外源海藻糖对啤酒酵母在热胁迫下的保护作用
2020-11-11王增妹王金晶郑飞云
王增妹 , 王金晶 , 李 磊 , 郑飞云 , 李 崎 *
(1. 江南大学 生物工程学院, 江苏 无锡 214122; 2. 江南大学 工业生物技术教育部重点实验室, 江苏 无锡214122)
啤酒酵母是啤酒酿造的灵魂。 啤酒酵母的生理状态通常通过活力和活性两个方面来评价。 细胞活性表示一个细胞群体中活细胞数占总细胞数的比例。 而细胞活力表示细胞的生理能力, 包括胞内ATP 含量、线粒体膜电位、酶活性等[1]。 在啤酒酿造过程中,啤酒酵母活力及活性的变化影响着诸多代谢物质的产生,如有机酸、高级醇、高级酯、醛类化合物等,进而影响啤酒的风味与成品质量[2]。 啤酒发酵结束后,企业通常将酵母泥回收,置于酵母储罐中。 在回收时,因罐内酵母泥稠密,难以实现良好散热,通常向酵母储罐中加入无菌水来降低酵母泥温度。 此后,酵母将被储存一段时间,直至下一轮发酵使用。 在这种营养匮乏的条件下,储存时间的延长与温度的升高会导致酵母在随后的发酵过程中发酵能力下降[3]。 同时,随着精酿啤酒的推广,市场上出现了越来越多的现酿啤酒吧。 在现酿啤酒生产过程中,同样存在着运输及储存酵母的需求。 在啤酒产量剧增的夏季,高温增加了酵母的运输和储存成本。 因此,无论对于大规模的啤酒工厂还是小规模的现酿啤酒吧来说,研究酵母对热胁迫的响应并提高酵母的耐热性都是十分重要的。
海藻糖是一种由两个葡萄糖通过α-1,1-糖苷键链接起来的非还原性二糖。 随着对海藻糖功能研究的深入,研究人员发现海藻糖对生物体的作用远不止于扮演碳源的角色[4]。 在某些生物体中,海藻糖可以作为信号分子,指导和控制代谢途径,或通过保护细胞膜和蛋白质实现在各类胁迫条件下对生物体的保护作用[5-8]。 海藻糖本身十分稳定,被视为抵抗各种胁迫环境的保护剂[9-10]。这种保护作用使海藻糖具有广泛的生物学功能,可用于对食物、酶制剂、疫苗、细胞等的保护上。 热胁迫是影响酵母发酵目标产物产量的重要影响因素之一,海藻糖对酵母耐热性的影响及其机制已经被广泛讨论[11-14]。 有报导指出,增加酵母胞内海藻糖含量可以使酵母耐热性增强,而这种作用与糖转运基因的上调有关[14]。也有研究人员认为,提升酵母耐热性的重要因素不在于海藻糖,而在于海藻糖合成途径上的Tps1 蛋白[12]。但对于外源海藻糖是否对啤酒酵母的耐热性起作用,目前尚未有文献报道。
作者通过向啤酒酵母储存坏境中添加海藻糖,探究外源海藻糖对啤酒酵母在热胁迫下的保护作用。
1 材料与方法
1.1 菌种
啤酒酵母 G-03(S. pastorianus):工业菌株,由作者所在实验室保藏。
1.2 培养基与试剂
YPD 培养基:葡萄糖 20 g/L,蛋白胨 20 g/L,酵母提取物10 g/L,加蒸馏水溶解,于115 ℃高温灭菌15 min。
0.5 mol/L 三氯乙酸溶液(TCA):称取 8.17 g 三氯乙酸用蒸馏水溶解,定容至100 mL。
80%浓硫酸: 将81.6 mL 98%的浓硫酸缓缓注入20 mL 蒸馏水中,防止飞溅。
蒽酮溶液: 称取0.2 g 蒽酮溶解至80%的硫酸中,定容至100 mL,蒽酮溶液需要新鲜配制。
亚甲基紫染液:参照文献[15]配制。
1 mg/mL 标准海藻糖溶液: 将海藻糖在105 ℃烘干至恒质量,准确称取10 mg 海藻糖,用蒸馏水定容至100 mL,获得质量浓度为0.1 mg/mL 的海藻糖溶液。
海藻糖溶液的配制: 称取 18.92、37.83、75.66 g海藻糖, 分别用蒸馏水溶解并定容到1 000 mL,制成浓度分别为50、100、200 mmol/L 的海藻糖溶液。
亚甲基紫、蒽酮、三氯乙酸:国药集团化学试剂有限公司;海藻糖:江苏省奥谷生物科技有限公司;BacTiter-GloTM Microbial Cell Viability Assay ATP检测试剂盒:Promega 公司;其他试剂:均为分析纯,生工生物工程(上海)股份有限公司。
1.3 仪器与设备
SWCJ-1Cu 双人无菌操作台: 苏州净化有限公司;AL104 电子天平:梅特勃-托利多仪器(上海)有限公司;SPX-250 生化培养箱:上海跃进有限公司;HPX-180BS-II 恒温恒湿培养箱: 上海新苗有限公司;Tecan Infinite®200 多功能酶标仪: 瑞士 Tecan公司;CX21 显微镜:日本OLYMPUS 公司;细胞振荡破碎仪及配套使用的破壁管和0.5 mm 玻璃珠:美国Biospec 公司;HVE-50 全自动高压蒸汽灭菌锅:日本HIRAYAMA 株式会社;TGL-16G 台式离心机:上海安亭科学仪器厂。
1.4 培养方法与胁迫条件
取一环斜面保存的G-03 酵母至10 mL YPD培养基,于28 ℃活化12 h,取活化好的酵母以1%的体积分数接种至400 mL YPD 培养基,28 ℃摇床培养 24 h。 参照王敏等[16]、许维娜等[17]的方法收集酵母泥。 将酵母泥分散到为 0、50、100、200 mmol/L 的海藻糖溶液中,控制菌浓在107cfu/mL。 于不同的胁迫温度下静置储存样品,检测指标前将样品混匀。
1.5 实验方法
1.5.1 酵母细胞活性测定方法 酵母细胞活性采用亚甲基紫染色法[15]。定时取样,将样品适当稀释后与亚甲基紫染液等量混匀, 进行染色,15 min 后用血球计数板镜检计数。 通过显微镜观察细胞,死细胞呈现紫色,活细胞为无色,记录细胞总数和活细胞数。
细胞活性=活细胞数/细胞总数×100%
1.5.2 基于ATP 含量的细胞活力测定方法[18]将收集的样品菌浓调整至106cfu/mL, 将样品用预冷无菌水洗涤3 次,5 000 r/min 离心3 min,去除上清液收集菌体,用无菌水将菌体重悬至原体积,取1 mL样品加入至破壁管中里,并加入(750±10) mg 直径为 0.5 mm 的玻璃珠, 振荡破碎仪上振荡1 min,共振荡5 次, 每次振荡结束后将样品置于冰上30 s。振荡结束后8 000 r/min 离心5 min 沉淀细胞碎片,取上清液。 破碎后的样品保持在冰浴上。
使用BactTiter-GloTM Microbial Cell Vitality Assay 试剂盒检测上清液中的ATP 含量, 参考试剂盒说明书。 取100 μL 上清液进行检测,检测条件为化学发光-发光光纤检测,读取化学发光值。 ATP 含量变化用相对含量表示,胁迫初始时的ATP 发光信号值记作100%。
1.5.3 酵母胞内海藻糖质量分数的测定 酵母胞内海藻糖用0.5 mol/L TCA 溶液提取,取3 mL 菌悬液于 5 mL 离心管中,12 000 r/min 离心 5 min,移除上清液。 使用预冷蒸馏水将菌体洗涤3 次后,用3 mL预冷的0.5 mol/L TCA 溶液重悬菌液,混匀。 室温放置 40 min 后 12 000 r/min 离心 5 min, 将上清液转移至10 mL 离心管中。 使用2 mL 预冷的0.5 mol/L TCA 溶液重悬菌体沉淀,重复提取一次。 将两次得到的上清液混合在一起即为海藻糖提取液,将提取液在冰浴上放置10 min。
海藻糖含量的测定采用蒽酮比色法[19]。 取1 mL海藻糖提取液放入25 mL 比色管, 加入4 mL 蒽酮溶液, 混匀。 沸水浴 10 min, 立即冷却 10 min,在620 nm 检测紫外吸光值。 空白样品为1 mL TCA 溶液。
标准曲线的绘制: 吸取不同体积0.1 mg/mL 的海藻糖标准液, 用蒸馏水稀释至不同质量浓度,制成不同质量浓度的海藻糖溶液。 用蒽酮比色法测定其吸光值,以吸光值为横坐标,各标准溶液质量浓度为纵坐标绘制标准曲线。 参照标准曲线计算样品胞内的海藻糖质量分数。 样品胞内海藻糖质量分数用mg/g 干质量细胞表示。
1.5.4 细胞干质量测定方法 细胞干质量的测定见国标[20]。
1.5.5 数据分析 实验数据通过Origin 9.0 绘制成图,每个点表示平行样品的均值及标准偏差。 通过SPSS 软件进行 ANOVA 分析及 T 检验,p<0.05 时认为差异具有显著性。
2 结果与分析
2.1 热胁迫下外源海藻糖对酵母活力的影响
按1.4 所述方法培养啤酒酵母24 h 后收集酵母细胞, 将收集的酵母置于 0、50、100、200 mmol/L的海藻糖溶液中, 在37、40、45 ℃高温环境下储存4 d,酵母基于ATP 相对含量的活力变化见图1。 由图1 可知,随着储存时间的延长,酵母胞内ATP 含量不断下降。 在37 ℃下,外源海藻糖的添加减缓了酵母胞内ATP 含量的下降速度。 37 ℃放置1 d 后,储存环境中未添加海藻糖的酵母胞内ATP 含量降低至起始时的5.66%, 此时,50 mmol/L 海藻糖溶液储存的酵母胞内ATP 含量降至起始时的36.91%。与未添加海藻糖的细胞相比,50 mmol/L 海藻糖溶液中酵母胞内ATP 含量提高6.52 倍, 当海藻糖浓度升高至100 mmol/L 时,与储存过程中未添加海藻糖的细胞相比, 海藻糖溶液储存的酵母胞内ATP含量提高了13.49 倍。 继续增加海藻糖浓度至200 mmol/L 时,与不添加海藻糖的细胞相比,海藻糖溶液储存的酵母的活力提高了14.93 倍。 在储存1 d 时, 不同浓度海藻糖对酵母细胞活力的影响有显著差别(p<0.05)。在第 2 天以后,200 mmol/L 的海藻糖与100 mmol/L 的海藻糖对胞内ATP 相对含量的影响没有显著性差别。 当胁迫温度提高至40 ℃时,与不添加海藻糖相比,添加海藻糖在一段时间内减缓胞内ATP 含量的下降速度。在40 ℃保存1 d后,酵母胞内ATP 含量降低至近乎为0,而50 mmol/L海藻糖溶液中,酵母胞内ATP 含量保持在初始值的41.44%。与37 ℃相比,40 ℃时3 种浓度的海藻糖的作用差别变小,50、100、200 mmol/L 的海藻糖溶液对胞内ATP 含量的影响相差不大。 在45 ℃热胁迫下,酵母胞内ATP 含量在1 d 之内下降至0。而此时外源海藻糖的添加并未使酵母活力提升。 可以看出,添加海藻糖在一定程度上可以减缓酵母细胞活力的下降速度,但随着热胁迫程度的增强,不同浓度的海藻糖对酵母活力的作用差别逐渐减小,且添加海藻糖对酵母活力的提升具有一定限度。 ATP 对细胞生命活动的重要作用已经被广泛研究,检测胞内ATP 含量的变化对理解酵母活力变化十分重要[1,18,21]。胞内 ATP 含量的下降会导致细胞器功能损伤,从而进一步造成ATP 含量的下降,形成恶性循环,ATP 含量下降是调控细胞死亡的一个重要原因[22]。 由此推测,添加海藻糖对酵母胞内ATP 含量下降速度的缓解将有助于阻止细胞活性快速下降。
2.2 热胁迫下外源海藻糖对酵母活性的影响
细胞活性变化是酵母耐热性能变化的直观体现,热胁迫下添加海藻糖对酵母细胞活性变化的影响,见图2。 与细胞活力的变化类似,随着热胁迫下储存时间的延长,酵母细胞活性逐渐下降,而添加海藻糖可以在一定程度上减缓活性下降速度。 如图2(a)所示,在37 ℃下,不同浓度海藻糖对酵母活性有不同程度提升。储存1 d 后,未添加海藻糖的酵母细胞活性降至 33%, 而在 50、100、200 mmol/L 的海藻糖溶液中, 酵母活性分别为64.85%、74.65%、86.4%。 与37 ℃相比,在40 ℃下,不同浓度海藻糖对酵母活性的作用差别减小,而当温度升高至45 ℃时,未添加海藻糖的酵母细胞活性在1 d 内即降为0,添加海藻糖后酵母细胞活性不再提升。 综合以上结果,添加海藻糖可以提高酵母耐热性,且在一定时间或温度范围内对活性和活力的提升程度随着海藻糖浓度的增高而提升,但外源海藻糖对酵母的保护作用具有一定限度的,超出这一限度后,海藻糖不再起到对酵母耐热性的提升作用。
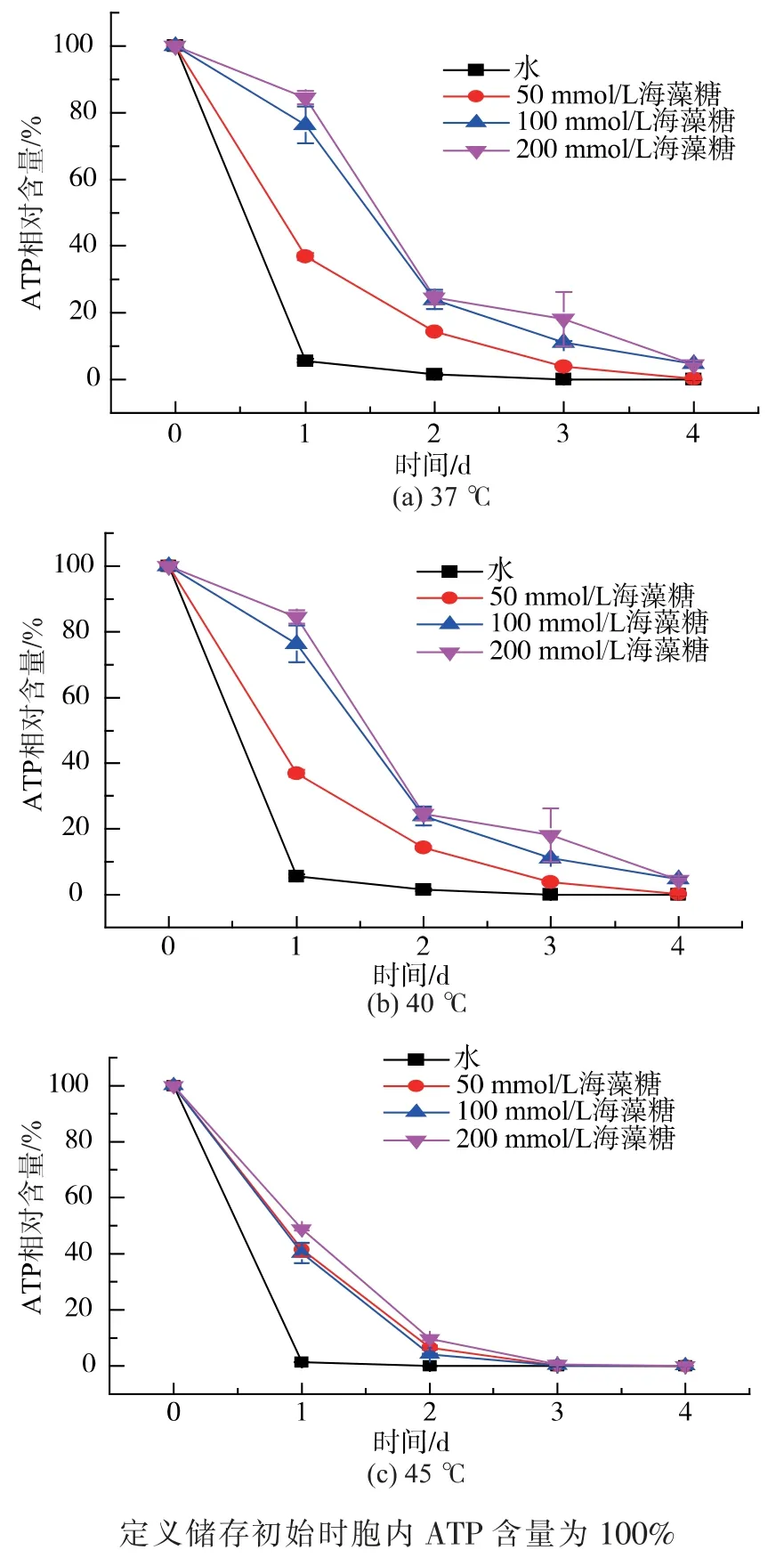
图1 热胁迫下外源海藻糖对G-03 活力的影响Fig. 1 Effect of exogenous trehalose on the vitality of G-03 under heat stress
2.3 添加海藻糖对酵母胞内海藻糖质量分数的影响
37 ℃是酵母耐热性研究中广泛使用的温度[12-13,23],为加深对热胁迫下外源海藻糖对啤酒酵母保护作用的理解,以37 ℃为例,探究添加海藻糖对啤酒酵母耐热性提升的机理。 由图 2(a)可知,37 ℃胁迫下1 d 后,酵母活性下降至33%,2 d 后活性基本为0。细胞完全丧失活性不利于探究外源海藻糖对酵母的保护作用及机理, 因此选取了处理1 d 的酵母细胞进行研究。 添加海藻糖对酵母胞内海藻糖质量分数的影响见图3。 不添加海藻糖在37 ℃下1 d 时,酵母胞内海藻糖质量分数从初始的28.58 mg/g 下降至2.58 mg/g,而此时添加海藻糖的酵母胞内海藻糖质量分数为11.89 mg/g。与不添加海藻糖相比,添加海藻糖使酵母胞内海藻糖质量分数显著提升(p<0.05)。 从中推断,热胁迫下外源海藻糖对酵母的保护作用可能是由于增加了胞内海藻糖质量分数引起的。

图2 热胁迫下外源海藻糖对G-03 活性的影响Fig. 2 Effect of exogenous trehalose on the viability of G-03 under heat stress

图3 37 ℃下添加海藻糖对酵母胞内海藻糖质量分数的影响Fig. 3 Effect of exogenous trehalose on intracellular trehalose contents at 37 ℃
2.4 37 ℃下转录组差异表达基因分析
为进一步了解外源海藻糖对啤酒酵母耐热性的提升作用机理, 采用转录组测序技术对37 ℃下不添加海藻糖的酵母细胞与添加50 mmol/L 海藻糖的酵母细胞进行比较,探究热胁迫下酵母细胞转录水平变化情况,选择差异倍数|log2(fold change)|>1和显著水平q value<0.05 的差异基因进行分析。 与不添加海藻糖的菌株相比,储存环境中添加海藻糖的菌株中有3 302 个基因相对稳定, 有2 505 个基因的调控模式发生变化,占基因总数的46%。 其中,有1 285 个基因转录水平上调,1 220 个基因转录水平下调。 由此可见,向储存环境中添加海藻糖后,啤酒酵母在储存过程中基因转录水平的变化规模较大。
2.5 37 ℃差异表达基因GO 功能分析
将差异基因根据不同的功能进行GO 功能注释及分类。 GO 功能分为 3 大类: 细胞组分(cellular component)、生物过程(biological process)及分子功能(molecular function)。 分类及统计结果见图 4。 在细胞组分包含的15 个亚分类中, 差异表达基因主要与细胞 (cell)、 细胞成分 (cell part)、 细胞器(organell)、细胞器成分(organelle part)有关,这 4 类功能占该大类的比例分别为95.67%、91.44%、81.65% 、52.55% 。 其 次 是 大 分 子 复 合 体(macromolecule complex)和膜(membrane),分别占比38.29%和37.52%。 在生物过程上的24 个亚分类中, 以细胞过程 (cellular process) 和代谢过程(metabolic process) 居多, 占该类别的比例分别为90.28%和77.8%, 其次是细胞组分组织和合成(cellular component organization or biogenesis) 及生物调控(biological regulation),分别占比 44.24%和34.14%。 在分子功能的11 个亚分类中,差异表达基因 主 要 与 结 合 (binding)、 催 化 活 性 (catalytic activity)有关,分别占该类别的64.45%和55.97%,其次是与结构分子活性(structural molecule activity)和转运活性(transporter activity),分别占比9.62%和9.45%。 在这些功能分类条目中,差异基因数目排名前三的功能分别为细胞、细胞成分、细胞过程3 个类别。
对富集结果进行进一步分类,通过有向无环图展示差异基因GO 富集分析结果。图中,分支代表包含关系, 从上至下所定义的功能范围越来越小,方框代表的是每个分类富集程度排名前5 的GO Term,颜色越深(红)表示富集程度越高。 在细胞组分的分类中,富集程度排名前5 的条目分别为核糖体 前 体 (preribosome)、 胞 质 核 糖 体 (cytosolic ribosome)、 核 仁 (nucleolus)、90S 核 糖 体 (90S preribosome)、 胞质大核糖体单元 (cytosolic large ribosomal subunit)。 在细胞过程的 GO 功能分类下面,富集程度排名前5 的条目分别为核糖体生物合成 (ribosome biogenesis)、rRNA 加 工 (rRNA processing)、 核 蛋 白 复 合 物 生 物 合 成(ribonucleoprotein complex biogenesis)、 质 膜 翻 译(cytoplasmic translation)、rRNA 代 谢 过 程(rRNAmetabolic process)。 在分子功能分类下面,富集程度排名前5 的条目分别为核糖体的结构组分(structural constituent of ribosome)、 核仁小 RNA 结合(snoRNA binding)、rRNA 结合 r(RNA binding)、氧化还原酶活性, 作用在醛或供体氧化基团(oxidoreductase activity,acting on the aldehyde or oxo group of donors)、氧化还原酶活性,作为受体作用 在 醛 、 供 体 、NAD 或 NADP 的 氧 化 基 团(oxidoreductase activity,acting on the aldehyde or oxo group of donors,NAD or NADP as acceptor)。 从中可以得出, 在GO 功能分类中, 富集程度最高的GO 条目主要与核糖体合成及相关功能有关。 转录组数据显示,这两条途径上的大部分差异基因发生上调。
2.6 37 ℃差异表达基因KEGG 通路分析
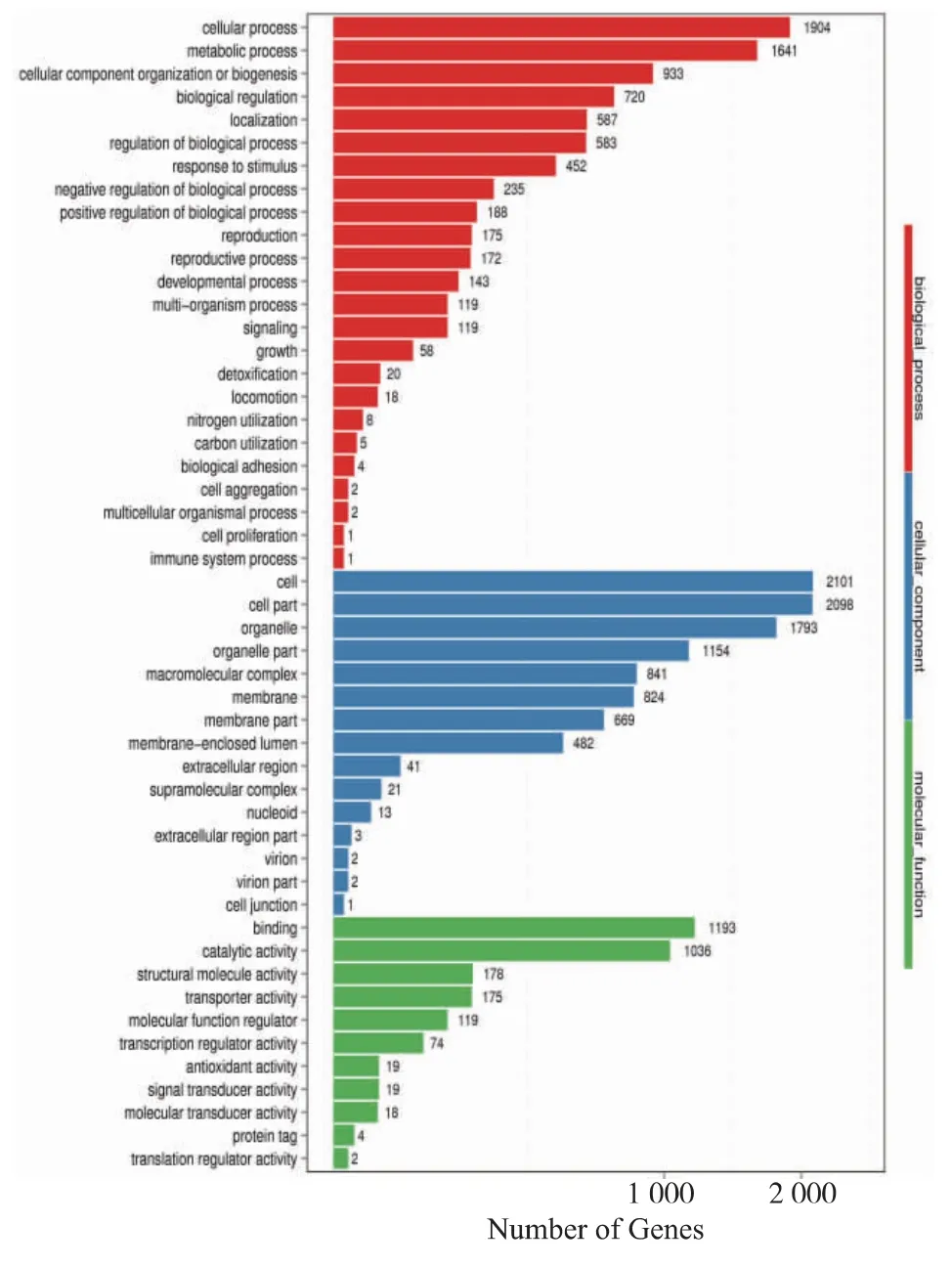
图4 差异基因GO 功能分类统计图Fig. 4 GO terms clustering analysis
为了解差异基因的生物学功能,对注释的后差异表达基因进行KEGG 通路富集分析。 有1 846 个差异基因被富集在301 条通路中,富集结果见图5。其中, 富集程度最显著的前10 个通路依次为核糖体 (Ribosome)、 真 核 生 物 核 糖 体 的 生 物 合 成(Ribosome biogenesis in eukaryotes)、糖酵解/糖异生(Glycolysis/ Gluconeogenesis)、 碳 代 谢 (Carbon metabolism)、 氨基酸的生物合成 (Biosynthesis of amino acids)、脂肪酸降解(Fatty acid degradation)、丙酮酸代谢(Pyruvate metabolism)、缬氨酸、亮氨酸和异亮氨酸的降解 (Valine,leucine and isoleucine degradation)、HIF-1 信 号 通 路 (HIF-1 signaling pathway)、组氨酸代谢(Histidine metabolism)。 其中,最显著的两条通路均与核糖体相关。 有研究指出,海藻糖对酵母的保护作用是由于海藻糖参与了诸多代谢途径,而并不仅仅是因为胞内海藻糖水平的上升[24]。结合本研究推测,外源海藻糖对啤酒酵母耐热性的增强可能是外源海藻糖的添加使酵母胞内海藻糖质量分数上升,上升的胞内海藻糖质量分数促进了诸多代谢途径,主要是参与核糖体合成的相关代谢途径,使核糖体功能得到增强,进而实现对啤酒酵母活力及活性的提升。

图5 差异基因Pathway 富集结果Fig. 5 KEGG Pathway analysis
X 轴代表富集因子值,Y 轴代表通路名称。颜色代表qvalue(颜色越白值越大,越蓝值越小),值越小代表富集结果越显著。 点的大小代表DEG 数目(点越大代表数目越大, 越小代表数目越少)。 Rich Factor 指的是富集因子值, 是注释上某一通路的前景值(差异基因个数)与注释上某一通路的背景值(所有基因个数)之商,数据越大,说明富集结果越明显。
3 结 语
外源海藻糖可以提高酵母耐热性,这种保护作用具有一定限度,随着温度的升高和胁迫时间的增加,不同浓度的外源海藻糖对酵母活力和活性影响的差异减小。 外源海藻糖的添加导致酵母胞内海藻糖质量分数上升并影响多条代谢途径,主要促进了核糖体的合成及功能相关途径。 推测外源海藻糖对啤酒酵母耐热性增强的作用机理是外源海藻糖导致酵母胞内海藻糖质量分数上升,促进核糖体相关代谢,增强核糖体的合成和功能,进而提高啤酒酵母细胞的活力和活性。 在后续工作中,希望通过分析37 ℃下核糖体组分和功能的变化,进一步探究热胁迫下外源海藻糖对啤酒酵母的保护作用机理。
