灵杆菌胞外核酸酶在短短芽孢杆菌中的高效表达
2020-11-11龚雪梅胡艳红陈银霜程睿婕张坤晓
龚雪梅 , 胡艳红 , 陈银霜 , 程睿婕 , 张坤晓 *
(1. 江苏海洋大学 江苏省海洋生物资源与环境重点实验室, 江苏 连云港 222005;2. 江苏海洋大学 江苏省海洋药物活性分子筛选重点实验室,江苏 连云港222005;3. 江苏海洋大学 江苏省海洋生物产业技术协同创新中心,江苏 连云港 222005)
核酸污染是重组蛋白类生物药物制备过程中存在的一个重大问题,残留的核酸同药物一起注入患者体内可能会产生不可预估的后果,存在导致人体基因组DNA 突变的潜在风险。 因此,核酸残留量是重组蛋白药物质量的一个重要评价指标[1],如何去除重组蛋白药物中残留的宿主核酸是提高该类药物安全性的一个关键问题。 目前常用的核酸去除方法有物理法、层析法以及核酸酶法,前两种方法所需的仪器设备昂贵, 且不适用于大规模去除核酸;利用核酸酶的高效性来降解核酸是除去蛋白质中宿主核酸残留的最理想方法[2]。 目前市场上商品化的非特异性核酸酶主要是Benzonase,由德国默克公司开发,纯度高、活性好,但因其重组表达难度大、价格昂贵,限制了其在生物制药行业的大规模应用。 基于目前的市场需求,开发新的非特异性核酸酶生产工艺具有重要的应用价值。
Benzonase 核酸酶是一种来自灵杆菌的非特异性核酸内切酶(Serratia marcescens non-specificnuclease,SMNE),含有245 个氨基酸,相对分子质量约30 000,由两条相同的单肽链组成同源二聚体[3-5]。 SMNE 能在较为宽泛的温度(35~44 ℃)和pH 范围(pH 6~10)内降解所有形式(包括单链、双链、线性、环状和超螺旋)的DNA 和RNA,将核酸完全消化成2~5 bp碱基长度的寡核苷酸[6-7],具有很高的降解效率。 有研究表明,其降解效率是金黄色葡萄球菌核酸酶的4 倍,是商品化 DNase I 的 34 倍[8]。 SMNE 能有效去除蛋白质样品中的核酸污染,还可降低蛋白质样品粘度、减少处理时间、增加蛋白质产量,这些性质使其成为生物制药过程中的最佳选择。
由于SMNE 能高效降解核酸,在体内大量表达会导致宿主死亡,对其重组表达及制备带来很大挑战。默克公司最早利用大肠杆菌W3110 菌株对其进行重组表达,通过分泌到大肠杆菌的周质腔中成功获得重组蛋白质, 然而大肠杆菌分泌能力有限,最终产量仅104U/L[9]。 其后有研究者利用大肠杆菌LK111(λ)菌株,通过形成包涵体的方式对SMNE 进行胞内表达,其后通过繁琐耗时的复性纯化方式得到10 mg/500 mL 的产量[10]。 国内的研究人员为了解决这一问题尝试了多种方法。 张开俊课题组通过构建分泌型载体 pET-20b(+),于 BL21(DE3) pLyss中进行诱导表达,表达量为8 mg/L[11]。 2011 年,陈鹏课题组将 SMNE 与融合在载体pMAL-c4X 上的MBP 共表达, 其在胞内的可溶性表达量为10 mg/L[12]。由此看来,利用大肠杆菌表达体系对SMNE 进行重组表达始终存在着产量不足的问题,寻找更适合SMNE 的表达系统, 提高其产量是促进SMNE 工业化应用的关键。
短短芽孢杆菌(Brevibacillus choshinensis)具有较强的蛋白质分泌能力, 且胞外蛋白酶活性低,是用于分泌蛋白质表达的理想宿主。 该表达系统蛋白质产量显著高于其他芽孢表达系统,在最佳的培养条件下短短芽孢杆菌的产量可以达到30 g/L[13]。 此外,该体系有一系列分子伴侣能够促进外源蛋白质在分泌过程中形成具有活性的构象[14]。 目前已成功表达出干扰素[15]、表皮生长因子[16]、抗体[17-18]、淀粉酶[19]等多种医疗及工业用酶。然而,利用该系统表达毒性蛋白的相关报道较少。 本研究首次尝试采用短短芽孢杆菌 HPD31-SP3 进行SMNE 高效重组表达,利用自身细胞壁蛋白质相关表达元件,构建分泌型表达穿梭载体, 优化发酵条件, 实现了SMNE在芽孢杆菌中高效可溶性重组表达 (bSMNE)。 同时,SMNE 在短短芽孢杆菌中的成功表达,也为其他核酸酶在该系统的表达提供了参考依据。
1 材料与方法
1.1 材料
1.1.1 菌株和质粒 大肠杆菌(E.coil JM109):购自Invitrovgen 公 司 ; 短 短 芽 孢 杆 菌 (Brevibacillus choshinensis HD31-SP3):购自 TaKaRa 公司。 重组质粒pET28b-SMNE: 作者所在实验室构建,SMNE的GenBank 序列登录号为WP_101426767.1; 芽孢杆菌-大肠杆菌穿梭质粒pNC-HisT: 购自TaKaRa公司。
1.1.2 主要试剂与仪器 限制性内切酶(XbaI、HindIII 等)、PCR Mix(Taq、Fast Taq 等)、无缝克隆试剂盒Hi-Fusion Mix 以及抗生素(氨苄青霉素、硫酸新霉素等):购自莫纳生物科技有限公司;质粒小量提取试剂盒、DNA 凝胶回收试剂盒: 购自Omega公司;鲑鱼精DNA:购自Amersco 公司;色谱层析基质:购自Toyopearl 公司;蛋白质相对分子质量标准品:购自金斯瑞生物科技有限公司;其他试剂:分析纯,购自国药集团化学试剂有限公司或进口;凝胶成像仪:购自上海勤翔科学仪器有限公司;酶标仪:Synergy Neo2 Muti-mode reader: 购自 Bio-Tek 公司; 高速冷冻离心机: 购自 J-26S XP (BECKMAN COULTER)公司;恒温细胞培养摇床:购自Innova 44R(Eppendorf)公司;高压破碎仪:购自广州聚能生物科技有限公司。
1.1.3 培养基 T2 培养基(g/L):葡萄糖 10,蛋白胨 10,牛肉浸膏 5,酵母膏 2;LB 培养基(g/L):蛋白胨 10,酵母膏 5,氯化钠 10。 T2G 培养基在 T2 培养基的基础上加入体积分数5%甘油。
1.2 方法
1.2.1 重组质粒 pNC-HisT-SMNE 的构建与转化以质粒 pNC-HisT 为载体, 使用 XbaI 和 HindIII 进行双酶切,酶切产物胶回收备用。 根据无缝克隆原理设计并合成引物 1:5′-GGATCCGTCGATCTAGA CATGGACACGCTCGAATCC-3′和引物 2:3′-CTAT AATGCCGAAGCTTTTAGTTTTTGCAGCCCATGAG -5′,以 pET28b-SMNE 质粒为模板,用引物 1 和引物2 扩增出SMNE 编码基因片段,PCR 产物回收后,使用Hi-Fusion 无缝克隆试剂盒, 将SMNE 基因片段与线性化的pNC-HisT 载体进行连接, 并转入大肠杆菌 JM109。 使用引物 3:5′-GCAACTTTTGATTCG CTCAGGCGTTTAATA-3′和引物 4:3′-GCAATTGG ACACCAAATGGTGTTACTTTG-5′, 通过菌落 PCR验证阳性转化子。 挑选鉴定为阳性的转化子,使用LB 培养基37 ℃培养16 h 后提取质粒,测序验证正确的质粒再经电击转化法转入短短芽孢杆菌感受态细胞。电击转化方法如下:从-80 ℃中取出制备好的感受态, 将菌液握化于手心,4 500 g、4 ℃离心45 s,在超净台中移去上清液,用等体积的PEG 缓冲液悬浮细胞, 加入适量重组质粒pNC-HisTSMNE 混匀后直接电击。 电击完毕立即加入800 μL MT 培养基,37 ℃振荡培养 1.5 h 后涂布含 75 μg/mL新霉素的琼脂糖平板。阳性转化子经菌落PCR 和提质粒测序两种方法鉴定,并保留菌液进行后续实验。
1.2.2 bSMNE 的表达条件 筛选及纯化对短短芽孢杆菌的阳性转化子进行小量活化,24 h 后取样离心收集上清液, 以如下体系进行粗酶活测定:3 μg λDNA,50 mmol/L Tris-HCl,1 mmol/L MgCl2,pH 8.0;3 μL 上清液,无菌水将体系补充至 50 μL。 37 ℃温育5 min 后通过凝胶电泳检测λDNA 消化程度。 选择活性较好的菌株在T2 培养基中进行小量活化,再按照1∶50 的比例扩大发酵,并进行3 次生物学重复。 24、27、30、37 ℃不同发酵条件下 120 r/min 持续培养60 h 后取上清液测定菌密度A600及上清液活性。 之后在T2 培养基中加入体积分数5%的甘油在120 r/min、30 ℃下持续培养 60 h 为实验组, 不加甘油为对照组,同样测定菌密度和培养上清液中目的蛋白质活性以确定最佳表达条件。 最后,根据最佳发酵条件30 ℃、120 r/min, 以同样的检测参数确定目的蛋白质最佳发酵时长, 并设计含pNC-HisT 空载体的菌株作为对照组。
发酵结束后经10 000 g、4 ℃离心30 min 收集发酵上清液。 含有重组核酸酶bSMNE 的上清液组分经过 Ni2+亲和层析初步纯化 (Toyopearl AFChelate-650M,自填 1.25 cm×8 cm,共 15 mL)和凝胶阻滞层析进行精细纯化 (Hiload 16/200 Superdex 200 pg,GE Healthcare;120 mL)。 Ni2+亲和层析过程中使用的缓冲液成分如下: 平衡缓冲液1×PBS,体积分数5%甘油,5 mmol/L 咪唑; 漂洗缓冲液 1×PBS,体积分数5%甘油,30 mmol/L 咪唑;洗脱缓冲液 1×PBS,体积分数 5%甘油,200 mmol/L 咪唑。 凝胶阻滞层析使用的缓冲液成分如下:100 mmol/L Tris-HCl,100 mmol/L KCl,0.2 mmol/L EDTA, 2 mmol/L DTT,pH 8.0。 含有 bSMNE 的洗脱峰合并后,加入等体积甘油,长期保存于-20 ℃,整个纯化过程保持低温。 蛋白质质量浓度使用Bradford 法,以BSA 为标准品绘制标准曲线进行计算。
1.2.3 bSMNE 的酶活测定 根据 GB/T 34801-2017 中脱氧核糖核酸酶活力检测方法对酶活进行定义。 将商业化重组SMNE 为标准品绘制标准曲线,设计不加底物和不加酶液的相同体系作为对照组,并在检测后作为背景值被减除,使用96 孔板在BioTek Synergy Neo2 酶标仪中检测反应液每分钟在260 nm 处的吸光值变化,连续监测10 min。 将上述纯化得到的bSMNE 进行梯度稀释, 使用相同的方法检测260 nm 吸光值变化, 根据标准曲线及稀释倍数计算bSMNE 的活性。 在SMNE 最适的反应条件下,1 min 内能够引起A260值变化0.001 的酶量定义为1 U。 使用OriginPro2017 软件处理分析数据。
1.2.4 温度及pH 对 bSMNE 活性的影响 根据1.2.3 描述的活性测定方法, 在4~85 ℃范围内,以10 ℃为梯度,对 bSMNE 进行活性测定。 在 pH 对活性影响测试中,以2 mol/L HCl 和2 mol/L NaOH 对基础pH 进行调节,检测bSMNE 在pH 4~11 范围内的活性。 使用OriginPro2017 软件处理分析数据。
1.2.5 盐离子浓度对bSMNE 活性的影响 根据1.2.3 描述的活性测定方法, 测试从50~400 mmol/L范围内, 以 100 mmol/L 为梯度检测 Na+/K+对bSMNE 活性的影响。 此外,以每 1 mmol/L 为梯度,测试 1~10 mmol/L 范围内 Mg2+/Mn2+对 bSMNE 活性的影响。 使用OriginPro2017 软件处理分析数据。
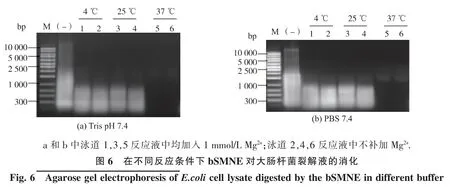
1.2.6 bSMNE 应用于细胞破碎液的核酸消化试验将培养所得的大肠杆菌JM109 离心后称质量,按照质量比1:5 的比例用缓冲液重悬后破碎。 将上述纯化得到的重组bSMNE 按照100 U/mL 细胞破碎液的比例加入到细胞破碎液样品中,选择pH 同为7.4的Tris 缓冲体系和PBS 缓冲体系重悬并破碎的两组细胞破碎液样品进行测试。实验组1 为1 mmol/L Mg2+时,bSMNE 在 4、25、37 ℃下分别消化两组细胞破碎液 30 min; 实验组 2 为不存在 Mg2+时,bSMNE在4、25、37 ℃下对分别消化两组细胞破碎液30 min,结果经琼脂糖凝胶电泳检测分析。
2 结果与讨论
2.1 bSMNE 的构建与表达
尽管在理论上利用芽孢杆菌系统进行核酸酶等毒性蛋白质的表达具有优势,但该系统相较于大肠杆菌表达体系存在转化效率较低的问题,重组表达载体构建难度较大。 因此,作者选择大肠杆菌-芽孢杆菌穿梭质粒pNC-HisT 作为重组表达载体,先在大肠杆菌中完成SMNE 基因的克隆,然后再转入到短短芽孢杆菌中进行重组表达。 穿梭质粒pNCHisT 基本元件见图1(a)。不同的抗性筛选标记便于分别在大肠杆菌和短短芽孢杆菌中进行筛选。 首先利用无缝克隆原理将SMNE 基因片段与线性化的pNC-HisT 载体进行连接, 转化入大肠杆菌感受态细胞,挑选10~12 个转化子进行菌落PCR 鉴定。 如图 1(b)所示,阳性转化子“1”和“2”的扩增片段大小约 1 200 bp,与预期的理论大小(1 216 bp)一致。 随后将阳性转化子送公司测序, 确认构建正确无误后,转化入短短芽孢杆菌感受态细胞,得到的转化子同样进行菌落PCR 验证,挑选阳性转化子进行后续实验。
在短短芽孢杆菌表达系统中,不同阳性转化子的表达效率和产物活性差别较大,因此在构建完成后, 作者选取5~7 个阳性转化子分别进行活化,提取其上清液初步测定酶活, 筛选酶活高的转化子。不同转化子在相同时间内对λDNA 的消化程度不同: 消化程度越高, 条带残留量越低, 结果见图1(c)。 泳道 1、2、3 中几乎没有 λDNA 条带的残留,消化效果明显,因此选择泳道1、2、3 对应菌株进行后续实验。
2.2 bSMNE 表达条件的优化
虽然B.choshinenesis SP3 系统具有优异的分泌异源蛋白质的能力,但对于不同类型的外源蛋白质表达,其培养条件也不尽相同。 作者首先对发酵温度进行了筛选,结果见图 2(a)。 在 24 ℃和 27 ℃下bSMNE 活性较低,菌体量也较少,表明短短芽孢杆菌的生长在此温度条件下受到一定抑制,外源蛋白质的表达活性也受到影响。 在30 ℃和33 ℃培养条件下,尽管菌体量无明显提高,但bSMNE 活性明显增强,尤其是在30 ℃发酵温度下,bSMNE 的活性最高,后续实验选择30 ℃作为最适发酵温度。
短短芽孢杆菌有相对较长的培养周期,通常在48 h 以上,且利用该系统表达出的蛋白质直接外泌至培养基中, 因此目的蛋白质在长时间培养过程中,缺乏有效保护,容易受到诸如菌体代谢引起培养基pH 变化等不利因素的影响。 在一些B.choshinenesis SP3 重组表达的研究中, 研究者发现氨基酸(尤其是脯氨酸)对外源蛋白质的表达表现出明显的促进作用, 其他添加剂诸如TWEEN[20]、山梨醇[21]对外源蛋白质也有一定的保护作用。另外,甘油作为润滑剂,在菌体培养过程中能够减少菌体间由于摩擦引起的细胞损伤, 并且甘油亲水性极佳,在培养基中能够结合大量的水,从而稳定蛋白质。 因此加入体积分数5%甘油到发酵培养基中,试图探究其对于外源蛋白质的表达是否有积极作用。结果如图2(b)所示:与不含甘油的培养物相比,加入体积分数5%甘油使bSMNE 蛋白质活性增加6倍。 然而甘油对B.choshinenesis SP3 的生长并没有明显的促进作用,菌体量没有显著增加,推测甘油促进bSMNE 蛋白质在培养基中积累的原因与酵母利用甘油作为碳源来促进蛋白质生成的机制不同,可能主要通过物理作用稳定外源蛋白质在培养基中的状态,从而在经过较长的培养时间后仍能获得理想的活性蛋白质。
最后, 对bSMNE 在短短芽孢杆菌中的生长曲线进行了监测,以确定其最优培养时间。 如图2(c)所示,菌体密度在32 h 时进入平稳期(A600=2.187 4)并维持超过40 h。 然而,bSMNE 的活性在培养56 h后达到最高,随后呈下降趋势。综上,确定的bSMNE最佳发酵条件是在T2G 培养基中于30 ℃下培养56 h。
2.3 bSMNE 的纯化与活性测试

图2 bSMNE 表达条件的优化Fig. 2 Optimization of protein expression conditions
bSMNE 重组蛋白质纯化流程见图 3(a),是该表达系统经典的纯化流程之一。 对离心后收集的上清液进行色谱层析纯化, 利用重组bSMNE 上所带的6xHis 标签, 使用Ni2+亲和层析富集上清液中的bSMNE,通过咪唑竞争性洗脱。经Ni2+亲和层析纯化后,重组 bSMNE 纯度已经达到 90%以上(图 3(b))。最后对洗脱液富集后再进行凝胶阻滞层析。 如图3(c)和表 1 所示,经凝胶阻滞层析后,bSMNE 纯度及比活力并没有明显提高,且回收率有所下降,最终回收率为84%,经Bradford 法检测蛋白质质量浓度仅为 0.12 mg/mL。上述结果显示:在B.choshinenesis中重组表达SMNE, 仅需一步亲和层析就能获得高比活目的蛋白质,纯化流程中的最后一步凝胶阻滞层析可略去。 纯化后的bSMNE 以商业化酶活定义标准进行酶活测定。 将3 种商业化Benzonase 按其标称酶活梯度稀释后,消化底物,检测实际的260 nm吸光值变化,绘制标准曲线,3 种商业化酶的标准曲线基本完全吻合,见图4,可以用来测定酶活。因此,将重组表达的bSMNE 梯度稀释后,在相同体系下,检测260 nm 吸光值变化,见表2,并与标准曲线比较。 经计算 bSMNE 比活力可达 1.3 × 107U/mg,相较在大肠杆菌系统中表达的商业化酶提高了2~3倍。 这一结果证实短短芽孢杆菌B.choshinenesis SP3 在表达bSMNE 上更具有优势。分析其原因主要有: 其一,SMNE 本身是一种胞外分泌型核酸酶,因此短短芽孢杆菌表达系统作为一种胞外分泌表达系统,相对胞内表达,更容易使SMNE 形成正确的活性构象,更易获得比活力高的蛋白质;其二,本实验使用的表达载体是用芽孢杆菌内源细胞壁蛋白质信号肽取代了SMNE 自身来源的信号肽,并使用芽孢杆菌细胞壁蛋白质基因的特异型启动子P2,这样有利于芽孢杆菌进入对数生长期后, 外源SMNE基因实现高效转录,从而使SMNE 蛋白质在随后较长的稳定期得以大量积累。
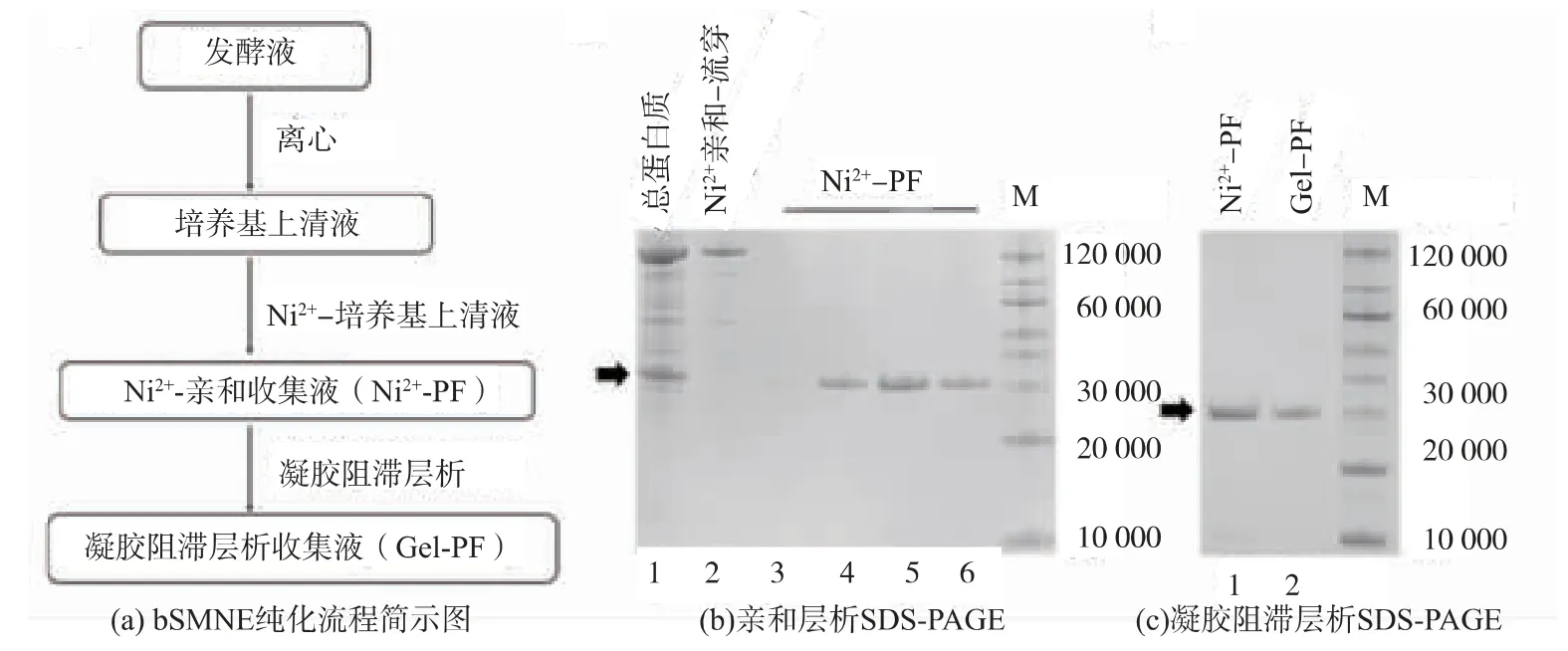
图3 bSMNE 纯化流程及SDS-PAGE 分析Fig. 3 Purification of bSMNE and SDS-PAEG analysis of the purification of bSMNE

表1 bSMNE 纯化流程中蛋白质质量、比活力、纯度及回收率Table 1 The amount of bSMNE,specific activity,purity and recovery during each process
2.4 bSMNE 在不同条件下活性测试
2.4.1 不同温度及pH 对bSMNE 活性的影响 对不同温度及pH 条件下bSMNE 的活性进行了检测。分别以37 ℃和pH 8.0 下的活性作为100%酶活标准, 计算不同温度或pH 值下bSMNE 的相对活性。在不同温度下的活性见图5(a)。 在低温条件下(4~25 ℃),bSMNE 仅有 8%~20%的活性;37 ℃达到最佳酶活,在45 ℃时酶活还可以保持80%以上;之后随着温度继续提高活性逐渐下降, 在85 ℃时仅存12%左右的活性。而不同pH 值下的活性变化见图5(b)。 pH 5 以下几乎无活性,pH 6~7 时 bSMNE 活性仅为标准活性的9%~25%,最适pH 区间为8~9。


图4 bSMNE 活性测试Fig. 4 Activity analysis of bSMNE

表2 bSMNE 梯度稀释表及相应的ΔA260 值Table 2 The dilution ratio and ΔA260 value of bSMNE
2.4.2 不同盐离子条件对bSMNE 活性的影响 作者检测了不同浓度的Mg2+和Mn2+两种二价阳离子,以及Na+和K+的两种一价阳离子对重组bSMNE 活性的影响。 如图 5(c)所示,bSMNE 在没有二价阳离子存在时仍然保持有47%的活性; 随着Mg2+/Mn2+的加入, 其活性快速上升; 但1 mmol/L 以上浓度的Mg2+/Mn2+对bSMNE 活性不再有继续促进作用。 另外,Mg2+对 bSMNE 酶活促进效果相对Mn2+较好,相同浓度的 Mn2+条件下,bSMNE 活性仅为 Mg2+的80%。 而对于一价阳离子而言, 如图 5 (d) 所示,bSMNE 在300 mmol/L Na+/K+条件下仍然保持35%~45%活性。 该结果表明,在 B.choshinenesis SP3 中重组表达的bSMNE 表现出了更广的一价阳离子适应性。
2.5 不同缓冲体系对bSMNE 活性的影响
不同缓冲体系下bSMNE 的活性表现, 能体现该酶的应用潜力,因此作者检测了在不同缓冲体系下bSMNE 对大肠杆菌裂解液的消化能力。 如图6所示,Mg2+对bSMNE 消化裂解液的能力并没有明显影响, 这可能是因为大肠杆菌胞内本身存在Mg2+,随着高压破碎后一并溶解在破碎液中。 在Tris 和PBS 缓冲体系中,bSMNE 的活性并无明显差异,4 ℃和25 ℃条件下bSMNE 的消化能力远低于37 ℃。该结果与之前实验结果相符。
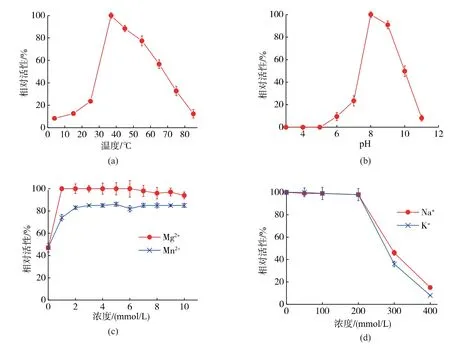
图5 不同条件对bSMNE 活性的影响Fig. 5 Effects of different conditions on activity
3 结 语
本研究使用短短芽孢杆菌表达系统成功实现了SMNE 的重组表达,并通过优化发酵条件获得较为理想的目标蛋白质。该蛋白质最适发酵条件为30 ℃下发酵56 h,最适发酵培养基为T2G 培养基。 在该系统中, 通过一步亲和层析即可获得30~40 mg/dL的目的蛋白质,产量可达109U/L,远高于大肠杆菌中106U/L 的产量。 本研究为后续利用短短芽孢杆菌表达系统实现SMNE 的大规模发酵提供了基础,同时也为其他核酸酶的重组表达提供了新的思路。
