联合检测EB 病毒不同抗体及其DNA 诊断鼻咽癌的价值
2020-11-09李旌
李旌
鼻咽癌属于肿瘤科临床常见的一种恶性肿瘤疾病,是危害人类身体健康的重要疾病之一,其发病率在头颈部肿瘤疾病中居于首位[1,2]。另外,鼻咽癌的转移性与侵袭性比较强,目前在世界各地均呈现出广泛流行趋势[3]。为了分析血清EB 病毒Rta-IgG、EA-IgA、VCA-IgA 以及EBV-DNA 联合检测对鼻咽癌的诊断价值,现将本院2017 年12 月~2019 年12 月收治的50 例鼻咽癌患者纳为研究样本,现报告如下。
1 资料与方法
1.1 一般资料 选择2017 年12 月~2019 年12 月本院收治的50 例鼻咽癌患者作为研究组,其中男27 例,女23 例;年龄30~78 岁,平均年龄(48.45±10.74)岁;疾病类型:根据TNM 分期将Ⅰ期和Ⅱ期作为早期鼻咽癌,Ⅲ期和Ⅳ期作为晚期鼻咽癌,其中Ⅰ期鼻咽癌4 例,Ⅱ期鼻咽癌6 例,Ⅲ期鼻咽癌21 例,Ⅳ鼻咽癌19 例。同期选择49 例鼻咽相关疾病患者作为观察组,其中男25 例,女24 例;年龄30~79 岁,平均年龄(48.66±10.34)岁;疾病类型:鼻息肉14 例,鼻出血1 例,耳鸣1 例,慢性耳源性眩晕1 例,耳炎3 例,淋巴瘤9 例,鼻炎12 例,头颈部肿瘤8 例。同期选取52 例健康体检人员作为对照组,其中男28 例,女24 例;年龄30~79 岁,平均年龄(48.57±10.62)岁;52 例健康体检人员均无鼻咽癌或鼻咽相关疾病。三组性别、年龄等一般资料比较差异无统计学意义(P>0.05),具有可比性。
1.2 方法 检测Rta-IgG 选择北京同昕生物技术有限公司生产的试剂盒,检测EA-IgA 与VCA-IgA 选择德国欧蒙实验诊断有限公司生产的试剂盒,仪器采用TECAN 全自动酶免分析仪。检测EBV-DNA 选用美国的ABI7500 实时荧光定量聚合酶链式反应(PCR)仪和EB 病毒核酸PCR 扩增试剂盒。在检测过程中将3 ml静脉血在EDTA 抗凝真空管与分离胶促凝管静置30 min,然后2500×g 离心5 min,对血清和血浆进行分离,保存-20℃待检[4]。采用酶联免疫吸附剂测定(ELISA)法检测,所有操作均根据试剂说明书进行。
1.3 观察指标及判定标准 比较三组检测结果及研究组不同分期、不同疗效检测结果。阳性诊断标准:Rta-IgG 试剂检测标本吸光度A 值/临界值≥1[5];EA-IgA 与VCA-IgA 试剂检测标本吸光度A 值/临界值≥1.1[6]。临界值按照说明书提供的算法CO(Cut Off)=0.05+阴性对照的读数平均值,若阴性对照<0.05,则按0.05 计算[7]。结果采用rA 值(相对A 值)。采用荧光定量PCR 检测血浆EBV-DNA,扩增与检测等相关操作都严格按照试剂说明书完成[8]。阳性标准:采用自动分析软件对PCR 扩增结果进行分析,EBVDNA>5×102copies/ml 为阳性[9,10]。研究组全部患者疗效评价按照PR 和CR 动态观察其相关指标。
1.4 统计学方法 采用SPSS20.0统计学软件对研究数据进行统计分析。符合正态分布的计量资料以均数±标准差()表示,采用t 检验;不符合正态分布的计量资料以中位数表示,采用秩和检验;计数资料以率(%)表示,采用χ2检验。P<0.05 表示差异具有统计学意义。
2 结果
2.1 三组VCA-IgA、EA-IgA、Rta-IgG 与EBV-DNA检测结果比较 研究组VCA-IgA、EA-IgA、Rta-IgG的rA 值和EBV-DNA 中位数分别为(2.41±3.44)S/CO、(2.65±3.38)S/CO、(4.23±5.81)S/CO、7500 copies/ml,观察组分别为(0.87±1.21)S/CO、(0.35±0.54)S/CO、(0.51±1.32)S/CO、82 copies/ml,对照组分别为(0.46±0.55)S/CO、(0.37±0.84)S/CO、(0.36±1.02)S/CO、66 copies/ml。研究组Rta-IgG、EA-IgA、VCA-IgA 的rA 值和EBV-DNA 中位数均高于观察组、对照组,差异具有统计学意义(P<0.05);观察组VCA-IgA 的rA值高于对照组,差异具有统计学意义(P<0.05);观察组Rta-IgG、EA-IgA 的rA 值和EBV-DNA 中位数与对照组比较,差异无统计学意义(P>0.05)。研究组Rta-IgG、EA-IgA、VCA-IgA 和EBV-DNA 检测阳性率均高于观察组、对照组,差异具有统计学意义(P<0.05);观察组VCA-IgA 检测阳性率高于对照组,差异具有统计学意义(P<0.05);观察组Rta-IgG、EA-IgA、EBV-DNA 检测阳性率比较差异无统计学意义(P>0.05)。见表1。
2.2 不同分期鼻咽癌患者Rta-IgG、EA-IgA、VCAIgA 与EBV-DNA 检测结果比较 Ⅰ期、Ⅱ期患者Rta-IgG、EA-IgA、VCA-IgA 的rA 值与EBV-DNA 中位数均低于Ⅲ期、Ⅳ期,差异具有统计学意义(P<0.05);Ⅰ期、Ⅱ期患者Rta-IgG 与EBV-DNA 检测阳性率均低于Ⅲ期、Ⅳ期,差异有统计学意义(P<0.05)。见表2。
2.3 不同疗效鼻咽癌患者治疗前后EBV-DNA、Rta-IgG、EA-IgA 与VCA-IgA 检测结果比较 CR、PR 患者治疗前后Rta-IgG、EA-IgA、VCA-IgA 的rA 值组间及组内比较差异均无统计学意义(P>0.05)。CR、PR患者治疗前EBV-DNA 中位数比较差异无统计学意义(P>0.05);CR、PR 患者治疗后EBV-DNA 中位数均低于治疗前,差异具有统计学意义(P<0.05);CR 患者治疗后EBV-DNA 中位数低于PR 患者,差异具有统计学意义(P<0.05)。见表3。

表1 三组Rta-IgG、EA-IgA、VCA-IgA 与EBV-DNA 检测阳性情况比较[n(%)]
表2 不同分期鼻咽癌患者Rta-IgG、EA-IgA、VCA-IgA 与EBV-DNA 检测结果比较[,n(%)]
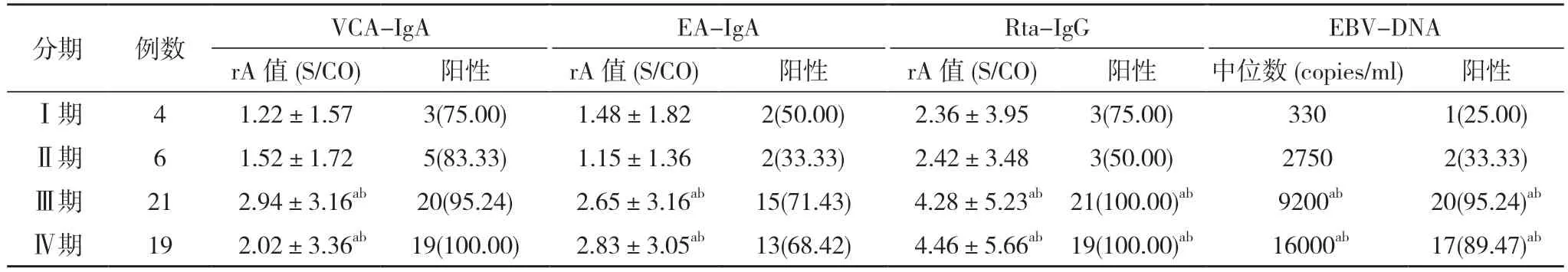
表2 不同分期鼻咽癌患者Rta-IgG、EA-IgA、VCA-IgA 与EBV-DNA 检测结果比较[,n(%)]
注:与Ⅰ期比较,aP<0.05;与Ⅱ期比较,bP<0.05
表3 不同疗效鼻咽癌患者治疗前后EBV-DNA、Rta-IgG、EA-IgA 与VCA-IgA 检测结果比较(,M)
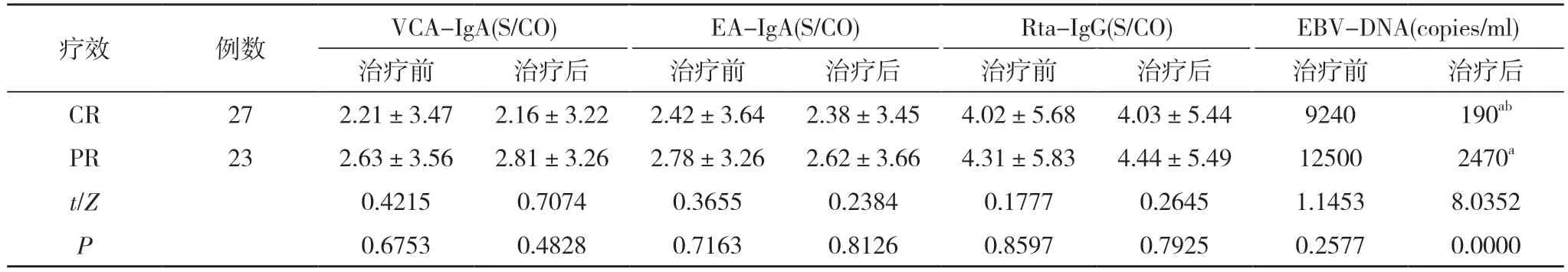
表3 不同疗效鼻咽癌患者治疗前后EBV-DNA、Rta-IgG、EA-IgA 与VCA-IgA 检测结果比较(,M)
注:与治疗前比较,aP<0.05;与PR 比较,bP<0.05
3 讨论
鼻咽癌的病理机制与EB 病毒存在密切联系,针对高危人群早期筛查鼻咽癌能够有效提高患者的预后效果与治愈率[11]。鼻咽癌患者的血浆中能够检测出肿瘤来源的EBV-DNA,其含量变化和患者病情、复发、疗效、转移密切相关[12]。EA-IgA 与VCA-IgA 抗体检测在鼻咽癌辅助诊断和筛查当中应用较多,而EB 病毒裂解期的基因编码Rta 蛋白是目前更受关注的新分子靶标[13,14]。EB 病毒裂解复制的情况下,病毒增殖过程中受染机体Rta 蛋白含量的高低能够准确反映病毒复制的活跃性[15]。
本研究结果显示:①鼻咽癌患者三种EB 病毒抗体表达和EBV-DNA 中位水平均显著高于健康体检人员和鼻咽相关疾病患者,而且鼻咽相关疾病患者的VCA-IgA 抗体表达和阳性率与健康体检人员也有差异,说明鼻咽癌患者血清中含有高浓度EB 病毒抗体,而且健康体检人员和鼻咽相关疾病患者也存在一定的阳性率,单项检查容易干扰血清学诊断结果或出现误诊,因而三种EB 病毒抗体和EBV-DNA 联合检测在鼻咽癌早期筛查与诊断当中有较高的临床诊断价值;②临床症状较轻和早期鼻咽癌患者的EA-IgA 与VCAIgA 抗体表达相对较低,在病灶增大或浸润范围扩散后抗体表达有一定的增高,但Ⅰ期、Ⅱ期、Ⅲ期、Ⅳ期患者的阳性率比较,差异无统计学意义(P>0.05);晚期鼻咽癌患者EBV-DNA 与Rta-IgG 抗体表达显著高于早期患者,说明根据淋巴结转移程度和临床分期的增高EB 病毒会出现高表达,引起相应抗体和Rta 蛋白出现明显的增多,Ⅲ期、Ⅳ期患者的阳性率也相对更高,因而Rta 蛋白抗体检测在鼻咽癌筛查诊断当中作用显著;③CR 患者治疗前EBV-DNA 中位数稍高于PR 患者,治疗后PR 患者的EBV-DNA 中位数显著高于CR患者,说明鼻咽癌分期与血浆中EBV-DNA 的含量相一致,由于病情变化后肿瘤细胞释放到外周血引起患者血浆中EBV-DNA 含量出现增高,因此血浆中EBVDNA 含量与肿瘤负荷属于正相关性。
综上所述,三种EB 病毒抗体和EBV-DNA 联合检测在鼻咽癌诊断中作用显著,建议推广应用。
