Neuritin与HSP60表达水平与肝细胞凋亡调节的相关性
2020-11-02武文博朱美意欧阳军石河子大学医学院第一附属医院急诊外科新疆石河子832000
武文博 朱美意 欧阳军 (石河子大学医学院第一附属医院急诊外科,新疆 石河子 832000)
肝脏是体内以代谢功能和再生能力为主的最大内脏器官,然而在生理状态下,绝大部分肝细胞正处于稳态,在受到外伤、感染、中毒、部分肝切除等损害因素造成肝脏受损后,存留的肝细胞会快速增生修缮受损部位,进而程序性表达极强的再生能力〔1~4〕。同时,肝脏的增殖重建涵盖复杂的病理生理全过程,牵涉到很多种细胞内外影响增殖及凋亡蛋白的调节。但是,肝损害后增殖修复的明确分子机制仍未全然认清。
1993年美国麻省理工学院的以色列籍科学家Nedivi及其同事发现Neuritin〔5〕是一种活性诱导的神经营养因子,曾经普遍视为其高度自限在神经细胞。2005年日本学者Nobuhiko研究发现Neuritin蛋白的表达水平随着肝脏的发育成熟而逐渐增高,成年小鼠的Neuritin蛋白表达量最多。同时,将成年小鼠的肝脏部分切除后Neuritin蛋白的表达水平呈现一过性降低,术后24 h伴随肝脏再生的开始,Neuritin蛋白的表达量随之升高,其升高水平与细胞周期蛋白(cyclin)D1(cyclinD1是肝脏成熟和再生的指标)一致〔6〕。据此可知Neuritin蛋白具备促使肝脏再生修复的功能。
课题组通过酵母双杂交技术及生物信息学技术发现了 Neuritin 与多条细胞增殖的基因有相互作用,热休克蛋白(HSP)60包含其中。HSP60是HSP家族的核心成员,最核心的功能是分子伴侣〔7〕,参与细胞周期与凋亡的调控〔6,8,9〕。含半胱氨酸的天冬氨酸蛋白水解酶(Caspase)-3是Caspase家族中最重要的成员,现在被认为是细胞调亡过程中最重要的终末剪切酶,细胞凋亡绝大部分都要依赖Caspase-3诱导的信号传导通道进而引发细胞凋亡〔10〕。但是Neuritin和HSP60在肝细胞内对Caspase-3的调控通路仍未确切。本研究通过体外细胞实验探讨Neuritin与HSP60在肝细胞中的表达水平及对细胞凋亡调节的分子机制。
1 材料与方法
1.1材料 BRL大鼠肝细胞购于中国科学院上海生命科学研究院细胞库;Neuritin抗体、HSP60抗体、Caspase-3抗体(Abcom 公司);Neuritin蛋白(Sino Biological公司);HSP60蛋白(Abcom 公司);Marker(Thermo Scientific公司),β-actin抗体(中杉金桥公司);NC膜(Whatman公司);DMEM液体培养基(Heclone 公司);胎牛血清(GIBCO公司);辣根酶标记山羊抗鼠IgG(H+L)、辣根酶标记山羊抗兔IgG(H+L)(中杉金桥公司);与一抗对应的免疫荧光二抗(Bioss公司);Western印迹、免疫荧光所需各种仪器设备。
1.2方法
1.2.1细胞培养 (1)将BRL大鼠肝细胞放于含有10%胎牛血清的DMEM培养基贴壁繁殖;待细胞贴壁率达95%~100%,吸出旧培养基,0.25%胰蛋白酶消化传代,再次加入1 ml DMEM培养基中止消化,800 r/min离心5 min,吸走上清液。(2)将含有10%胎牛血清的DMEM培养基重悬后缓缓吹打肝细胞,待其分散成单个肝细胞,将细胞悬液按照1∶3的比例接种至新的培养皿中,饱和湿度、37℃、5%CO2、95%空气恒温培养箱正常培养,间隔8 h进行换液。
1.2.2干预 (1)待培养皿中细胞生长状态较好,长至60%,准备好干预。(2)将上述培养皿,随机分为4大组,分别为Neuritin低表达组、Neuritin高表达组、HSP60低表达组、HSP60高表达组。每个大组分为5个小组,对照组(n=4)和实验组(n=16),对照组不做任何处理,Neuritin低表达组实验组分别给予0.1 、0.3、0.5、0.7 μg/ml的Neuritin抗体;Neuritin高表达组实验组分别给予0.5、1.0、1.5、2.0 μg/ml的Neuritin蛋白;HSP60低表达组实验组分别给予0.6、0.8、1.0、1.2 μg/ml的HSP60抗体;HSP60高表达组实验组分别给予10、50、100、200 ng/ml的HSP60蛋白,BRL肝细胞培养48 h后使用Western印迹检验Neuritin、HSP60及Caspase-3在肝细胞中的表达量。
1.2.3Western印迹法 BRL肝细胞培养48 h后分别提取上述各组细胞蛋白,5×十二烷基硫酸钠(SDS)裂解缓冲液裂解细胞,测各组蛋白浓度,调平每组蛋白提取液浓度时采用细胞降解液,获取肝细胞总蛋白,100℃煮沸8 min,12 000 r/min离心5 min,获取上清液。15 μl目的蛋白经15%聚丙烯酰胺凝胶电泳分离出来后采用电转移至NC膜上,使用5%脱脂奶粉TBST封闭2 h,分别加一抗(Neuritin抗体1∶500、HSP60抗体1∶20 000、Caspase-3抗体1∶300、β-actin 抗体 1∶1 000),4℃ 过夜。TBST溶液洗膜4次(1次5 min、3次15 min),对应的二抗〔辣根酶标记山羊抗兔IgG(H+L)1∶2 500,辣根酶标记山羊抗鼠IgG(H+L)1∶2 500〕。用ECL发光试剂盒显影检测蛋白印迹条带,Quantity one 分析蛋白条带灰度值。运用目地蛋白条带灰度值和相应的β-actin灰度值之比视为蛋白相对表达量。
1.2.4细胞免疫荧光 将六孔板中生长状态优良的肝细胞使用磷酸盐缓冲液(PBS)清洗3次,每次2~3 min,用4%多聚甲醛固定20 min,PBS冲洗3次,每次2 min,0.2%TritonX-100透化3 min,PBS清洗,5%牛血清白蛋白(BSA)37℃封闭30 min,倒去封闭液,同时加一抗(Neuritin抗体1∶100、HSP60抗体1∶100)置于湿盒4℃过夜,第二天复温后PBS清洗,在暗室加PBS稀释后的荧光二抗(1∶50)37℃、2 h,PBS冲洗3次,滴加抗荧光淬灭剂封片,最后使用共聚焦显微镜观察。
1.3统计学处理 采用Graphpad8.0软件进行方差分析、Pearson相关分析。
2 结 果
2.1Neuritin低表达在肝细胞中对HSP60及Caspase-3变化的影响 与对照组相比,0.1、0.3、0.5、0.7 μg/ml的Neuritin抗体组Neuritin相对表达水平逐渐降低,Caspase-3相对表达量逐渐增高(均P<0.05);各组HSP60相对表达水平基本一致,差异无统计学意义(P>0.05),见表1,图1。

表1 Neuritin低表达在肝细胞中对HSP60及Caspase-3变化的影响

1~5:对照组、0.1、0.3、0.5、0.7 μg/ml的Neuritin抗体组
2.2Neuritin高表达在肝细胞中对HSP60及Caspase-3变化的影响 与对照组相比,0.5、1.0、1.5、2.0 μg/ml的Neuritin蛋白组Neuritin相对表达水平逐渐升高,Caspase-3相对表达程度逐渐减低,差异均有统计学意义(均P<0.05);HSP60相对表达水平基本一致,差异没有统计学意义(P>0.05);见表2,图2。

表2 Neuritin高表达在肝细胞中对HSP60及Caspase-3变化的影响

1~5:对照组、0.5、1.0、1.5、2.0 μg/ml的Neuritin蛋白组
2.3HSP60低表达在肝细胞中对 Neuritin及Caspase-3变化的影响 与对照组相比,0.6、0.8、1.0、1.2 μg/ml的的HSP60抗体组HSP60相对表达水平逐渐降低,Caspase-3相对表达量逐渐增高,差异均有统计学意义(均P<0.05);各组Neuritin相对表达程度基本相同,差异无统计学意义(P>0.05),见表3,图3。

表3 HSP60低表达在肝细胞中对HSP60及Caspase-3变化的影响

1~5:对照组、0.6、0.8、1.0、1.2 μg/ml的HSP60抗体组
2.4HSP60高表达在肝细胞中对Neuritin及Caspase-3变化的影响 与对照组相比,10×10-3、50×10-3、100×10-3、200×10-3μg/ml的Hsp60蛋白组HSP60相对表达水平逐渐增高,Caspase-3相对表达水平渐渐减低,差异均有统计学意义(均P<0.05);各组Neuritin相对表达程度基本相同,差异无统计学意义(P>0.05),见表4,图4。

表4 HSP60高表达在肝细胞中对HSP60及Caspase-3变化的影响
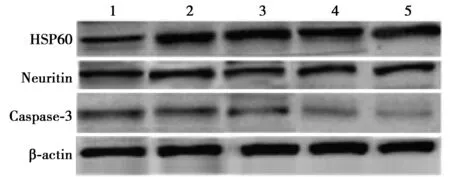
1~5:对照组、10×10-3、50×10-3、100×10-3、200×10-3 μg/ml的HSP60蛋白组
2.5Neuritin、HSP60在肝细胞内和Caspase-3的相关性分析 Neuritin低表达组和Neuritin过表达组中,Neuritin表达与Caspase-3表达呈明显负相关(r=-0.993,P<0.05)(图5);HSP60低表达组和HSP60高表达组中,HSP60表达与Caspase-3表达呈明显负相关(r=-0.996,P<0.05)(图6)。

图5 Neuritin和Caspase-3的相关分析

图6 HSP60和Caspase-3的相关性
3 讨 论
引发细胞凋亡程序的因素主要是通过Caspase-3介导的细胞信号传导途径而导致细胞凋亡。在细胞增殖和凋亡程序中起着关键作用是线粒体通道,然而在凋亡调控基因中,最受瞩目的是Bcl-2 家族、Caspase家族,其中抗凋亡蛋白Bcl-2蛋白和促凋亡蛋白Bax蛋白是目前为止在凋亡调节进程中基本功能彼此对立的一对不可或缺的调节蛋白〔11〕。Caspase-3的活性和细胞凋亡呈正相关,主要通过细胞色素(Cyt)C的释放进而影响线粒体通道诱导的Caspase凋亡。当细胞接收到来自凋亡的信号,如外源性信号(大部分肝切除、电离辐射、化疗药物等),或内源性因素〔Neuritin、HSP60、活性氧(ROS)生成等〕,引发Bax和Bcl-2激活,导致线粒体膜两侧化学浓度差消失,跨线粒体膜两侧电位梯度消失,线粒体基质中储存的Ca2+释放导致线粒体膜通透性增高并大量释放CytC〔12~15〕。CytC释放入细胞质后与Caspase结合形成复合物,进而使信号传递至下游Caspase-3,最后使细胞凋亡信号持续传送下去〔16,17〕。
研究表明Neuritin、HSP60参与细胞增殖及凋亡的调控〔18〕。人类Neuritin基因〔候选可塑性基因(CPG)15〕位于6号染色体上(6p25.1);长2 072 bp;并且在物种间高度保守,人与鼠之间的同源性高达97%(cpg15)。其在神经元可塑性和再生中发挥重要作用,同时还涉及抗细胞凋亡、血管生成、肿瘤发生等生物过程。研究发现胚胎脑中表达的可溶性Neuritin可以通过阻止Caspase-3介导的细胞凋亡途径,来抑制皮质祖细胞的凋亡,进而调节其存活〔19〕。有文献报道Neuritin在施万细胞中同样也有表达〔20〕。在过量表达Neuritin的施万细胞中克隆Bcl-2的功能,导致Caspase-3活性增加,从而增加细胞凋亡。这显示了该途径中Neuritin与Bcl-2的关系。随着细胞凋亡的变化,Caspase-3和Caspase-9的活性发生了相应的变化。同样的,研究发现〔21〕通过磷脂酰肌醇-3-激酶(PI3K)上调Neuritin表达,类胰岛素1号增长因子(IGF1)可以施万施万细胞的凋亡,Neuritin是该途径的下游元素,研究表明,在体外高血糖症状下,Neuritin是IGF1对施万细胞凋亡的调节剂或介质,至少通过抗凋亡元件Bcl-2。研究发现外源性IGF1在一定程度上阻止了施万细胞暴露于高血糖的细胞凋亡。在给定的高血糖水平下,Neuritin介导IGF1的作用,IGF1的作用随剂量而变化。研究表明IGF1可能是抗细胞凋亡途径的上游调节因子:PI3K-Neuritin-Bcl-2-Caspase-3〔21〕。有趣的是,本实验通过使Neuritin低表达及高表达研究发现,Neuritin和Caspase-3呈现出相反的变化趋势,并且影响Neuritin的表达水平,并不能影响HSP60的表达。结合上述研究笔者归纳其机制可能为Neuritin激活Bcl-2抗细胞凋亡作用,从而影响Caspase-3的表达,最后起到抗细胞凋亡的作用。
以往研究证实HSP60是重要的线粒体分子伴侣,然而如今研究发现HSP60同时存在于细胞膜、细胞质〔10〕。目前研究表明 HSP60 的主要功能如下:①参与新生蛋白质的正确折叠和组装及变性蛋白质的恢复过程;②在细胞周期与细胞凋亡中起到调控作用;③参与蛋白质跨膜转移;④具有抗氧化功能;⑤在免疫中起作用〔6,9,10〕。HSP60作为分子伴侣的确切作用机制尚不明确,因为据报道它可以促凋亡或抗细胞凋亡〔22〕。Gupta等〔23〕研究发现在心脏细胞质中HSP60与Bax,Bak和Bcl-XL复合,但不与Bcl-2复合。HSP60表达的减少促进细胞凋亡,但不改变线粒体功能。在缺氧期间HSP60在细胞分布位置发生变化,HSP60离开细胞质,转移到质膜。总细胞HSP60直到复氧(10 h才改变;然而,CytC从线粒体释放发生在再氧合之前,与HSP60的重新分布一致。在缺氧期间HSP60、Bax和HSP的变化,CytC可以通过三磷酸腺苷(ATP)消耗来复制。HSP60也被证明可以加速pro-Caspase-3的裂解。因此,HSP60在细胞凋亡程序中起关键作用。HSP60在正常条件下与Bax的结合表明其在细胞凋亡中的关键调节作用。同样的Caruso Bavisotto等〔22〕研究报道双(吡啶基)恶二唑酮络合物(CubipyOXA)的促细胞凋亡作用可能是使HSP60水平的降低和其阻断HSP60/pro-Caspase-3复合物的形成,因此阻碍了HSP60的抗细胞凋亡作用。肾上腺皮质癌(ACC)中HSP60激活ERK和Akt,减少Bax和CytC释放及Caspase-3级联的凋亡信号传递〔24〕。HSP60信号传导的丧失有助于糖皮质激素诱导的促凋亡反应的增强,从而加速成骨细胞凋亡和骨质量损失〔25〕。本实验通过在肝细胞体外实验使HSP60低表达及高表达研究发现,HSP60和Caspase-3表达水平显现出相反的变化趋势,并且影响HSP60的表达水平,并不能影响Neuritin的表达。进而推断HSP60可能通过抑制Bax的促细胞凋亡作用,进而影响Caspase-3的表达,最后呈现出抗细胞凋亡的作用。
由本研究结果可知,HSP60与Neuritin低表达可以促进细胞凋亡,而HSP60与Neuritin过表达抑制细胞凋亡。笔者推测HSP60和Neuritin可能通过某种协同作用共同参与肝细胞的抗凋亡调控机制。
