L1细胞黏附分子在结肠癌中表达的临床意义和生物学作用
2020-10-31陈立智胡军傅厚丰符敏
陈立智 胡军 傅厚丰 符敏
琼海市人民医院普通外科(海南琼海571400)
结肠癌(colon cancer,CC)是中国第四常见的恶性肿瘤,每年新增CC 病例超过130 000 例,占我国癌症死亡人数的10%[1-2]。统计数据显示目前约有54%的CC 确诊病例未发生转移(Dukes A&B期),46%的病例有远处淋巴结或器官转移(Dukes C&D 期)[3-4]。近些年,虽然改良的外科技术、辅助放射治疗以及经肝动脉栓塞化疗等在CC 转移治疗中取得一定进展,但大多数进展期的CC 患者最终死于转移性疾病[5-6],因此寻找结肠癌远处转移的治疗靶点是延长结肠癌患者生存期重要策略。
L1细胞黏附分子(L1 cell adhesion molecule,L1CAM)又名CD171,是一种细胞黏附的免疫球蛋白超家族分子[7-8],L1CAM 在神经系统的轴突引导和细胞迁移中起着至关重要的作用,其突变易发生多种神经系统疾病[9-10]。L1CAM 被质膜附近的胰蛋白酶、金属蛋白酶等酶裂解水解后会生成可溶式入胞片段L1-ICD,然后与细胞骨架蛋白、肌动蛋白、血影蛋白相互作用后驱使细胞向远处转移[11-12]。最近多项研究表明L1CAM 在胶质母细胞瘤、肺癌、胃癌等多种实体瘤中高表达,促进肿瘤细胞转移和侵袭等生物学行为,并与患者不良预后相关[13-16]。然而,L1CAM 在CC 中的表达及其与临床预后的关系却鲜有报道。本研究系统地评估了L1CAM 在166 例CC 组织中表达情况,还设计一系列体外实验研究L1CAM 在CC 中的生物学特性,以综合评价L1CAM 对CC 患者预后影响和生物标志物潜力。
1 材料与方法
1.1 临床资料选取2010年3月至2016年3月期间在我院收治并经病理证实的166 例结肠癌患者。其中,男92 例,平均年龄为(58.62±14.21)岁。女74 例,平均年龄为(59.27±16.31)岁。所有入组病例术前未接受过放、化疗,且均有详细的临床资料和手术记录。本研究按照1964年《赫尔辛基宣言》的伦理标准和随后的所有修订进行。且得到琼海市人民医院伦理委员会审核和批准,患者和对照者在纳入本研究之前均知情同意。
1.2 免疫组织化学检测L1CAM 表达于我院病理科取4 μm 厚度的石蜡切片;切片经二甲苯脱蜡、水化;5%的Triton 透化30 min,加入柠檬酸缓冲液(pH 6.0),微波抗原修复15 min 后,用3%的H2O2去离子水孵育10 min 阻断内源性过氧化酶的作用;10%正常山羊血清(PBS 稀释)封闭,室温孵育10 min;滴加100 μL L1CAM 一抗(1∶200 稀释,Abcam,货号:ab24345,美国)于4 ℃孵育过夜,以PBS 作一抗为阴性对照。次日,PBS 冲洗玻片,滴加辣根过氧化物酶标记的二抗,室温孵育30 min;用GT Vision 抗体复合物(抗鼠/兔)法和GT VisionI检测系统试剂盒(上海基因技术有限公司)进行染色。以细胞内出现棕黄色颗粒为阳性表达。每张切片随机选取10 个不同的视野,在显微镜下随机捕获多个图像,分析每个视野的阳性细胞数并计算阳性率。
细胞质被染上棕黄色或棕褐色的记为阳性细胞。参照MATTERN 等提到的方法,从两方面进行半定量评分:(1)染色深浅度。未见染色为0,轻度染色为1,中度染色为2,深度染色3。(2)染色细胞的百分比:未见染色细胞为0,染色细胞<25%为1,染色细胞25%~50%为2,染色细胞>50%为3。将这两方面评分相加计总分(0~6 分)。当评分为0~2 分则为阴性,超过2 分则为阳性。
1.3 细胞培养和小分子RNA(si-RNA)转染人CC细胞HCT116 和LS174T 细胞株及正常上皮细胞NCM460 和FHC 细胞购于中国科学院上海细胞库。细胞培养于T25 cm3的培养瓶中。加入5 mL 的DMEM高糖培基(Gibco,美国)、10%胎牛血清(FBS,Gibco,美国)、100 U/mL 青霉素钠和100 μg/mL 链霉素(Hyclone,美国)。细胞培养瓶放于37 ℃含5%CO2的培养箱中。
靶向敲除人源L1CAM 的序列:正义链:5′-CGGCAGGCATTAGAG ATGAACAGCA-3′;反义链:3′-AGGCCCAUAACCACTCAGCCTAG-5′。以同一厂家(锐博生物,广州)提供的与人类基因没有同源性的阴性对照发夹siRNA 作为阴性对照。将1.5×105个细胞接种于35 mm 培养皿中24 h,用脂质体Lipo 3 000 试剂(赛默飞公司,美国)转染。24 h检测转染效率,提取细胞蛋白并进行功能实验检测。
1.4 Western blot检测L1CAM表达将细胞种于6 孔板中,待其融合度达到90%左右时,弃去培养液,每孔加入200 μL 含有蛋白酶抑制剂Cocktail的蛋白裂解液RIPA。吸取细胞裂解液于EP 管中,4 ℃12 000 g 离心30 min。采用BCA 蛋白浓度测定试剂盒测定蛋白浓度(上海碧云天生物技术)。40 μg总蛋白由SDS-PAGE凝胶电泳分离,再转移到0.45 μm 厚度的PVDF 膜上。于4 ℃孵育L1CAM 和GAPDH 一抗(1∶1 000,Abcam,货号:ab 24345,美国)过夜。次日,条带与相应的辣根过氧化物酶标记的二抗体室温孵育1 h(1∶5 000;上海碧云天生物技术)。用ECL 增强化学发光检测系统(Bio-Rad,加州,美国)对膜进行可视化,并用凝胶分析仪进行了灰度分析。目标蛋白的相对含量为目标蛋白与相应的内参条带灰度值比值。
1.5 划痕实验检测细胞迁移能力将对照组(control,Con)和 转 染si-L1CAM 组 的HC116 和LS174T 细胞种于6 孔板中,待融合度达到90%左右时,用200 μL 的Tip 枪头进行划痕,PBS 冲洗3 次洗去脱落的细胞。加入新鲜的完全培养基。用倒置显微镜捕获同一区域0 h 和48 h 的划痕的图片(10 倍),该实验重复3 次,测量划痕区细胞之间的距离的迁移能力进行量化。
1.6 细胞增殖和凋亡检测CCK8 检测细胞增殖:取对数生长期的细胞,以1 × 103/孔细胞接种于96 孔板中继续培养。于6、12、24、48 和72 h 后开始进行CCK 8 实验,每孔加入100 μL RPMI-1640培养基稀释好的CCK-8 溶液,37 ℃避光孵育2 h,于酶标仪450 nm 处测吸光值,每组3 个复孔,连续测量3 d,绘制生长曲线图。
流式细胞仪测凋亡:本实验采用细胞凋亡试剂盒(BD science,芝加哥,美国)进行检测。细胞在转染2 d 后被消化离心,用冰PBS 洗涤两次,重悬于100 μL 的1X Bing buffer 中,分别加入5 μL 的PI 和Anexin V 试剂,室温避光孵育15 min。然后在1 h 之内送至本院科研中心进行上机检测。细胞凋亡细胞率=早期凋亡率+晚期凋亡率。
1.7 统计方法用GraphPad Prism software(Version 5.01,GraphPad 软件公司,圣地亚哥,智利)统计软件进行分析。采用独立样本t检验比较两组样本间各指标的差异。采用卡方检验分析L1CAM 蛋白的阳性率和患者临床病理变量之间的关系。选择过程来发现L1CAM 表达的独立危险因素使用Kaplan-Meier 方法绘制总体生存(overall survival,OS)曲线,并使用Log-rank 检验进行分析。P<0.05认为差异有统计学意义。
2 结果
2.1 L1CAM 在结肠癌中高表达免疫组化检测结肠癌组织和癌旁组织中LICAM 蛋白表达结果如图1所示,LICAM 蛋白在结肠癌组织中主要定位于细胞质,着棕褐色的细胞定义为阳性表达。根据评分,在入组的166 例结肠癌组织中125(75.30%)例为LICAM 阳性表达。在癌旁组织中LICAM 的阳性表达为41 例,阳性率为24.70%。两组比较差异有统计学意义(P<0.05)。
2.2 L1CAM 高表达与CC 患者临床病理特征的关系由表1可知,L1CAM 表达与CC 患者性别、年龄无关(P>0.05)。然而L1CAM 表达和肿瘤直径、分化程度及患者淋巴转移和临床分期显著相关(P<0.05)。其中,相比于淋巴结未转移的患者,淋巴结转移组的患者的组织中L1CAM蛋白的阳性率更高(P<0.05)。此外,Ⅲ-Ⅳ患者组织中L1CAM 蛋白的表达显著高于Ⅰ-Ⅱ患者(P<0.05)。

图1 IHC 检查CC 组织和癌旁组织中L1CAM 的表达(×200 倍)Fig.1 IHC examination of L1CAM expression in colon cancer tissues and adjacent tissues(×200)

表1 L1CAM 的表达与CC 患者临床病理特征的关系Tab.1 The relationship between L1CAM expression and clinicopathological features of patients with CC 例
2.3 L1CAM表达与CC患者病理因素的相关性在Cox 风险比例模型分析中,L1CAM 表达(P<0.001)、肿瘤大小(P<0.001)、淋巴结转移(P<0.001)、分化程度(P<0.001)、更高的临床分期(P<0.001)为CC 患者的独立风险预后因素。相反,性别、年龄不是CC 患者的独立风险预后因素。由图2可知,L1CAM 高表达组的OS 中位生存期为18.5 个月,而L1CAM 低表达组的OS 中位生存期为25.23 个月,两组比较,差异有统计学意义(P=0.008)。提示L1CAM 高表达预示结肠癌患者的不良预后。
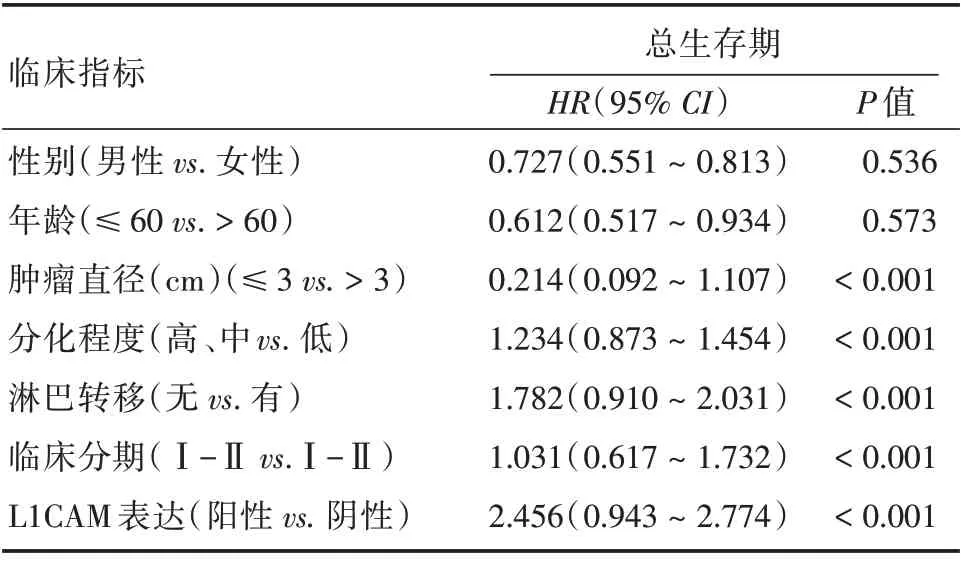
表2 Cox 风险比例模型分析CC 患者的独立预后风险因素Tab.2 Cox risk proportional model analysis of independent prognostic risk factors for patients with CC

图2 L1CAM 高低表达组患者的OS 生存曲线Fig.2 OS survival curves in patients with L1CAM high and low expression group
2.4 敲除L1CAM 降低CC 细胞迁移能力为了探索L1CAM 的在CC 中的生物学作用,选择具有较高侵袭性的结肠癌细胞系HCT116 和LS174T。同时选取了正常结肠上皮细胞系FHC 和NCM460作为对照。由图3A可知,相比于FHC 和NCM460,CC 细胞系HCT116 和LS174T 内源性L1CAM 表达水平显著升高(P<0.05)。进一步探究L1CAM对CC细胞的正向调控作用,利用si-RNA 建立HCT116和LS174T 细胞L1CAM 低表达模型。结果如图3B所示,si-L1CAM 组的L1CAM 蛋白表达较对照组显著降低(P<0.05)。细胞迁移实验结果表明,与对照组相比,L1CAM 低表达组CC 细胞的迁移距离明显缩短。
2.5 敲除L1CAM 促进CC 细胞凋亡L1CAM 敲除后,HCT116和LS174T的细胞凋亡率显著上升,差异有统计学意义(P<0.05),图5A-B。此外,采用CCK8 检测细胞增殖结果提示L1CAM 敲除后两株细胞的增殖率显著下降(P<0.05),见图5C。
3 讨论
在这一回顾性分析中,采用IHC 方法检测了166 例CC 患者癌和癌旁配对组织中L1CAM 的蛋白表达,以评价L1CAM 在CC 中的作用。本研究发现在75.30% CC 组织中存在L1CAM 蛋白阳性表达,而24.7%CC组织L1CAM蛋白阴性表达。其中,Ⅲ~Ⅳ级患者组织中L1CAM 蛋白的表达显著高于Ⅰ~Ⅱ级患者。MOHANAN 等[17]发现L1CAM 蛋白水平与胶质瘤临床病理分级显著相关,本研究结果与其一致。此外,相比于未发生淋巴结转移的患者,淋巴结转移的患者的组织中L1CAM 蛋白的阳性率更高。与以往的研究一致,在乳腺癌的研究表明L1-CAM 的表达主要发生在乳腺癌组织的侵袭性前沿和血管内皮细胞,这提示L1CAM 在癌症的恶性进展和侵袭性中起作用。在随后的多因素分析中,发现L1CAM 蛋白水平(95%CI:0.943~2.774,P<0.001)、肿瘤直径(95%CI:0.092~1.107,P<0.001)、分化程度(95%CI:0.873~1.454,P<0.001)、淋巴结转移(95%CI:0.910~2.031,P<0.001)、临床分期(95%CI:0.617~1.732,P<0.001)是影响CC 患者生存的独立因素,且L1CAM阳性组患者与L1CAM 阴性组患者相比,OS 较差(18.5vs.25.23,P=0.008),这提示L1CAM 在CC 的发生和发展中扮演重要角色。另外,肿瘤标志物常作为肿瘤筛查和复发转移监测的重要手段[18],以上多因素分析结果还提示L1CAM 具有发展成为监测结肠癌术后复发和转移的标记物的潜在价值。
然而,目前尚未见更深入的细胞水平研究。为了更进一步探讨L1CAM 在CC 的生物学关系,根据本研究的临床结果L1CAM 似乎与CC 的侵袭性相关,而与肿瘤的生长无显著相关。因此选择了具有较高侵袭性的结肠癌细胞系HCT116和LS174T。同时选取了正常结肠上皮细胞系FHC和NCM460 作为对照。采用si-RNA 干扰技术检查了细胞的迁移能力变化。值得注意的是,敲除L1CAM 显著降低CC 细胞的迁移能力。之前的研究表明,L1CAM 阳性与血管侵犯有关,且认为L1CAM 阳性肿瘤细胞对肿瘤血管的亲和力高于淋巴管[19]。在本研究中,发现异常活化的L1CAM阳性肿瘤细胞的淋巴结转移能力显著升高。根据相关研究进展,认为这可能是以下原因:(1)与L1CAM 在肿瘤细胞中表达的因子相互作用,包括整合素、神经肽-1 或L1CAM 本身,导致肿瘤细胞通过细胞-细胞相互作用迁移。(2)近来研究显示,L1CAM 的细胞外结构域包含SL1,其可通过崩解剂ADAM10 和金属蛋白酶ADAM17 介导的切割从细胞表面脱落[20]。一些研究发现,乳腺、黑色素瘤、胶质瘤和卵巢癌细胞会通过自分泌或旁分泌刺激作用释放SL1 到血液中,然后发挥肿瘤归巢效应,加速肿瘤转移。(3)L1CAM 破坏含有E-cadherin 的粘附连接,增加MCF7 乳腺癌细胞的散射和运动,这种表型似乎与EMT 的机制密切相关[19]。随后,WHITTARD[21]发现L1CAM 的表达与上皮间充质转换(EMT)、MAPK、JNK 和ERK 信号相关,导致肿瘤细胞存活、迁移、侵袭和耐药的产生。
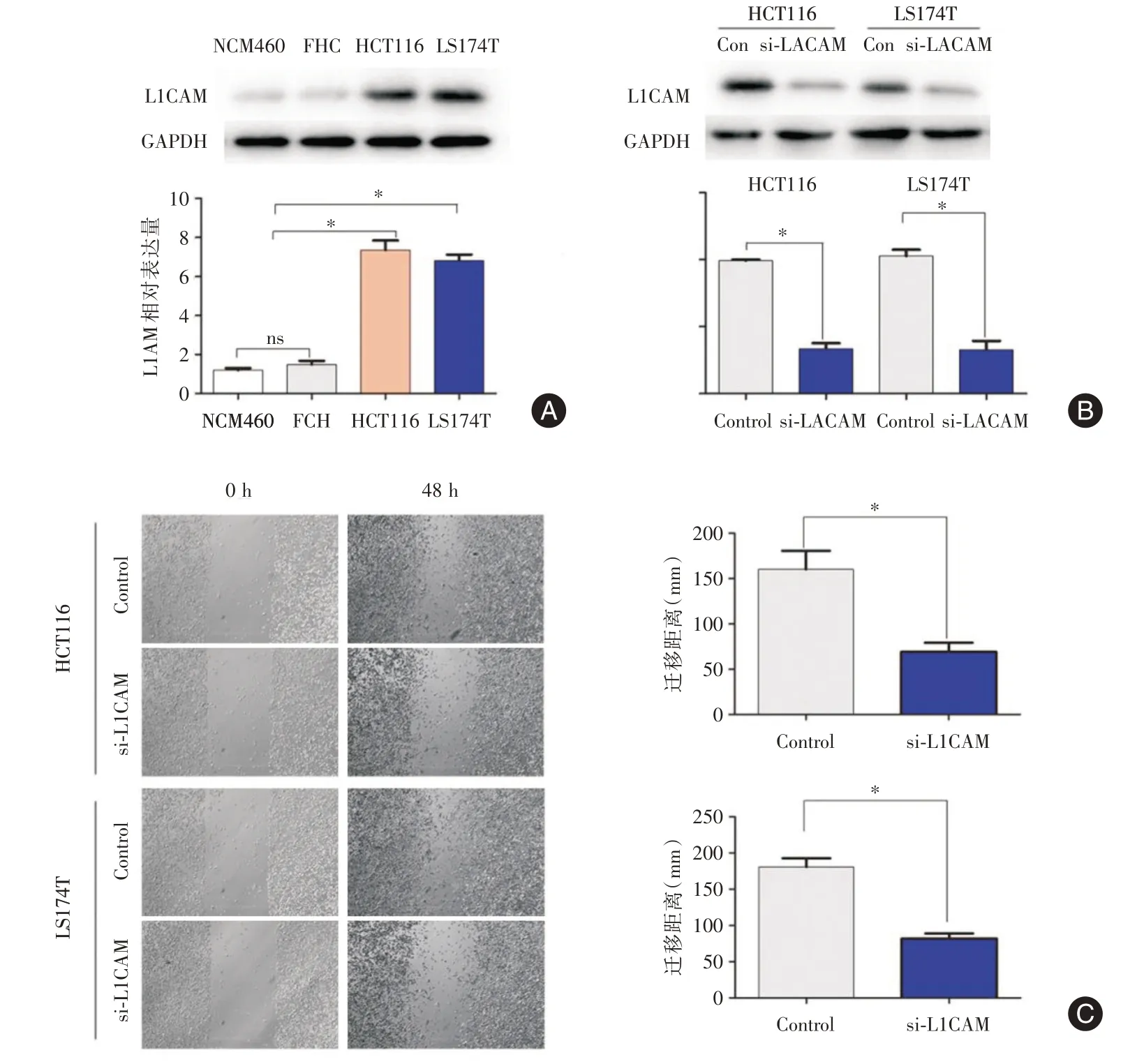
图3 敲除L1CAM 降低CC 细胞迁移能力Fig.3 Knockout of L1CAM reduces CC cell migration

图4 敲除L1CAM 对CC 细胞凋亡和增殖的影响Fig.4 The effect of knocking out L1CAM on apoptosis and proliferation of CC cells
本研究尚存在一些不足之处,虽然OS 曲线结果分析表明L1CAM 的高表达对结肠癌患者的预后不良,但是治疗方式对OS 曲线存在部分影响,本研究样本病例和随访时间较短,没有分别对化疗和未化疗患者中L1CAM 高、低表达的OS 进行分析,所以在今后的研究工作中要进行多中心研究、扩大样本,延长随访周期,规避OS 生存分析的影响因素。另外,L1CAM 促进转移的作用机制没有进行深入的研究,虽然在其他肿瘤有研究报道,但对L1CAM 促结肠癌转移机制并没有很重要的参考意义,因此在今后的研究中将通过多组学的方法多维度寻找L1CAM 促进结肠癌转移机制,并利用分子生物学方法多层次进行验证。
综上所述,本研究结果显示L1CAM 蛋白在人结肠癌组织中高表达,导致患者不良预后,并能够促进结肠癌增殖和转移,提示L1CAM 蛋白可发展为结肠癌患者诊断和预后的一个分子指标,并为临床治疗结肠癌提供一定的理论基础。
