小鼠学习记忆能力及海马区突触功能相关蛋白BDNF、PSD95、GluA1的增龄性变化
2020-10-27王晓燕侯爱生宋玉祥刘文刚钟坤根郝建华曹江北米卫东
王晓燕,侯爱生,宋玉祥,刘文刚,钟坤根,郝建华,曹江北,米卫东
1 解放军总医院第四医学中心 麻醉科,北京 100037;2 解放军总医院第一医学中心 麻醉手术中心,北京 100853
年龄相关的认知能力下降是衰老的常见并发症,会影响多种脑功能,包括速度感知、推理归纳,甚至可能是严重的海马依赖性空间学习和记忆损害[1]。这些功能损害不仅影响生活质量,还给社会及卫生保健系统带来沉重负担,并且随着预期寿命的显著增加,年龄相关性认知障碍的患病率持续上升[2]。因此,要重视对老年性认知下降的机制理解及防治。海马是学习记忆形成的重要生物学基础,衰老后学习记忆能力下降与海马组织形态结构和功能的改变联系密切。脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)是一种神经营养素家族分泌的蛋白质,调节大脑发育、突触形成、记忆和学习[3]。突触后致密蛋白95(postsynaptic density protein95,PSD95)是突触后膜最重要、最丰富的脚手架蛋白,主要存在于成熟的兴奋性谷氨酸能突触内[4-5],为突触后膜的受体活动和稳定性所必需,在突触可塑性中起重要作用[6]。GluA1 是α-氨基-3-羟基-5-甲基-4-异唑丙酸(alpha-amino-3-hydroxy-5-methyl-4-isoxazole propionic acid,AMPA) 受 体 的 亚 单 位,AMPA 受体(AMPA receptor,AMPAR)是一种谷氨酸受体,在突触调节中起关键作用,参与突触传递、突触可塑性以及最终的学习和记忆[7]。本研究拟通过Morris 水迷宫空间获得训练和记忆测试评价C57BL/6 小鼠学习记忆能力随年龄的变化,并通过Western blot 观察其海马区突触功能相关蛋白BDNF、PSD95、GluA1 表达的增龄性变化,以期为老年性认知下降提供一定的防治线索。
材料和方法
1 实验动物及饲养 18 月龄雄性C57BL/6 小鼠10只饲养11 周,然后购买9 周龄雄性C57BL/6 小鼠10 只,同时喂养1 周后做行为学训练,此时老年小鼠为21 月龄,青年小鼠为10 周龄。前后两批小鼠均为SPF 级动物,购自斯贝福(北京)生物技术有限公司,许可证号:SCXK(京)2016-0002。小鼠饲养环境:室温23℃ ~ 24℃,湿度40% ~ 50%,光暗间隔12 h,每笼3 ~ 4只群养,可自由摄食饮水。
2 主要试剂 兔抗小鼠BDNF 抗体、兔抗小鼠PSD95 抗体购自Abcam 公司;兔抗小鼠GluA1 抗体、兔抗小鼠β-Actin 抗体购自Cell Signaling Technology 公司;辣根过氧化物酶标记的山羊抗兔二抗购自中杉金桥公司。
3 动物分组及实验设计 10 周龄C57BL/6 雄性小鼠为青年组(Young 组),21 月龄C57BL/6 雄性小鼠为老年组(Old 组),每组10 只。小鼠于第1 ~ 5天进行水迷宫空间获得性训练,第6 天休息常规饲养,第7 天进行水迷宫空间探索实验与工作记忆检测。
4 Morris 水迷宫实验装置 水迷宫主要测试场所为白色内壁不锈钢圆桶(直径145 cm,高50 cm),桶内注入21℃ ~ 22℃温水(水深约25 cm),并倒入适量脱脂奶粉搅拌均匀。桶内十字等分为Ⅰ、Ⅱ、Ⅲ、Ⅳ4 个象限,桶外部标记小鼠各象限入水的起点(各象限圆弧中点)。白色平台(直径10 cm)固定于第Ⅰ象限的中间,并低于水面1 cm。水槽四周贴有不同形状作为动物空间记忆参照物。小鼠的行为学表现由水槽上方的摄像头实时记录并传输到电脑软件进行分析。
5 空间获得性训练 小鼠空间获得性训练方法参照本实验室常规训练方法[8],所有动物进行连续5 d 每天4 次的空间获得性训练,保证每只动物每天随机从4 个不同的入水点各训练1 次。摄像系统记录分析每只小鼠4 个象限的上台次数和登台潜伏期。
6 空间探索实验 在第7 天进行空间探索实验,检测小鼠依赖训练获得的空间记忆能力,即参考记忆。检测时撤除原有平台,开始60 s的探索实验。入水点选为原平台象限的对侧象限,记录小鼠进入目标象限(原平台放置象限)穿过平台所在区域的次数(穿台次数)、在目标象限停留时间及路程百分比,以此作为空间记忆的检测指标。
7 工作记忆检测 第7 天进行工作记忆检测,测定小鼠不依赖前5 d 训练的即时工作记忆能力。工作记忆的完成有赖于小鼠对新近出现刺激的记忆。将平台随机置于第Ⅰ象限以外的任一象限,如果小鼠能够在60 s 内找到并爬上平台,则允许小鼠在平台停留10 s;如果找不到平台,则将其引导至平台,并允许小鼠在平台上停留10 s;取出小鼠,间隔10 s 后从同一入水点放入,记录小鼠登台潜伏期、在目标象限(原平台放置象限)停留时间及路程百分比,以此作为工作记忆的检测指标。
8 实验动物处理 第7 天行为测试完成后,对所有小鼠实施水合氯醛麻醉后心脏灌流处死,并于冰上取小鼠双侧海马,液氮冷冻后-80℃保存,待Western blot 检测。
9 Western blot 实验 使用总蛋白提取试剂盒(凯基KGP2100)及膜蛋白和胞质蛋白提取试剂盒(凯基KGP3100),参照操作说明分别提取两组小鼠海马的总蛋白(n=5)和膜蛋白(n=5)。BCA 法定量蛋白浓度。配置10%聚丙烯酰胺凝胶(SDS-PAGE),每孔上样30μg,电泳分离,PVDF 膜半干法转膜。转膜完毕以5%脱脂牛奶封闭2 h,然后分别加BDNF 兔抗鼠一抗(1 ∶1 000 稀释)、PSD95 兔抗鼠一抗(1 ∶1 000 稀释)、GluA1 兔抗鼠一抗(1 ∶1 000 稀释)、β-Actin 兔抗鼠一抗(1 ∶1 000 稀释),4℃孵育过夜。第二天TBST 洗膜后,加入辣根过氧化物酶标记的山羊抗兔二抗(1 ∶2 000 稀释),室温孵育1 h,TBST 洗涤。化学增强发光法(ECL)显色,Quantiy One 软件计算灰度值,采用β-Actin作为内参蛋白并对蛋白相对表达量进行归一化处理。10 统计学方法 应用SAS9.4 软件进行统计分析。实验观测数据以±s 表示。小鼠获得性训练实验数据采用混合效应模型(两因素重复测量)进行分析,其他实验数据采用非参数检验进行分析。P <0.05 为差异有统计学意义。
结 果
1 小鼠Morris 水迷宫空间获得性训练表现 在5 d训练过程中,两组隐藏平台获得实验的平均登台潜伏期均随着训练次数的增多呈现逐渐缩短趋势(图1),从训练第4 天开始所有小鼠均能准确找到隐藏平台。在混合效应模型中,时间、年龄分组、象限因素主效应的检验结果分别为F=4.75、P=0.002,F=19.39、P=0.000,F=5.34、P=0.003,交互效应都无统计学意义。训练第1 天青年组与老年组小鼠4 个象限到达平台平均潜伏期无统计学差异[(42.25±22.02) s vs (48.79±17.57) s,P=0.217],训练第2 ~ 4 天青年组小鼠在同一时间点4 个象限到达平台平均潜伏期均明显短于老年 组[Day2:(30.53±22.23) s vs (43.61±20.10) s,P=0.016;Day3:(28.98±23.15) s vs (40.08±21.29) s,P=0.039;Day4:(23.68±19.98) s vs (39.25±21.05) s,P=0.004],训练第5 天4 个象限到达平台的平均潜伏期差异无统计学意义(28.60±24.44 vs 34.04±22.91,P=0.425)。
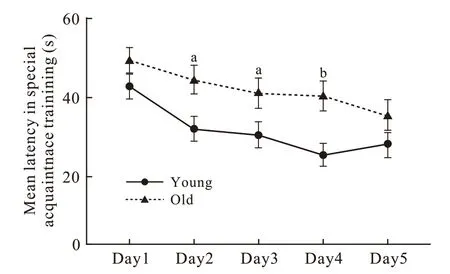
图 1 两组小鼠Morris 水迷宫空间获得性训练中平均登台潜伏期(n=10; aP <0.05, bP <0.01)Fig. 1 Mean latency of mice in special acquaintance training in Morris maze (n=10; aP <0.05, bP <0.01)
2 小鼠Morris 水迷宫空间探索实验参考记忆测试与青年组相比,老年组小鼠目标象限穿台次数(P=0.007)、在目标象限停留时间(P=0.003)及路程百分比(P=0.008)均明显减少(图2)。
3 小鼠Morris 水迷宫工作记忆测试 与青年对照组相比,老年组小鼠登台潜伏期平均值(P=0.049)和在目标象限停留时间(P=0.010)均明显延长(图3)。
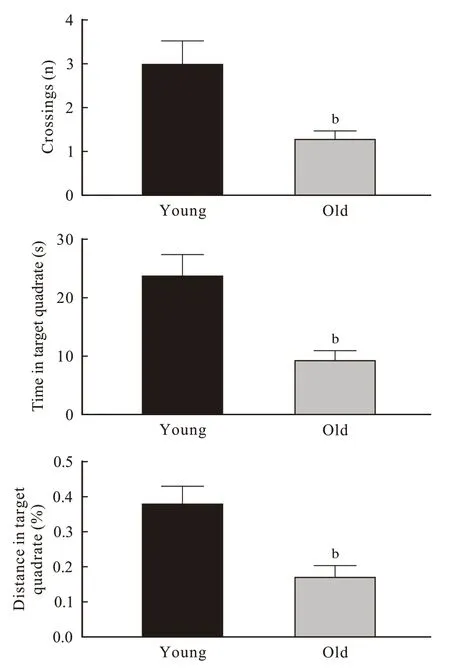
图 2 小鼠 Morris 水迷宫空间探索实验参考记忆测试 (n=10; bP <0.01)Fig. 2 Reference memory test of mice in Morris maze (n=10; bP <0.01)
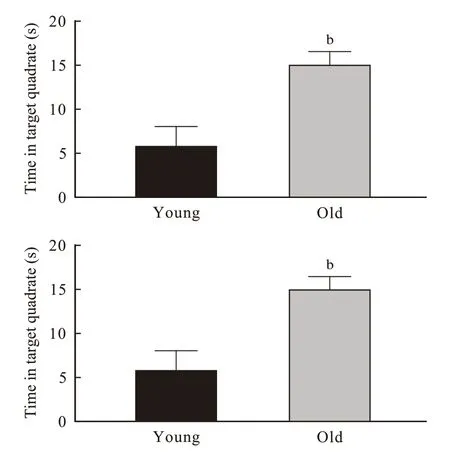
图 3 小鼠 Morris 水迷宫工作记忆测试(n=10; bP <0.01)Fig. 3 Working memory test of mice in Morris maze (n=10; bP <0.01)
4 小鼠海马组织BDNF、PSD95、GluA1 蛋白表达与青年对照组相比,老年组小鼠海马总蛋白BDNF(P=0.008)、PSD95(P=0.032)、GluA1(P=0.028 6) 表 达量明显低于青年组(图4),老年组小鼠海马膜蛋白GluA1 的表达量也显著低于青年组(P=0.008;图5)。
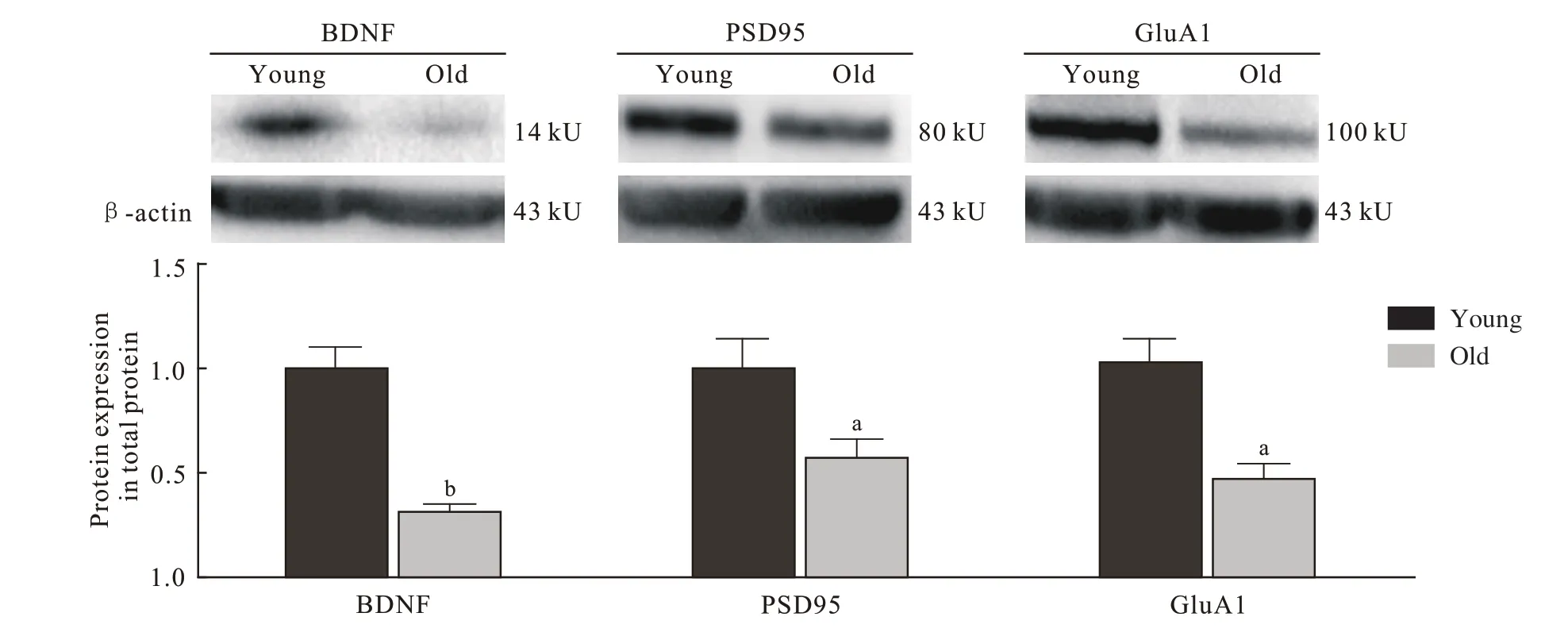
图 4 两组小鼠海马总蛋白BDNF、 PSD95、 GluA1的表达量(n=5; aP <0.05, bP <0.01)Fig. 4 Expression levels of BDNF, PSD95, GluA1 in hippocampus total protein of mice (n=5; aP <0.05, bP <0.01)
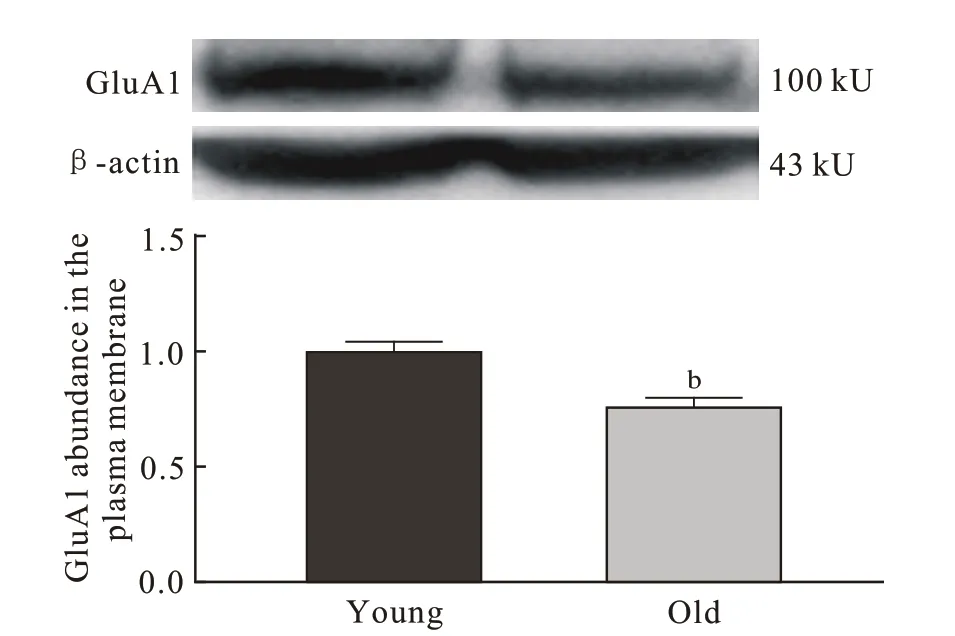
图 5 两组小鼠海马膜蛋白GluA1的表达量(n=5; bP <0.01)Fig. 5 Expression levels of GluA1 in hippocampal membrane protein of mice (n=5; bP <0.01)
讨 论
本研究通过空间获得性训练发现两组小鼠空间学习记忆能力随着训练时间的增长有逐渐提高的趋势,但青年组比老年组学习记忆快、学习能力强(图1)。空间探索实验提示老年小鼠24 h 参考记忆能力下降(图2)。工作记忆检测提示老年小鼠短期学习记忆力也下降(图3)。综上可见,衰老是老年小鼠学习记忆能力下降的关键因素。另外在空间获得性训练时发现,通过连续5 d 的重复学习和记忆巩固,两组小鼠在第5 天可达到接近相似的空间学习记忆效果,这提示该项学习可能存在封顶效应,也提示正常老年小鼠通过持续的学习训练可以达到和青年小鼠相似的空间学习成果。然而,在学习停止24 h 后老年小鼠的空间参考记忆能力明显下降,再次证明衰老对小鼠空间记忆的影响。
已知海马结构和功能完整性对于正常的学习和记忆巩固至关重要,但这种结构特别容易受到衰老过程的影响[9]。既往研究发现,衰老的海马会发生诸多与老年性认知能力下降相关的神经生物学改变,包括氧化应激和神经炎症的增加,细胞内信号传导和基因表达的改变,以及神经发生和突触可塑性的降低等[10]。其中,突触可塑性被认为是包括学习、记忆在内的大脑高级认知行为的关键分子机制[11]。
研究发现增强神经发生可以改善海马依赖性学习记忆功能,而海马神经发生减少会导致认知功能受损[12]。洪岸[13]的研究发现,老年记忆减退大鼠在海马CA1 区的突触素含量明显减少,齿状回分子层突触数密度也明显减少。BDNF 主要表达于中枢神经系统的神经元内,是维持神经元完整性和促进神经细胞生长与分化的重要调节因子[14],同时具有促进突触生长、调节突触可塑性及参与学习记忆的功能[15-16]。Erickson 等[17]认为神经营养支持的中断,尤其是BDNF 表达和信号传递的中断,与年龄相关的认知缺陷有关。Schmidt 和Duman[18]发现可通过给予外源性BDNF 逆转空间记忆受损和神经发生减少。本研究通过Western blot的方法发现老年组小鼠海马区BDNF 的表达量明显低于青年组,提示小鼠海马区BDNF 表达量下降在年龄相关性学习记忆衰退中具有不可或缺的作用。
PSD95 作为突触后膜胞质面细胞骨架网内最主要的细胞骨架蛋白,是PSD 大小和突触强度的重要决定因素,在神经元发育、长时程增强(longterm potentiation,LTP)及认知功能中非常必要[19],在突触结构、功能和可塑性等方面也发挥重要作用[20-21]。本研究显示老年组小鼠海马区PSD95 表达显著下降,这与VanGuilder 等[22]蛋白组学研究发现PSD95 随着年龄增长表达逐渐下降的研究结果一致。结合其在神经突触中发挥的重要作用,我们有理由推测老年小鼠海马区PSD95 表达下降可能影响其学习记忆功能。
AMPAR 是由4 种亚基(GluA1 ~ 4)组成的谷氨酸门控离子通道,介导大脑中大部分快速兴奋性突触传递,并参与大脑发育和突触可塑性[23]。AMPAR 并不是完全稳定,大约50%的AMPAR 通过质膜内布朗扩散不断移动,促进突触和突触外部的持续交换[24]。AMPAR 快速转运到神经元质膜被认为是学习和记忆的基本生物学过程[25],而海马的长时程增强作为突触可塑性的主要形式,也被认为是学习和记忆的分子基础,且依赖于AMPAR快速募集到突触后膜[7]。早期AMPAR 转运模型表明,长尾AMPAR(GluA1)在LTP 过程中会被迅速聚集到突触[26]。也有研究证实GluA1 C 末端在LTP 中起关键作用[27]。Sanderson 等[28]还发现,与正常野生型小鼠相比,GluA1-/-小鼠Y 形迷宫空间新颖性偏好功能受损,因此认为GluA1 对于短期学习非常重要。本研究在同样观察短期学习记忆能力的Morris 水迷宫工作记忆测试中发现,老年组小鼠在原平台象限停留时间更久(P <0.05),且老年组海马区总蛋白和膜蛋白中GluA1 表达量均明显低于青年组(P <0.05),这提示老年小鼠海马内可以快速募集并转运的AMPAR 数量及实际转运到质膜的AMPAR 数量均明显减少,因此海马区AMPAR 亚基GluA1 表达显著下降可能是影响老年小鼠工作记忆测试表现的重要因素。
当前对于年龄相关性认知下降有诸多推论,海马突触和记忆功能障碍的分子机制也尚不清楚。已知PSD95 和GluA1 对LTP 这一突触可塑性主要形式均有重要作用。有研究显示海马PSD95通过与AMPAR 相关蛋白Stargazin 的相互作用将AMPAR 锚定在突触上,且在增加突触PSD95 的水平时可以在不改变表面AMPAR 数量的情况下募集新的AMPAR 到突触[29]。而新近研究显示在无PSD95 蛋白水平动态调节的情况下,AMPAR 的突触可塑性也可能发生[30]。BDNF 对PSD95 的调节也被认为是LTP 形成和维持的基本机制[31]。BDNF还被认为可诱导AMPAR递送到突触[32]。由上可见,BDNF、PSD95、GluA1 三个突触功能相关蛋白之间联系密切且均与学习记忆相关,其中含有GluA1亚基的AMPAR 快速募集到突触作为学习记忆的必经生物学过程,值得进一步关注。本研究中老年组小鼠突触功能相关蛋白表达一致下降势必会影响老年小鼠的学习记忆能力。而这三种突触功能相关蛋白对老年小鼠海马学习记忆影响的程度、各蛋白之间的相互关联,尤其是如何改善海马中含有GluA1 亚基的AMPAR 数量及其转运仍需进一步研究探讨。
