HPLC法同时测定食用植物酵素中12种有机酸
2020-10-23王珍珍沙如意王高坚徐成龙毛建卫朱姣琳
王珍珍,沙如意,*,王高坚,徐成龙,戴 静,葛 青,毛建卫,2,*,朱姣琳
(1.浙江省农产品化学与生物加工技术重点实验室,浙江省农业生物资源生化制造协同创新中心,浙江科技学院生物与化学工程学院,浙江杭州 310023;2.浙江工业职业技术学院,浙江绍兴 312000;3.富元生命科技(宁波)有限公司,浙江宁波 315194)
食用植物酵素(Edible plant source Jiaosu)[1]是以一种或多种新鲜蔬菜、水果和谷豆类、海藻类、食药两用本草类、菌菇类等食材为原料,加(或不加)糖类物质,经多种有益菌通过较长时间发酵而生产的功能性微生物发酵产品,拥有丰富的代谢产物、植物本身营养成分和益生菌等,特别是富含小分子功能成分,研究表明该类产品具有抗衰老、抗菌消炎、净化血液、增强机体免疫能力及解毒抗癌等多种保健功能[2-5]。
有机酸可影响食用植物酵素的口感、稳定性、pH等,具有抗菌活性、控制血糖水平和调节血脂异常[6-7],软化血管、助于消化吸收、改善食欲等功能,发酵过程中适当的酸度不仅能起到抑菌的作用,还能增强VC、花青素、花色苷等活性成分的稳定性[8],而且通过改变pH调控微生物的代谢,可使有机酸代谢成为酚类物质或风味物质的前体物质[9]。食用植物酵素中有机酸的组成除了受原料的影响,还与菌种、代谢等因素有关,有机酸的种类及含量会直接影响食用植物酵素产品的口感、风味和品质。用于定量评价发酵产品如发酵果蔬汁、酒类、醋类等中的有机酸含量主要方法有:液相色谱法、气相色谱法和毛细管电泳法等,其中液相色谱(HPLC)操作简便、精密度高,因而成为最广泛的鉴定发酵产品中有机酸的方法[10-11]。
本文采用HPLC法建立同时检测食用植物酵素中12种有机酸含量的方法,以此检测了5种食用植物酵素中有机酸的含量,并以12种有机酸含量为变量进行主成分分析和分层聚类热图分析,实现了对不同原料植物酵素中有机酸代谢产物的区分,以期为食用植物酵素发酵过程监测及品质控制提供方法学指导,同时为不同原料植物酵素发酵过程中有机酸代谢产物差异监测提供科学依据和理论基础。
1 材料与方法
1.1 材料与仪器
青梅酵素、沙棘酵素、火龙果酵素 浙江省农产品化学与生物加工技术重点实验室;博伊森莓酵素(由博伊森莓、菠萝、橙子发酵制备)、黄金酵素(由菠萝、橘子、葡萄发酵制备) 富元生命科技(宁波)有限公司;草酸、富马酸(98%)、马来酸(99.7%)、苹果酸(98%)、柠檬酸(均为标准品) 中国药品生物制品检定所;酒石酸(色谱纯) Sigma公司;抗坏血酸、莽草酸、没食子酸、乙酸、乳酸、磷酸二氢钾(色谱纯) 上海阿拉丁生化科技股份有限公司;甲醇(色谱纯) 美国天地有限公司;磷酸(色谱纯) 上海长哲生物科技有限公司。
Allegra X-12R型冷冻离心机 美国贝克曼库尔特有限公司;Waters e2695高效液相色谱仪 美国Waters公司。
1.2 实验方法
1.2.1 样品预处理 配制0.01 mol/L KH2PO4溶液,用磷酸调pH至2.7,用于稀释样品和配制标准溶液。取适量样品,10000 r/min高速离心10 min,取上清液,适当稀释后过0.22 μm的微孔滤膜,用于有机酸分析。
1.2.2 有机酸混合标准溶液的配制 精确称取各有机酸,配制草酸、酒石酸、苹果酸、莽草酸、抗坏血酸、乳酸、乙酸、马来酸、柠檬酸、富马酸、琥珀酸、没食子酸的混合标准溶液,其浓度分别为0.095、1.000、1.000、0.009、0.100、1.00、1.069、0.0096、1.000、0.0108、1.000、0.0098 mg/mL,分别将其不稀释,稀释20倍、10倍、5倍、4倍,得到不同溶度的标准混合液,以浓度为横坐标,峰面积为纵坐标绘制标准曲线。
1.2.3 HPLC分离条件优化 色谱柱:AtlantisRR T3色谱柱(250 mm×4.6 mm,5 μm);流动相:A:甲醇,B:KH2PO4,用磷酸调pH至2.7;流速:1 mL/min,等度洗脱,检测器:光电二极管阵列检测器,进样量:10 μL。通过对标准品的波长扫描,确定检测波长,3D分辨率设置为1.2 nm;通过改变缓冲盐浓度(以0.01、0.02、0.04 mol/L KH2PO4等不同浓度的缓冲溶液为水相,流动相A∶B=2∶98,柱温20 ℃),流动相比例(以0.01 mol/L KH2PO4缓冲溶液为水相,流动相分别为A∶B=1∶99、2∶98、3∶97、4∶96,柱温20 ℃),柱温(以0.01 mol/L KH2PO4缓冲溶液为水相,流动相A∶B=2∶98,柱温分别为20、25和30 ℃),优化HPLC分离条件。
1.2.4 方法学考察实验 通过线性关系、检出限、加标回收率、精密度等考察方法的可行性。
1.2.5 主成分分析和分层聚类热图分析 通过主成分分析的思想,对多维数据进行降维处理,以实现利用较少的变量表达原来多重复杂变量信息的目的。以12种有机酸为变量,5种食用植物酵素样品作为研究对象,基于R软件(R x64 3.6.2)对数据进行主成分分析和分层聚类热图分析。
1.3 数据处理
使用Origin 8.6软件和Waters e2695自带的Empower 3软件对数据进行处理。
2 结果与分析
2.1 HPLC分离条件优化
2.1.1 检测波长的确定 用光电二极管阵列检测器,检测器在190~400 nm范围内分别对12种有机酸进行波长扫描。结果表明,各有机酸的最大吸收波长分别为:莽草酸:212.4 nm;乙酸:201.8 nm;马来酸:210.0 nm;富马酸:208.9 nm;没食子酸:214.7 nm;草酸、酒石酸、苹果酸、抗坏血酸、乳酸、柠檬酸和琥珀酸均在210 nm附近有较大吸收。综上,选择210 nm作为有机酸的检测波长。
2.1.2 缓冲盐浓度的选择 有机酸为弱酸,在水溶液中存在着解离平衡,向流动相中加入磷酸盐,提高H+浓度,有利于有机酸保持分子态,增加其在色谱柱上的保留时间[12]。各条件下分离效果见图1。从图1中可以看出,各有机酸均能有效分离,分离度较好,峰型较好,KH2PO4缓冲溶液浓度的改变对各有机酸的分离效果影响不大,考虑到高盐度对泵和色谱柱的影响,采用0.01 mol/L KH2PO4作为流动相缓冲液,这与Scherer等的研究结果一致[13]。
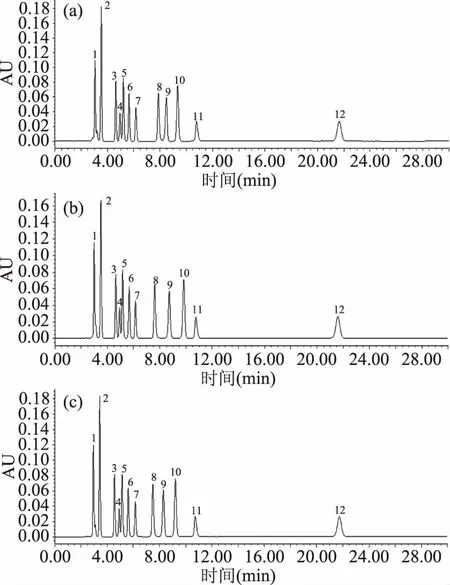
图1 流动相中不同浓度KH2PO4缓冲液条件下有机酸混合标准品色谱图
2.1.3 流动相中甲醇比例的选择 增加流动相中甲醇的比例,有机酸疏水基与固定相的相互作用减弱,保留时间缩短,能有效改善峰形[14]。流动相中甲醇的比例对有机酸分离效果的影响见图2,由图2可知:随着流动相中甲醇含量的增加,分析时间缩短。当流动相中甲醇含量为1%时,抗坏血酸与乳酸有部分色谱峰重叠;甲醇含量为2%,各有机酸可有效分离;甲醇含量为3%时,莽草酸与抗坏血酸色谱峰有小部分重叠;当甲醇含量为4%时,苹果酸、莽草酸与抗坏血酸的色谱峰有部分重叠,富马酸和琥珀酸的色谱峰重叠,不能分离。综上所述,确定流动相中甲醇的比例为2%。
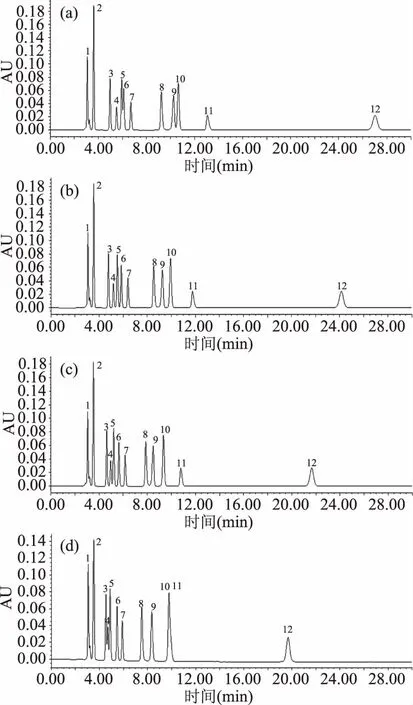
图2 流动相中不同浓度甲醇条件下混合有机酸标准品色谱图
2.1.4 柱温的选择 温度升高,可降低传质阻力,缩短分离时间。不同柱温下,有机酸的分离效果见图3。由图3可知:25 ℃时,莽草酸与抗坏血酸的分离度降低,马来酸与柠檬酸的分离度降低;30 ℃时,莽草酸与抗坏血酸色谱峰部分重叠,马来酸与柠檬酸色谱峰重叠,不能有效分离,20 ℃条件下,各种有机酸分离度及峰形较好。故选择较优的色谱柱温度为20 ℃。
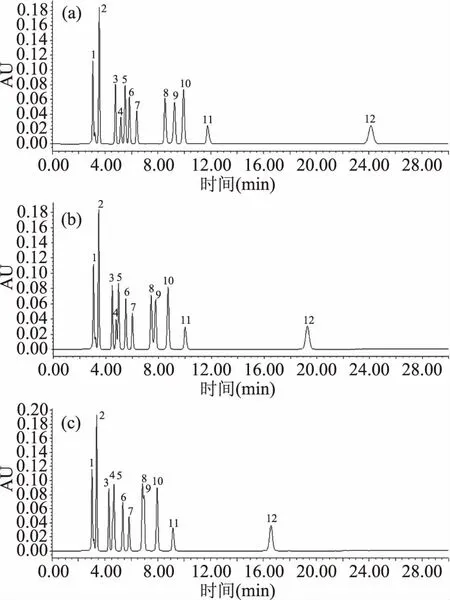
图3 不同柱温条件下混合有机酸标准品色谱图
综合上述实验结果,确定HPLC分离有机酸的较优条件为:检测波长210 nm,流动相甲醇:KH2PO4(0.01 mol/L,pH2.7)=2∶98 (V/V),柱温:20 ℃。
2.2 有机酸标准曲线和检出限
分别吸取不同浓度的12种有机酸标准溶液,在上述优化后的HPLC分离条件下采集数据并进行分析。以12种标准有机酸的峰面积(y)对各自的浓度(x)进行线性回归分析,所得各种有机酸的标准曲线和线性范围如表1所示,决定系数为0.9994~0.9999,表明各有机酸含量与其浓度之间线性关系良好。根据信噪比确定检出限(RSN=3),从表1可以看出,12种有机酸的检出限在0.05~12.47 μg/mL范围内。
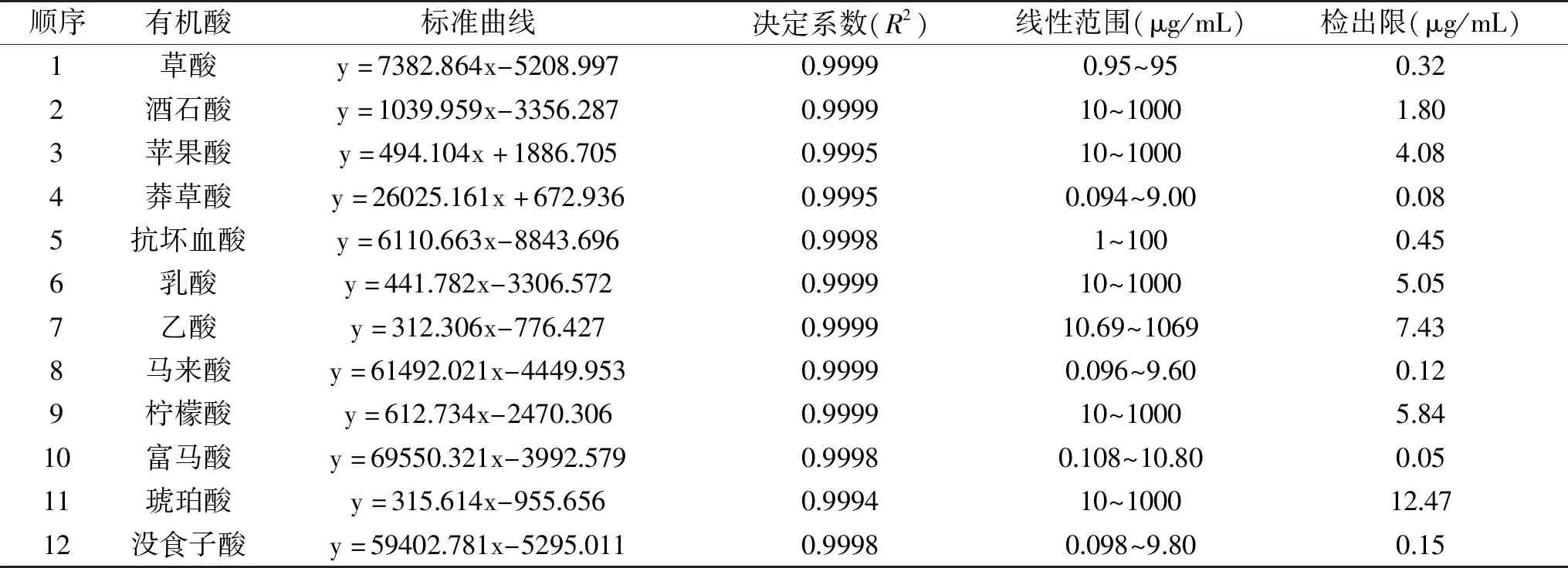
表1 有机酸标准曲线及检出限
2.3 加标回收率实验
取青梅酵素发酵液2份,一份中加入有机酸标准品,平行测定3次,计算相应的加标回收率和相对标准偏差(RSD),结果见表2,各有机酸的加标回收率在87.28%~109.78%之间,回收率较好,而且各种有机酸的相对标准偏差RSD的范围在0.11%~4.19%之间,说明本方法具有较好的灵敏度和重复性。
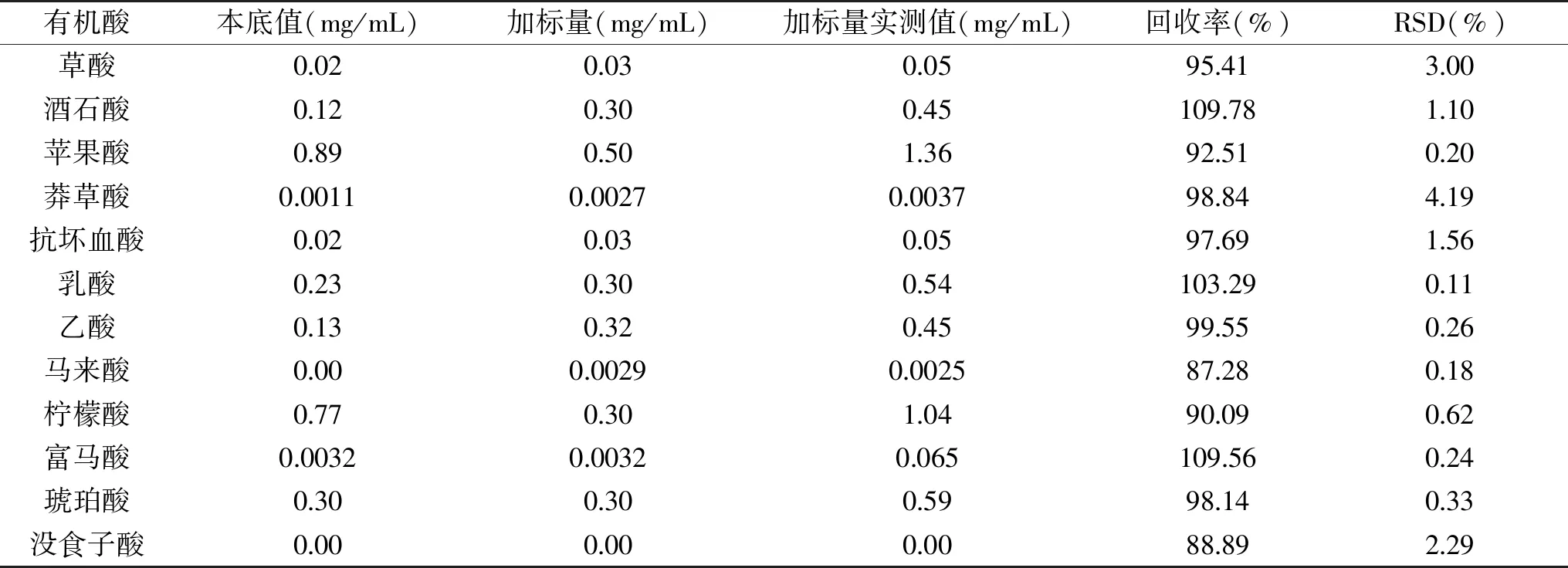
表2 样品加标回收率
2.4 精密度实验
取有机酸标准溶液,连续进样6次,测定各组分的含量,计算精密度,结果见表3,该方法的精密度RSD(%)在0.49%~1.49%之间。
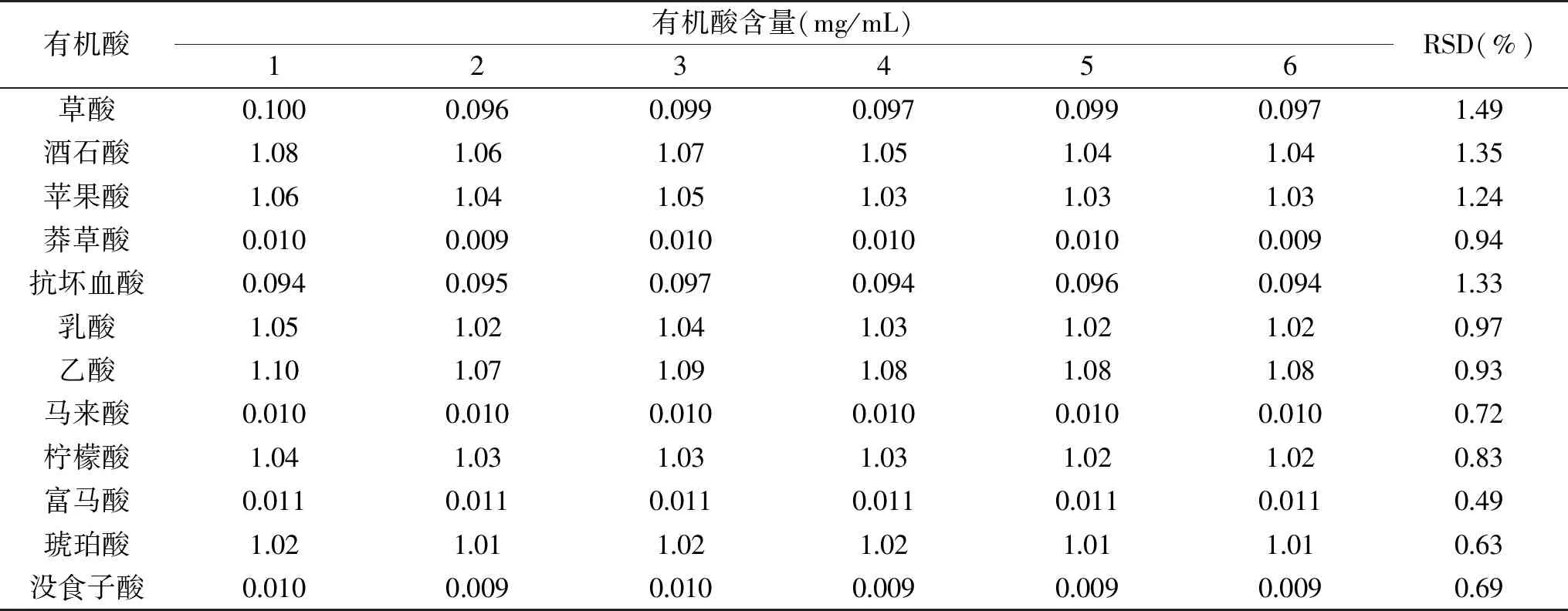
表3 方法的精密度
2.5 5种食用植物酵素中有机酸含量测定
采用上述优化后的液相色谱条件,对不同原料制备的青梅酵素、沙棘酵素、火龙果酵素、博伊森莓酵素和黄金酵素5种食用植物酵素中有机酸的种类及含量进行检测,所得色谱图峰型均较好,分离度均较高,有机酸测定结果见表4。
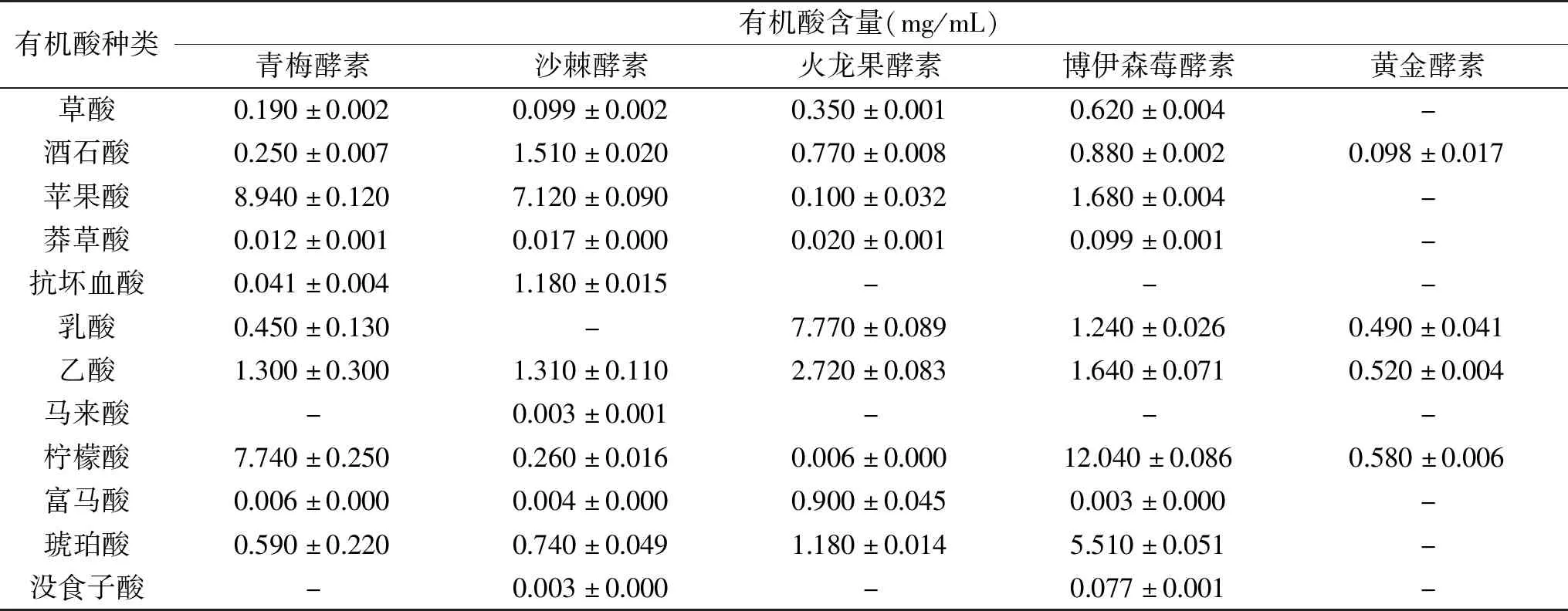
表4 5种食用植物酵素中有机酸含量测定结果
食用植物酵素中的有机酸除了源于原料本身外,还可以通过微生物的代谢途径产生。从表4中可以看出,5种食用植物酵素中均检测到酒石酸、乙酸和柠檬酸。青梅酵素中检测到10种有机酸,其中苹果酸、柠檬酸的含量较高,乙酸次之;研究表明:青梅原料中含有草酸、酒石酸、苹果酸、抗坏血酸、乳酸、乙酸、柠檬酸、马来酸和琥珀酸,其中柠檬酸的含量最高,其次是苹果酸,马来酸的含量极低[15-16];本研究在青梅酵素中也检测到草酸、酒石酸、苹果酸、乳酸、乙酸、柠檬酸及琥珀酸,除此之外还检测到了少量的莽草酸和富马酸。莽草酸作为芳香氨基酸等的前体,在经莽草酸途径合成的同时,也会进入其他代谢途径;富马酸是微生物进行三羧酸循环的中间产物,生成的同时也会通过其它途径进行分解代谢,因此在青梅酵素中莽草酸和富马酸的含量较低。本研究从青梅酵素中未检测到马来酸,可能是因为马来酸在青梅酵素发酵的微生物代谢过程中不容易积累。
沙棘酵素中检测到11种有机酸,其中苹果酸的含量最高,其次是酒石酸、乙酸和抗坏血酸,草酸和柠檬酸的含量较低。研究表明:沙棘原料中含有草酸、柠檬酸、酒石酸、苹果酸、琥珀酸、抗坏血酸和乳酸,其中苹果酸含量最高[17-18]。本研究在沙棘酵素中还检测到莽草酸、乙酸、马来酸、富马酸和没食子酸,未检测到乳酸。沙棘酵素中检测到没食子酸的含量为0.003 mg/mL,孙燕[18]采用高效液相色谱-高分辨质谱法从沙棘叶和茎中检测到没食子酸,但是在沙棘果中没有检测到没食子酸;沙棘酵素中的没食子酸可能是由莽草酸途径生成的3-脱氢莽草酸,在莽草酸脱氢酶或脱氢莽草酸脱氢酶作用下生成[19]。
火龙果酵素中检测到9种有机酸,其中乳酸含量最高,其次是乙酸。蒋侬辉等[20]从火龙果原料中检测到草酸、酒石酸、苹果酸、乙酸、乳酸、柠檬酸、琥珀酸、抗坏血酸8种有机酸,其中苹果酸的含量最高,其次是柠檬酸。本研究从火龙果酵素中除检测到上述7种有机酸(无抗坏血酸)外,还检测到莽草酸和富马酸。
博伊森莓酵素由博伊森莓、菠萝和橙子3种水果发酵而成,本研究从博伊森莓酵素中检测到10种有机酸:草酸、酒石酸、苹果酸、莽草酸、乳酸、乙酸、柠檬酸、富马酸、琥珀酸和没食子酸,其中柠檬酸的含量最高,其次是琥珀酸,苹果酸、乙酸、乳酸次之。研究表明:3种水果原料中含有柠檬酸、琥珀酸、马来酸、苹果酸、酒石酸、抗坏血酸、乳酸、草酸8种有机酸[21-25]。对比原料中的有机酸种类,发酵过程中新产生了莽草酸、乳酸、乙酸、富马酸和没食子酸。
黄金酵素由菠萝、橘子和葡萄3种水果发酵而成,本研究从黄金酵素中检测到酒石酸、乳酸、乙酸和柠檬酸,但4种有机酸的含量相对较低。研究表明:3种水果原料中含有苹果酸、柠檬酸、草酸、莽草酸、酒石酸和乳酸6种有机酸[26-28],对比原料中的有机酸种类,发酵过程中丙酮酸、苹果酸、富马酸等有机酸可能在发酵过程中转化成其他代谢物。
2.6 5种食用植物酵素中有机酸代谢产物的主成分分析
各种有机酸赋予了酵素不同的风味特性,苹果酸具有温和愉悦性的酸味,柠檬酸具有温和的酸味,乙酸具有刺激性酸味,乳酸酸味温和适中,琥珀酸有鲜味。不同原料制备的植物酵素中有机酸的种类及含量有较大差异,因而不同原料制备的食用植物酵素表现出不同的风味特征。为了明确不同种类有机酸的差异对于酵素风味特征的影响,以5种食用植物酵素为研究对象,以12种有机酸作为研究变量,利用R语言对所得的有机酸含量进行主成分分析,选取特征值大于1的成分为主成分,结果如图4所示,前2个主成分的方差贡献率分别为42.48%和34.52%,累计方差贡献率达到77.00%,表明前2个主成分能够较好地代表5种食用植物酵素中总有机酸77.00%的信息。其中,变量苹果酸、柠檬酸在第一主成分的正方向有较高的载荷系数,说明与第一主成分正相关;变量草酸、酒石酸、莽草酸、抗坏血酸、马来酸、富马酸、没食子酸在第一主成分的负方向有较高的载荷系数,说明与第一主成分负相关;变量乙酸、乳酸在第二主成分的正方向有较高的载荷系数,说明与第二主成分正相关;变量苹果酸在第二主成分的负方向有较高的载荷系数,说明与第二主成分负相关。因此,柠檬酸、苹果酸和乳酸是影响食用植物酵素的主要特征有机酸成分,对不同原料制备的植物酵素差异影响较大。
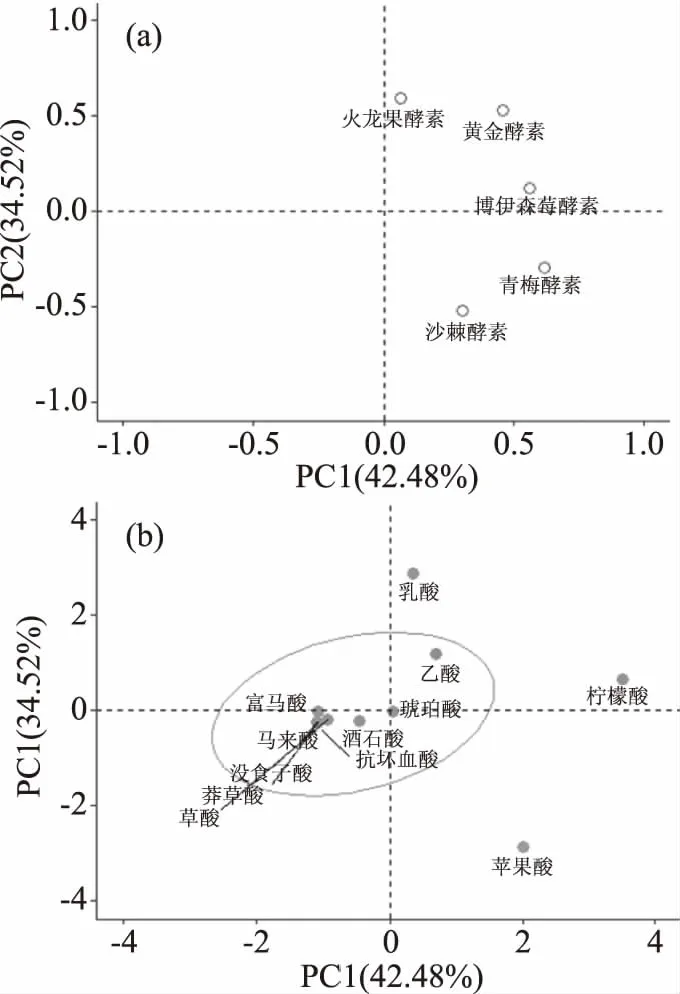
图4 不同酵素样品的有机酸主成分分析
样品博伊森莓酵素和青梅酵素沿第一主成分正方向分布,在第二主成分方向的投影比较短,表明柠檬酸、苹果酸占有较高的比重,对两种酵素的风味产生明显影响。沙棘酵素沿第二主成分负方向分布,表明苹果酸占有较高的比重,对于沙棘酵素的风味产生明显影响。火龙果酵素和黄金酵素沿第二主成分正方向分布,表明乙酸和乳酸占有较高的比重,从而显著影响两种酵素的风味特征。这些有机酸含量的差异,赋予了不同植物酵素的特征风味差异。
2.7 5种食用植物酵素中有机酸代谢产物的聚类分析
为了进一步确定不同原料制备的植物酵素有机酸代谢产物表达的定量差异,对5种植物酵素样品进行层次聚类分析,并绘制了样品中有机酸代谢产物含量的热图,结果如图5所示,通过欧式距离法聚类分析,把5种来源食用植物酵素分成3类,火龙果酵素和黄金酵素为一类,乳酸和乙酸含量较高;青梅酵素和沙棘酵素为一类,苹果酸含量较高;博伊森莓酵素为一类,其中的柠檬酸和琥珀酸含量较高。对五种不同原料制备的食用植物酵素有机酸进行聚类分析,可以将有机酸分为三类,一类为OA1:草酸、酒石酸、莽草酸、乳酸、乙酸、富马酸、琥珀酸、没食子酸、马来酸和抗坏血酸;一类为OA2:苹果酸;另一类OA3为柠檬酸;这与图4有机酸的主成分分析结果相一致。
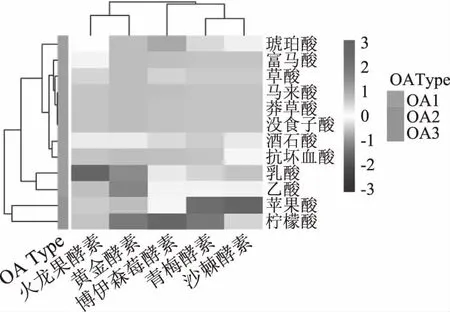
图5 不同酵素样品的有机酸热图和聚类分析
3 结论
本文建立了同时检测食用植物酵素中12种有机酸的HPLC方法,优化后的色谱条件为:检测波长210 nm,流动相为甲醇:KH2PO4(0.01 mol/L,pH2.7)=2∶98 (V/V),柱温20 ℃;所得各种有机酸的标准曲线决定系数为0.9994~0.9999,加标回收率为87.28%~109.78%之间,该方法的精密度RSD(%)在0.49~1.49%之间,该方法具有操作简便、快速、准确度高、精密度高、重复性好等优点。利用此法对青梅酵素、沙棘酵素、火龙果酵素、博伊森莓酵素和黄金酵素5种食用植物酵素中的有机酸种类及含量变化进行测定,分别检测到10、11、9、10、4种有机酸,均检测到酒石酸、乙酸和柠檬酸。该方法适合食用植物酵素样品中有机酸的检测,为食用植物酵素样品中有机酸检测提供方法学基础。
对5种食用植物酵素的有机酸含量进行主成分分析,提取2个主成分反映酵素中有机酸的77.00%的信息。柠檬酸、苹果酸和乳酸是食用植物酵素主要特征有机酸成分,对不同原料来源的植物酵素差异影响较大。通过分层聚类热图分析,可将5种来源的食用植物酵素分成三类,其中火龙果酵素和黄金酵素为一类,乳酸和乙酸含量较高,青梅酵素和沙棘酵素为一类,苹果酸含量较高,博伊森莓酵素为一类,柠檬酸和琥珀酸含量较高。对5种不同原料制备的食用植物酵素有机酸进行聚类分析,可以将有机酸分为三类,一类以乳酸为主,一类以苹果酸为主,另一类以柠檬酸为主。本研究通过对不同原料制备的食用植物酵素中有机酸含量进行分析,阐明了不同原料发酵的食用植物酵素有机酸的差异,为食用植物酵素的开发利用提供数据支撑。
