复方北冬虫夏草提取工艺及其对链尿佐菌素诱导1型糖尿病大鼠的降血糖作用研究
2020-10-23卢学春段懿涵徐广宇安丽萍杜培革孙晶波
徐 健,卢学春,段懿涵,王 珊,盛 瑜,徐广宇,安丽萍,杜培革,孙晶波,*
(1.北华大学药学院,吉林吉林 132013;2.解放军总医院南楼血液科,北京 100853)
糖尿病是一种常见的代谢紊乱性疾病[1],主要与遗传、年龄、收入、社会地位和受教育程度等因素相关[2]。该病以慢性高血糖为主要特征,常伴有“三多一少”症状,长期处于病理状态可引发肾、肝等多器官疾病,进而严重影响患者的生活质量。良好的血糖控制可降低与糖尿病相关慢性病的风险及并发症[3]。因此,如何预防及治疗糖尿病已成为重要的全球议题。链尿佐菌素(STZ)是由产色链霉菌产生的抗生素,常作为糖尿病模型诱导剂,选择性破坏胰腺β细胞,使细胞活性降低,导致胰岛素对组织摄取葡萄糖和高血糖的敏感性较差[4],还能够影响肝细胞和肾小管细胞的表达,这也是STZ对肝脏和肾脏产生毒性的原因之一[5]。
北冬虫夏草(Cordycepsmilitaris),别名蛹虫草、北虫草,隶属于子囊菌亚门,麦角菌科,虫草属[6],性平,味甘,入肺肾二经,既补肺阴,又补肾阳,是长白山地区资源丰富且药食同源的道地药材,其主要活性成分有腺苷、多糖、虫草酸、虫草素以及氨基酸等[7]。其中的多糖类成分具有多种生物活性。Liu等[8]研究表明,北冬虫夏草多糖具有激活免疫细胞、改善和修复受损胰岛细胞的降糖功效,并能显著改善糖尿病小鼠体重及其脏器指数。黄芪、枸杞、西洋参也有不同程度的降糖和提高免疫力的作用[9-11],但以北冬虫夏草为主药协同其他药材发挥降糖效果鲜有研究。因此,本试验即通过观察复方北冬虫夏草提取物对STZ诱导1型糖尿病大鼠的血糖相关指标以及氧化应激和脂代谢的影响,探究其降糖功效,为药食同源类中药品种在中药降糖药物或保健品的开发应用提供科学依据。
1 材料与方法
1.1 材料与仪器
北冬虫夏草 铁岭市云欣虫草生物有限公司开原分公司;黄芪、枸杞子、西洋参 威海松岭诺可佳中药饮片股份有限公司;Amberlite-XAD-2大孔树脂 郑州艾诺化工科技有限公司;葡萄糖、人参皂苷 中国药品生物制品鉴定所;乙醇等化学试剂 均为分析纯,沈阳华东试剂厂;Wistar雄性大鼠 长春市亿斯实验动物技术有限公司,许可证号码:SCXK(吉)-2016-0003;链脲佐菌素 Sigma公司;甘油三酯测定试剂盒、总胆固醇测定试剂盒、超氧化物歧化酶测试盒、丙二醛测定试剂盒、谷胱甘肽过氧化物酶测定试剂盒、胰岛素测试盒 南京建成生物工程研究所。
DHG-9070A真空干燥箱 上海一恒科学仪器有限公司;UV2600紫外分光光度计 岛津;R5005KB旋转蒸发仪 上海申生科技有限公司;TD-3213血糖仪 Roche Diagnostics Gmbh。
1.2 实验方法
1.2.1 复方北冬虫夏草提取物的制备 北冬虫夏草22.5 g、黄芪40 g、枸杞30 g、西洋参25 g→双馏水浸泡1.5 h→恒温水浴回流提取→滤液→浓缩→真空干燥至恒重→复方北冬虫夏草提取物。
操作要点:恒温水浴回流提取后过滤,收集滤液,于70 ℃条件下浓缩至膏状,于真空干燥箱中干燥至恒重,磨成粉末,计算提取率,密封备用。
提取率(%)=[干燥后所得粉末(g)/原料药材总重量(g)]×100
1.2.2 标准曲线的绘制及总皂苷含量计算 总皂苷含量采用紫外分光光度法测定[12],以人参皂苷Re为标品(2.000 mg/mL),绘制标准曲线,以1.2.1中提取物配制样品并测定其吸光度值,带入标准曲得皂苷质量,计算总皂苷含量。
总皂苷得率(%)=(样品容积÷测定取样量×总皂苷含量÷样品的总质量)×100
1.2.3 标准曲线的绘制及多糖含量计算 多糖含量采用“苯酚-硫酸分光光度测定法”测定[13],以葡萄糖为标品(0.100 mg/mL),绘制葡萄糖标准曲线,以1.2.1中提取物配制样品并测定其吸光度值,带入标准曲得多糖质量,计算多糖含量。
多糖得率(%)=[样品容积÷测定取样量×多糖含量÷样品的总质量]×100
1.2.4 单因素实验 根据前期预实验,提取率能够间接反映提取物中多糖的含量,且测定简单,故选择提取率作为单因素实验检测指标。
1.2.4.1 料液比对提取率的影响 按1.2.1中配比称取样品,固定反应条件为提取时间1 h,提取次数1次,提取温度70 ℃,考察不同料液比(1∶6、1∶8、1∶10、1∶12、1∶14 g/mL)对提取率的影响。
1.2.4.2 提取时间对提取率的影响 固定反应条件料液比1∶8 g/mL,提取次数3次,提取温度70 ℃,考察不同提取时间(0.5、1、1.5、2、2.5 h)对提取率的影响。
1.2.4.3 提取次数对提取率的影响 固定反应条件料液比1∶8 g/mL,提取时间1 h,提取温度70 ℃,考察不同提取次数(1、2、3、4、5次)对提取率的影响。
1.2.4.4 提取温度对提取率的影响 固定反应条件料液比1∶8 g/mL,提取时间1 h,提取次数1次,考察不同提取温度(60、65、70、75、85 ℃)对提取率的影响。
1.2.5 正交试验 根据预试验及单因素实验结果确定因素水平,详见表1。以多糖含量和提取率为考察指标,采用L9(34)正交试验优化提取工艺。
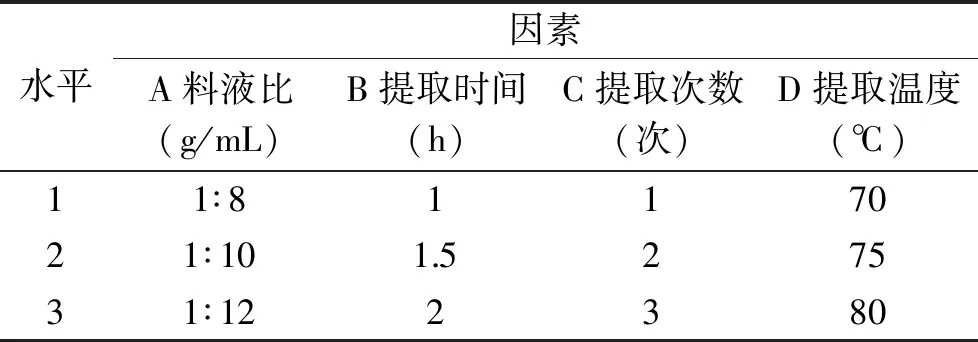
表1 正交试验的因素水平设计
1.2.6 STZ诱导大鼠糖尿病模型的建立 将饲养一周后的大鼠分出10只作为空白组,腹腔注射生理盐水。其余大鼠分别单次腹腔注射STZ溶液(STZ溶于0.1 mol·L-1、pH=4.3的柠檬酸/柠檬酸钠缓冲液中)50 mg/kg,单次注射STZ前均断粮不断水12 h,7 d后检测大鼠血糖值,以血糖值>15 mmol/mL为糖尿病模型建立成功标准。
1.2.7 动物给药和分组 取成模大鼠40只随机平均分为模型组(生理盐水)、低(250 mg/kg)、中(500 mg/kg)、高(1000 mg/kg)剂量组。空白组直接给予生理盐水。各组给药采取灌胃方式,每日一次,期间给予充足的水及饲料。给药12周后,用10%的水合氯醛麻醉,观察并记录各组实验大鼠的体重。
1.2.8 血糖值及血清胰岛素含量检测 麻醉后,腹主动脉取血,静置后4 ℃离心(3000 r/min)10 min,取血清,按照试剂盒说明书测定大鼠空腹血糖值和胰岛素含量。
1.2.9 大鼠肝组织中丙二醛(MDA)含量、超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-PX)活力和肾脏甘油三酯(TG)、总胆固醇(TC)含量检测 解剖实验大鼠,取肝脏和肾脏,严格按照试剂盒标准检测肝脏中MDA含量、SOD、GSH-PX活力及肾脏中TG、TC含量。
1.2.10 肾脏组织形态学观察 新鲜肾脏组织于福尔马林中固定24 h,经程序脱水、石蜡包埋后,5 μm切片,用于组织HE染色检测。
1.3 统计学处理
2 结果与分析
2.1 复方北冬虫夏草提取物制备工艺优化
2.1.1 人参总皂苷Re标准曲线 在560 nm波长下测定吸光度值,以人参皂苷Re质量为横坐标(mg),吸光度值为纵坐标,绘制人参总皂苷含量与吸光度的标准曲线(见图1),计算回归方程Y=3.035X+0.1062,R2=0.9976,线性关系良好。
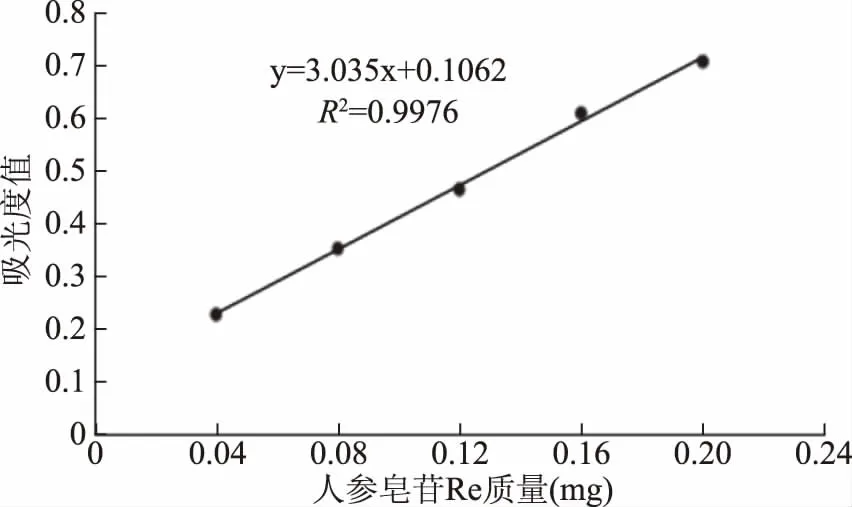
图1 人参皂苷Re标准曲线
2.1.2 葡萄糖标准曲线 在490 nm波长下测定吸光度值,以葡萄糖质量为横坐标(mg),吸光度值为纵坐标,绘制葡萄糖含量与吸光度的标准曲线(见图2),计算得回归方程Y=4.0694X+0.0129,R2=0.99746,线性关系良好。
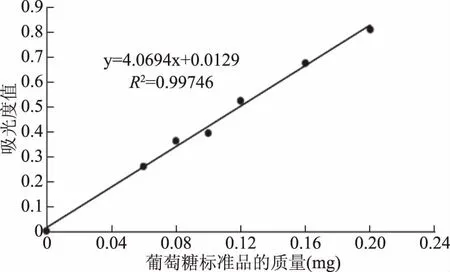
图2 葡萄糖标准曲线
2.1.3 单因素实验 单因素实验结果见图3~图6。结果表明,当料液比偏小时(图3),固/液两相间有效成分的浓度差较小,溶液黏性较大,不利于有效成分的溶出。随着料液比的增大,两相浓度差增大,提取率增高,当料液比达到1∶10 g/mL时,提取较为充分,而过大的料液比,不但造成了资源的浪费,对于提取效果也无明显影响,因此选择1∶8、1∶10、1∶12 g/mL三个因素进行正交试验。如图4所示,提取率随着时间的延长而升高,超过1.5 h后,提取率不再明显增加,考虑获得较高得率和工业生产能耗,选择1、1.5、2 h三个水平进行正交试验。如图5所示,当提取次数为2次时,提取率明显提高,且随时间的增加,变化率不再明显,考虑工业生产和材料成本,选择1、2、3次三个水平进行正交试验。如图6所示,随着提取温度的升高,提取率在75 ℃之后增加不再明显,故选择70、75、80 ℃三个水平进行正交试验。
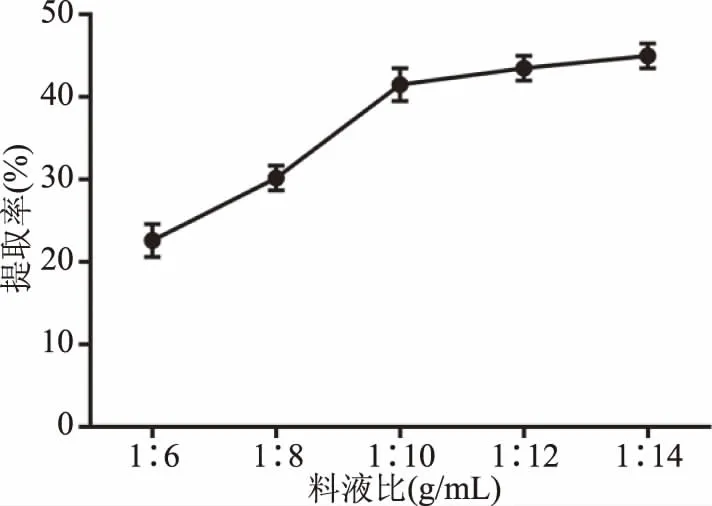
图3 料液比对提取率的影响
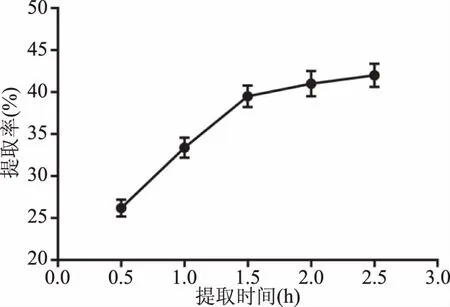
图4 提取时间对提取率的影响
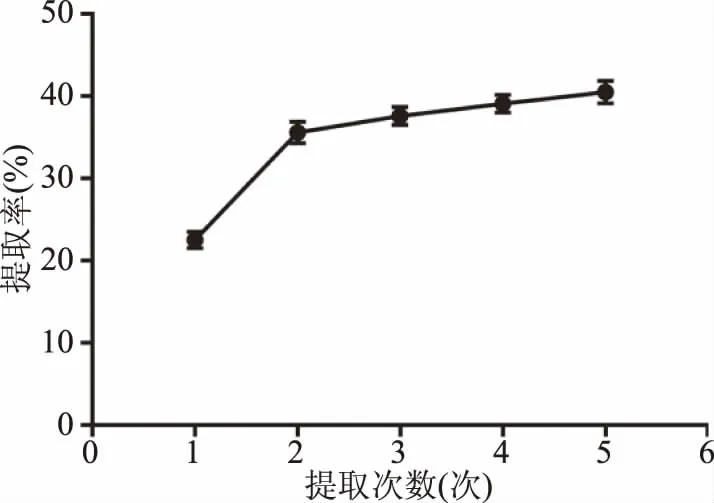
图5 提取次数对提取率的影响
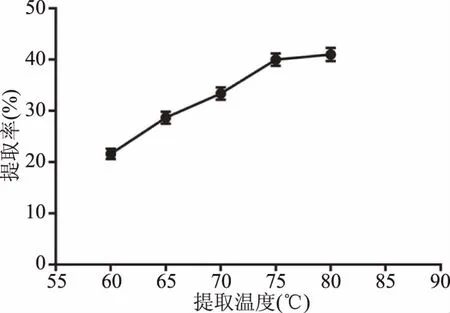
图6 提取温度对提取率的影响
2.1.4 正交试验结果及极差分析 对提取工艺进行优化,结合正交试验结果及极差分析,由表2可知,各因素对复方北冬虫夏草提取率的影响由大到小依次为提取次数>提取时间>料液比>提取温度,最佳因素的水平组合为A3B2C3D2;各因素对于多糖提取的影响由大到小依次为料液比>提取温度>提取时间>提取次数,最佳因素的水平组合为A1B2C3D1,各因素对于总皂苷提取的影响由大到小依次为提取次数>提取温度>提取时间>料液比,最佳因素的水平组合为A2B2C2D2和A2B2C3D2,三者搭配间唯有BC一致,根据直观分析和经济效益以及单因素实验结果等多方面考量,确定A2B2C3D1为最佳提取工艺参数,即料液比为1∶10 g/mL,提取3次,每次提取1.5 h,提取温度为70 ℃。经三次平行试验验证平均提取率为53.1%,平均多糖得率为5.1 g/10 g,平均总皂苷得率为1.3 g/10 g,与正交试验表中该组结果相近,证明该工艺重复性良好、稳定。
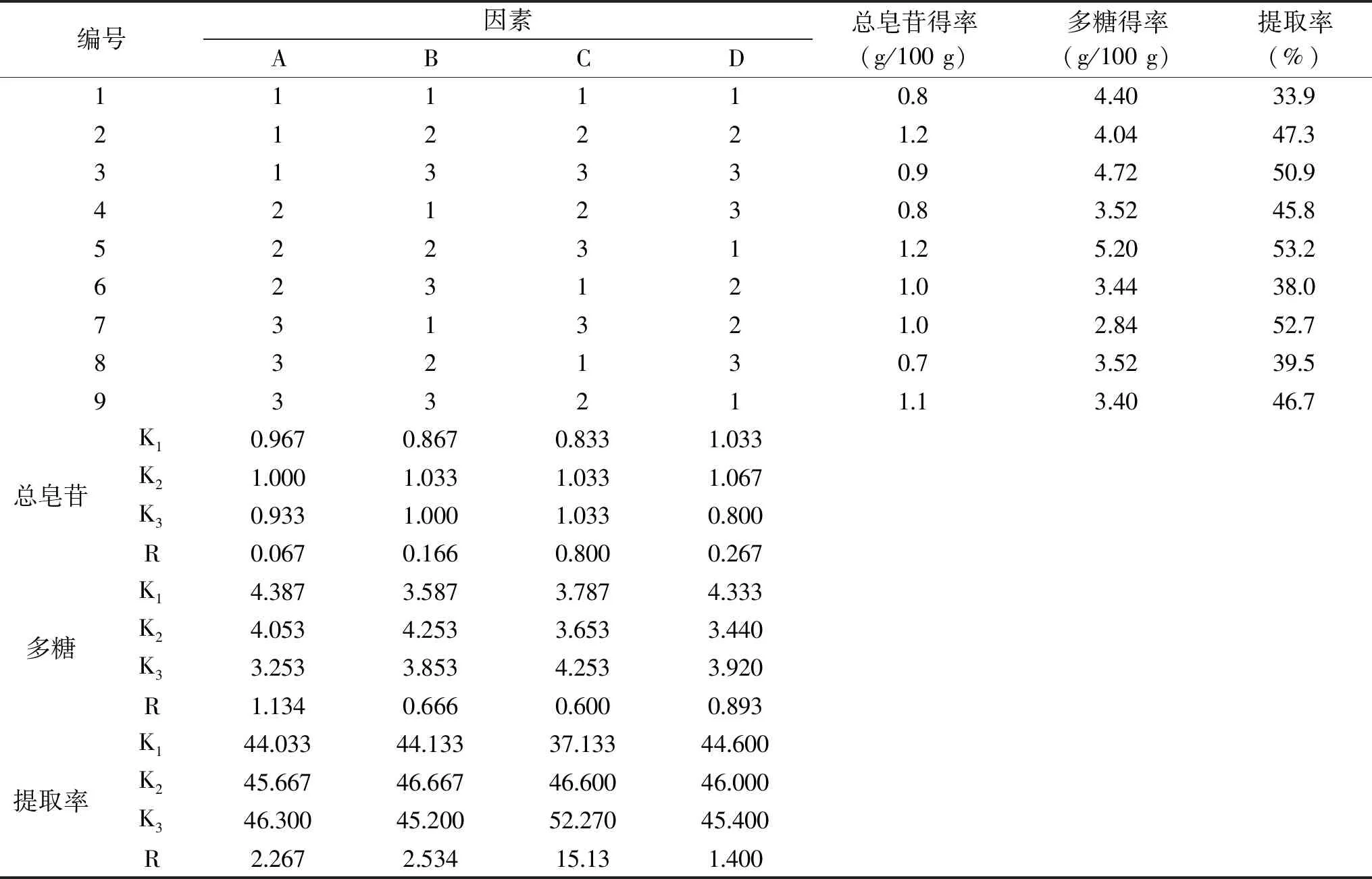
表2 正交试验结果及极差分析
2.2 糖尿病大鼠模型的建立
大鼠腹腔注射STZ溶液7 d后,检测大鼠血糖值,94%的大鼠符合血糖值>15 mmol/mL,模型建立成功。
2.3 复方北冬虫夏草对糖尿病大鼠体重的影响
由图7结果提示,与空白组相比,模型组体重极显著降低(P<0.01);与模型组比较,复方北冬虫夏草提取物高剂量组体重显著提高(P<0.05),低、中剂量组体重虽有上升趋势,但不显著(P>0.05),说明复方北冬虫夏草提取物具有改善糖尿病大鼠质量的作用。STZ诱导的糖尿病具有严重的体重减轻特征,这可能是因为肌肉和脂肪细胞组织退化以补偿能量损失[14],糖尿病作为一种长期代谢紊乱的疾病,长期病理状态下,高血糖及其并发症严重影响糖尿病大鼠身体状况及正常生活水平,因此复方北冬虫夏草提取物能够改善糖尿病大鼠的体重。
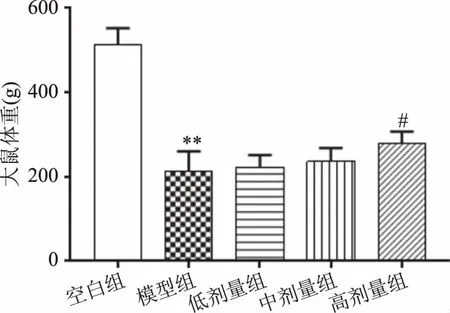
图7 复方北冬虫夏草提取物对大鼠体重的影响
2.4 复方北冬虫夏草对大鼠血糖值及胰岛素含量的影响
糖尿病是一种代谢性疾病,其特征是血液中葡萄糖水平升高以及体内胰腺分泌的胰岛素不足或功能性障碍[15],胰岛素是胰腺β细胞中响应各种刺激(例如葡萄糖、磺酰脲和精氨酸)而合成的一种蛋白质[16],体内胰岛素分泌不足或对胰岛素的抵抗会降低组织对葡萄糖的摄取,从而导致细胞内低血糖和细胞外高血糖。细胞内低血糖会导致糖原异生和糖异生,导致脂肪分解,形成糖尿病性酮症酸中毒,而细胞外高血糖则导致高血糖昏迷和渗透性糖尿病[17],因此观察血糖和胰岛素的含量变化在糖尿病治疗中至关重要。由表3可知,给药治疗12周后,与空白组相比,模型组大鼠血糖值极显著升高(P<0.01),血清中胰岛素含量极显著降低(P<0.01),再次证明STZ诱导1型糖尿病大鼠模型建立成功;与模型组相比,复方北冬虫夏草提取物中剂量组大鼠血糖值显著下降(P<0.05),高剂量组血糖值极显著下降(P<0.01),中、高剂量组大鼠胰岛素含量均显著升高(P<0.05),而低剂量组血糖值有降低趋势、血清中胰岛素含量有升高趋势,但无统计学意义(P>0.05),说明复方北冬虫夏草提取物具有改善糖尿病胰岛机能的作用,这一作用效果与给药剂量密切相关。

表3 各组大鼠血糖值及血清胰岛素含量(n=10)
2.5 复方北冬虫夏草对大鼠肝脏MDA含量、SOD及GSH-Px活力的影响
高血糖会通过葡萄糖自氧化作用增加ROS的产生,进而增加脂质氧化[18],而过量的ROS超出人体可清除的能力,会损坏细胞大分子,引起蛋白质糖基化和氧化变性,对细胞结构产生氧化应激损伤[19-20]。根据Antonio等[21]和Fukuda等[22]的研究,MDA是由于脂质过氧化作用而形成的,脂质过氧化作用可在脂质过氧化物与硫代巴比妥酸反应后用于测量脂质过氧化物,MDA含量常常可以反映机体内脂质过氧化的程度。由图8所示,与空白组相比,模型组大鼠肝脏MDA含量极显著升高(P<0.01),与模型组相比,复方北冬虫夏草低剂量组MDA含量显著下降(P<0.05),中、高剂量组MDA含量极显著下降(P<0.01),说明模型组脂质过氧化作用过激,经治疗后得到改善。
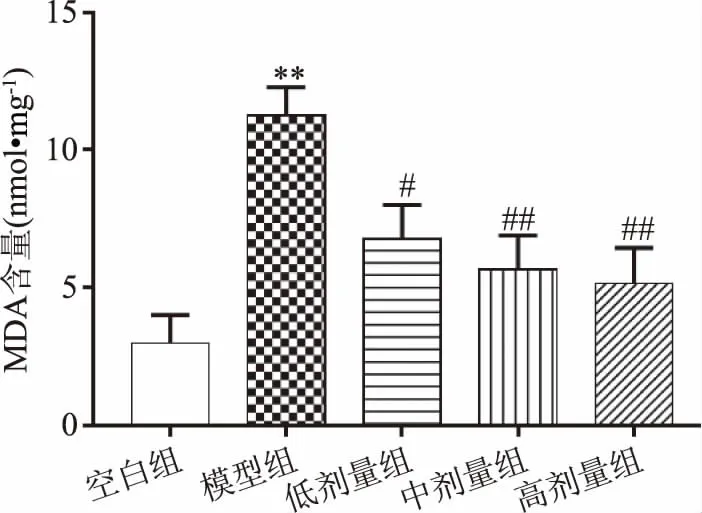
图8 复方北冬虫夏草提取物对MDA含量的影响
谷胱甘肽和SOD是糖尿病中氧化应激的生物标志物,糖尿病引起谷胱甘肽过氧化物酶和谷胱甘肽还原酶活性的改变,这些酶将过氧化物代谢为水,并将谷胱甘肽二硫化物转化回谷胱甘肽[15],其水平的任何改变都将使细胞易于产生氧化应激并因此损害细胞。SOD是体内抗氧化防御系统的主要金属酶,通过催化氧气代谢中ROS超氧化物与分子氧和过氧化物的比例,将超氧化物分解为其他毒性较小的化合物[23-24],维持机体氧化平衡。由图9、图10所示,与空白组相比,模型组大鼠SOD和GSH-Px活力极显著下降(P<0.01),说明随着发病时间的推移,糖尿病大鼠氧化平衡破坏,氧化应激严重紊乱,与模型组相比,复方北冬虫夏草低、中剂量组SOD活力显著增加(P<0.05),高剂量组SOD活力极显著升高(P<0.01);而三个剂量组大鼠GSH-Px活力均显著升高(P<0.05),这与梁勇刚[25]对穿心莲内酯注射液对1型糖尿病大鼠氧化应激的研究结果相一致,表明复方北冬虫夏草提取物可提高糖尿病大鼠的氧化应激水平,具有明显的抗氧化能力。
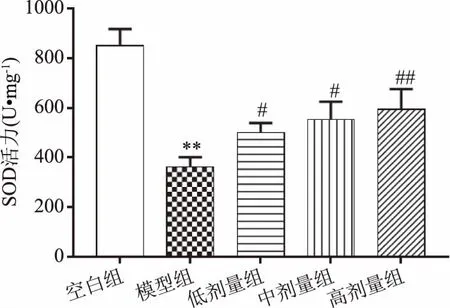
图9 复方北冬虫夏草提取物对SOD活力的影响
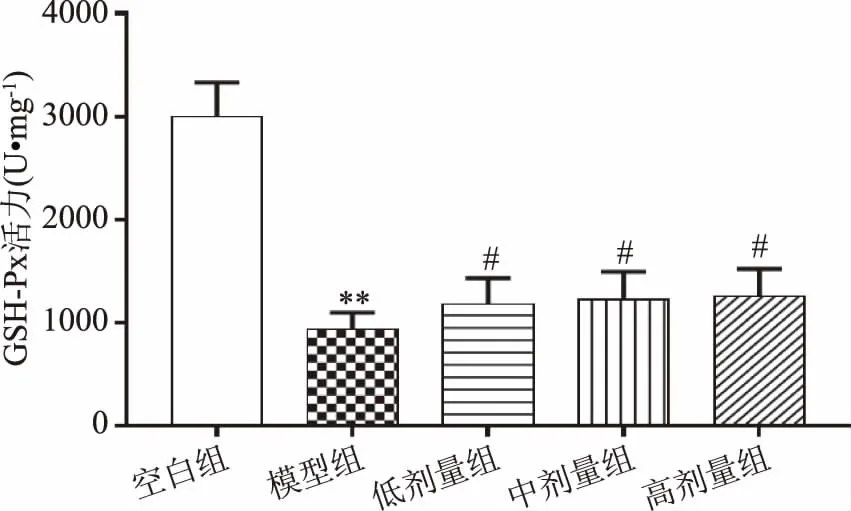
图10 复方北冬虫夏草提取物对GSH-Px活力的影响
2.6 复方北冬虫夏草对大鼠肾脏TG、TC含量的影响
长期处于糖尿病状态下,可导致调节脂肪酸氧化的关键酶表达下降,进而导致机体脂代谢异常[26]。根据夏惠[27]的研究,TG、TC作为脂代谢的重要指标,其含量的增加是导致脂代谢紊乱的原因之一,也是糖尿病大鼠肾功能恶化的重要因素。由图11、图12可知,与空白组相比,模型组糖尿病大鼠肾脏中TG和TC含量均极显著提高(P<0.01),表明模型组大鼠脂代谢异常;与模型组相比,复方北冬虫夏草低、中剂量组TG、TC含量显著下降(P<0.05),高剂量组TG、TC含量极显著下降(P<0.01),说明经给药经治疗后,大鼠脂代谢有所改善,且呈剂量依赖性增强。
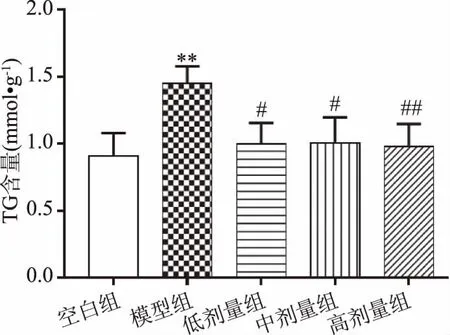
图11 复方北冬虫夏草提取物对TG含量的影响
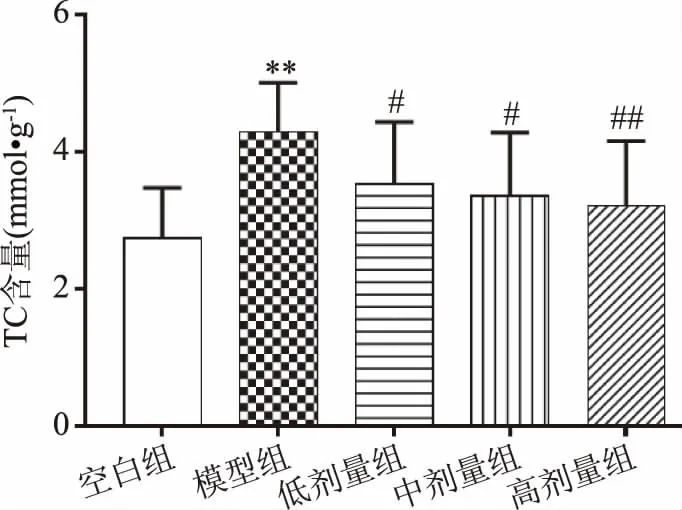
图12 复方北冬虫夏草提取物对TC含量的影响
2.7 复方北冬虫夏草对大鼠肾脏组织形态的影响
由图13可见,空白组大鼠肾脏包膜完整,肾小球结构清晰完整,且未见结构或大或小变化,肾小管上皮细胞无变性迹象,管腔内无渗出物;而模型组大鼠肾脏出现肾小球体积增大,形状不规则,肾小球毛细血管袢及肾小管基底膜增厚,系膜细胞增殖,肾小球系膜基质增生,肾小体减少,这与杜时晶[28]对于1型糖尿病大鼠肾脏的病理形态描述相符;低剂量组肾小球形状规则,结构较为清晰,中剂量组肾小体增多,高剂量组肾小球虽形态偏大,但形态结构较为完整,肾小管基底膜基本恢复,肾小体增多。表明复方北冬虫夏草提取物可改善糖尿病大鼠的肾损伤。
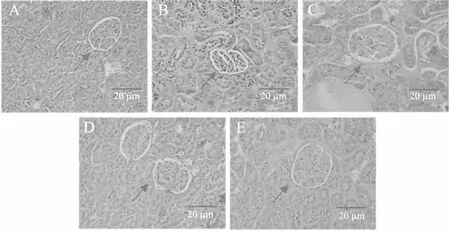
图13 大鼠肾脏组织形态学比较(HE×400)
3 结论
本研究采用水煎煮法提取复方北冬虫夏草,通过单因素试验和正交试验筛选并优化复方北冬虫夏草的最佳提取工艺:料液比1∶10 g/mL,提取3次,每次1.5 h,提取温度为70 ℃,此工艺条件下的平均提取率为53.1%,平均多糖得率为5.1%,平均总皂苷得率为1.3%。大鼠经STZ诱导给药后,与空白组比较,大鼠体重极显著下降(P<0.01),糖尿病典型特征血糖水平极显著升高(P<0.01),且胰岛素含量极显著降低(P<0.01),说明1型糖尿病模型建立成功;与模型组相比,复方北冬虫夏草提取物高剂量组糖尿病大鼠的体重、胰岛素水平和GSH-Px活力均显著提高(P<0.05),SOD活力极显著提高(P<0.01),而血糖值、肝脏MDA及肾脏TG、TC水平则极显著降低(P<0.01),并从组织学上证明复方北冬虫夏草提取物可有效改善糖尿病大鼠的肾损伤程度。
综上所述,复方北冬虫夏草提取物对糖尿病大鼠具有良好的降血糖作用,其降糖机制可能与改善机体氧化应激水平和影响脂代谢途径相关,其具体信号通路需要进一步研究。本研究结果将为开发北冬虫夏草系列产品提供理论基础。
