电子顺磁共振波谱法测定三种类胡萝卜素抗氧化活性
2020-10-23郭学文蒋晨辰乔俊琴练鸿振
郭学文,全 力,蒋晨辰,陈 璐,乔俊琴,*,练鸿振
(1.生命分析化学国家重点实验室,南京大学现代分析中心,江苏南京 210093;2.南京中医药大学整合医学学院,江苏南京 210023)
自由基特别是活性氧自由基作为高活性中间体对人体代谢有着重要影响[1-2]。在病理状态下或者衰老过程中,自由基的过量积累产生氧化应激会对人体造成危害[3-4],如炎症[5]、神经退行性疾病[6-7]、心血管疾病[8]、糖尿病[9]和癌症[10-11]等。因此外源抗氧化剂的筛选及其抗氧化能力比较受到人们广泛关注[12-14]。
类胡萝卜素是最常见的外源抗氧化剂之一,其优良的抗氧化性来源于不饱和共轭双键结构,可清除人体内自由基。许多流行病学研究表明类胡萝卜素可以降低多种癌症、心血管疾病及其它慢性疾病的危险性[15-16]。β-胡萝卜素、叶黄素和番茄红素是人体血清中含量最多的三种类胡萝卜素,广泛存在于水果和蔬菜中,其良好的自由基清除能力使得它们可以用作食品抗氧化剂,并用于制造功能性食品及营养补充剂[17-19]。
目前测定物质抗氧化活性最常用的方法是紫外-可见分光光度(UV-Vis)法。作为自由基清除剂的抗氧化剂与在紫外-可见光范围内有吸收的自由基反应,根据褪色程度确定其抗氧化活性[20-22],但类胡萝卜素本身在紫外-可见光范围内有吸收,会对紫外-可见分光光度法的检测造成较大干扰[23-24]。电子顺磁共振波谱(EPR)法是检测自由基最直接的方法,EPR基于未成对电子在直流磁场中吸收电磁辐射后从低能级跃迁到高能级这一原理,可以避免类胡萝卜素自身颜色对自由基检测的干扰[25]。本文基于EPR法探讨了1,1-二苯基-2-三硝基苯肼(1,1-Diphenyl-2-picrylhydrazyl radical,DPPH)浓度与EPR信号强度关系,研究了Fenton法产生羟基自由基(·OH)中Fe2+和过氧化氢的浓度及比例对·OH信号强度的影响,通过比较β-胡萝卜素、叶黄素和番茄红素对DPPH·、·OH的清除能力,测定了三种类胡萝卜素的抗氧化活性能力,为完善类胡萝卜素等天然食品添加剂的抗氧化活性能力评价方法提供依据。
1 材料与方法
1.1 材料与仪器
番茄红素 纯度为80%,上海源叶生物科技有限公司;叶黄素 纯度为80%,萨恩化学技术(上海)有限公司;β-胡萝卜素、DPPH 纯度为96%,上海麦克林生化科技有限公司;5,5-二甲基-1-吡咯啉-N-氧化物(5,5-Dimethyl-1-pyrroline N-oxide,DMPO) 纯度为96%,东仁化学科技(上海)有限公司;七水硫酸亚铁(FeSO4·7H2O) 纯度97%,江苏清禾化工有限公司;过氧化氢(H2O2,浓度30 wt%)、乙醇、丙酮 分析纯,南京化学试剂有限公司;去离子水 超纯水机(TM-D24UV纯水/超纯水一体化系统,美国Millipore公司)制备。
EMX 10/12电子顺磁共振波谱仪 德国Bruker公司;G-9S紫外可见分光光度计 南京菲勒仪器有限公司;KH-300DB型超声仪 昆山禾创超声仪器有限公司。
1.2 实验方法
1.2.1 EPR检测方法 用毛细管(内径0.9~1.0 mm)取100 μL样品溶液,再将毛细管放入顺磁石英管(内径4 mm)进行EPR检测。EPR测试参数如下:中心磁场:3480 Guass;扫场宽度:150 Guass;微波功率:20 mW;调制频率:100 kHz;放大倍数:2×103;调制幅度:1 Guass;时间常数:40.96 ms;扫场时间:83.89 s;扫描次数:1;测试温度:室温。
1.2.2 标准曲线绘制
1.2.2.1 DPPH标准曲线 称取一定质量的DPPH粉末,用乙醇超声溶解配制成5 mmol/L储备液备用。实验时,用乙醇分别稀释为浓度为0.02、0.05、0.10、0.20、0.30、0.40、0.50、1.00和2.00 mmol/L的DPPH溶液,按1.2.1中方法进行EPR测定,建立DPPH的EPR标准曲线。
1.2.2.2 DMPO-OH标准曲线和Fe2+与H2O2比例探索 称取一定质量的FeSO4·7H2O粉末,用去离子水超声溶解配制成5 mmol/L的FeSO4溶液作为储备液;量取一定体积的H2O2溶液,用去离子水配制成50 mmol/L的H2O2储备液;DMPO用去离子水配制成1 mol/L的溶液。考察Fe2+与H2O2不同比例时的EPR信号时,取20 μL DMPO溶液,分别加入20 μL FeSO4储备液和2、10、20、30 μL H2O2储备液,加去离子水至总体积为400 mL,此时混合液中FeSO4和H2O2摩尔比分别为1∶1、1∶5、1∶10、1∶15,反应5 min后立即按1.2.1中方法进行EPR测定;建立DMPO-OH的EPR标准曲线时,取20 μL DMPO溶液,加入一定量的FeSO4储备液和H2O2储备液,加去离子水至总体积为400 mL,使混合液中FeSO4和H2O2浓度分别为0.05、0.10、0.15、0.20、0.25、0.30 mmol/L和0.5、1.0、1.5、2.0、2.5、3.0 mmol/L,反应5 min后立即按1.2.1中方法进行EPR检测,建立DMPO-OH的EPR标准曲线。
1.2.3 自由基清除率测定 取番茄红素、叶黄素、β-胡萝卜素粉末,分别用丙酮超声溶解,配制成1、2、3、4、5、6 mmol/L的待测样品溶液备用。
1.2.3.1 DPPH·清除率的测定 根据Bartoszek等[26]的方法稍作调整。分别取40 μL不同浓度的番茄红素、叶黄素、β-胡萝卜素样品溶液(空白组取等量的丙酮溶液),加入到40 μL 5 mmol/L的DPPH溶液中,加乙醇使总体积为400 μL,混合均匀后按1.2.1中方法进行EPR检测,其中考察浓度为0.2 mmol/L和0.5 mmol/L 的类胡萝卜素对DPPH·清除率随时间的变化时,将混合溶液黑暗条件下分别静置30、60、150、210、270、330 min后进行检测;考察浓度分别为0.1、0.2、0.3、0.4、0.5和0.6 mmol/L的类胡萝卜素对DPPH·清除率时,将混合溶液黑暗条件下静置160 min后进行检测。自由基清除率(Radical scavenging activity,RSA)的计算公式为RSA(%)=(A0-A)/A0×100,其中A0为空白组特征峰的二次积分值,A为样品组特征峰的二次积分值。
1.2.3.2 ·OH清除率的测定 根据Kladna等[27]的方法稍作调整。取40 μL不同浓度的番茄红素、叶黄素、β-胡萝卜素样品溶液(空白组取等量的丙酮溶液),加入20 μL FeSO4溶液(5 mmol/L)、20 μL DMPO溶液(1 mol/L),混合均匀后加入20 μL H2O2溶液(50 mmol/L),加去离子水使总体积为400 μL,混合均匀后立即按1.2.1中方法进行EPR检测。其中考察DMPO-OH信号随时间的变化时,将混合溶液黑暗条件下分别静置5、10、15、20、25、30 min后进行检测;考察浓度分别为0.1、0.2、0.3、0.4、0.5和0.6 mmol/L的类胡萝卜素对·OH清除率时,将混合溶液液黑暗条件下静置5 min后进行检测。RSA(%)=(H0-H)/H0×100,其中H0为空白组第二特征峰的峰高,H为样品组第二特征峰的峰高。
1.2.3.3 UV-Vis法对比 根据Zhang等[28]的方法稍作调整。取30 μL 5 mmol/L的番茄红素、叶黄素、β-胡萝卜素样品溶液(空白组取等量的丙酮溶液),加入到30 μL 5 mmol/L的DPPH溶液中(类胡萝卜素自身吸光度测定时以等体积乙醇代替DPPH),加乙醇使总体积为3 mL,混合均匀后黑暗处静置30 min后加入比色皿中,然后置于UV-Vis检测517 nm波长处的吸光度,光谱扫描波长范围:200~800 nm。RSA(%)=[H0-(H-Hc)]/H0×100,其中H0为空白组517 nm处吸光度,H为样品组517 nm处吸光度,Hc为类胡萝卜素自身517 nm处吸光度。
1.3 数据处理
所有实验均重复三次,结果以平均值±标准偏差表示,采用Bruker WinEPR Processing 2.22软件对EPR数据进行处理,采用Origin 8.5对结果进行分析。
2 结果与讨论
2.1 番茄红素、叶黄素、β-胡萝卜素对DPPH·清除率
DPPH是一种稳定的自由基,可以通过EPR直接测定其EPR信号谱图,图1为不同浓度DPPH的EPR谱图及归一化的二次积分值与浓度关系曲线。由图1可知,在0.01~1.00 mmol/L范围内DPPH浓度(C)与EPR谱图二次积分值(I)成良好的线性关系,线性方程I=1.3033C+0.0028,相关系数R2=0.9949。因此,可以通过监测DPPH的EPR二次积分值来反映DPPH的浓度变化,进而用于DPPH·清除率的测定。实验时,固定DPPH初始浓度为0.5 mmol/L用于类胡萝卜素对DPPH·清除率的测定。
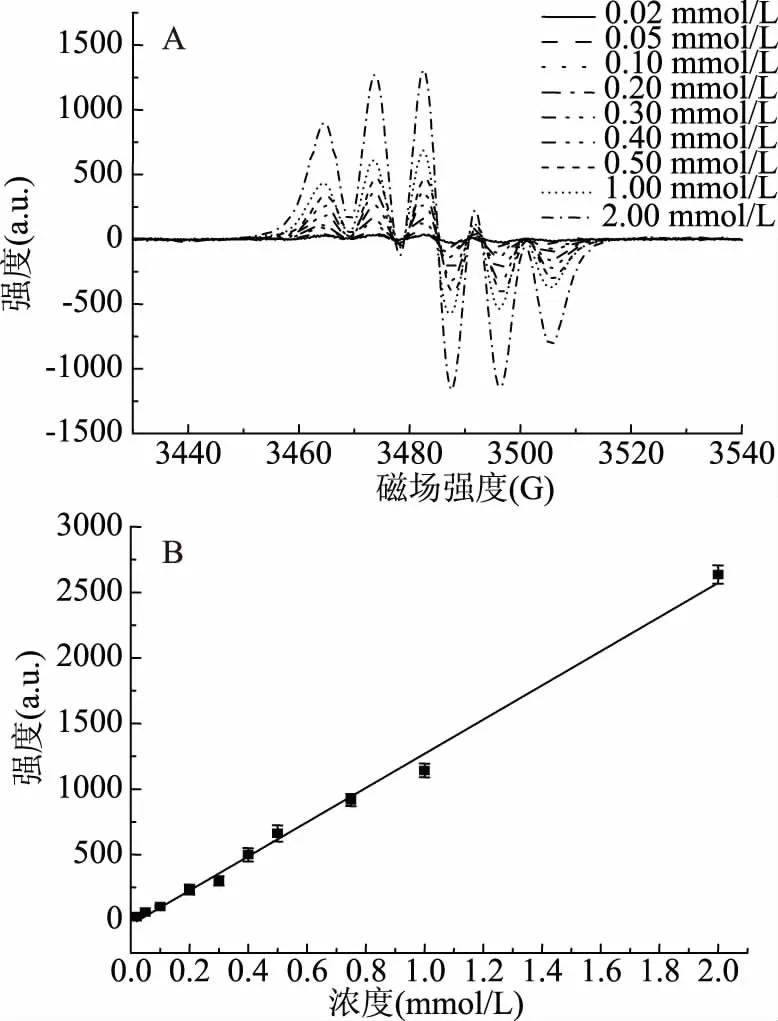
图1 不同浓度DPPH的EPR谱图(A)及积分值与浓度关系图(B)
图2显示了浓度分别为0.2、0.5 mmol/L的番茄红素、叶黄素、β-胡萝卜素对DPPH·(0.5 mmol/L)清除率随时间的变化。由图2可知,随时间的延长,三种类胡萝卜素对DPPH·的清除率均增大,且呈现前期随时间增大迅速增大,后期增大趋势变缓的趋势,300 min后清除率几乎保持不变。对同种类胡萝卜素,高浓度(0.5 mmol/L)的类胡萝卜素对DPPH·清除率高于低浓度(0.2 mmol/L)。其中,番茄红素对DPPH·的清除速率最快,浓度为0.2和0.5 mmol/L的番茄红素对DPPH·的清除率在30 min时分别达到54.0%和74.8%,在60 min时分别达到65.4%和90.1%,在270 min时达到了97.4%和100.0%。相同浓度的叶黄素对DPPH·的清除率略高于β-胡萝卜素,在330 min时,0.2 mmol/L叶黄素和β-胡萝卜素对DPPH·的清除率分别为44.8%和41.1%,0.5 mmol/L的叶黄素和β-胡萝卜素对DPPH·的清除率分别为67.1%和56.9%,均高于0.2 mmol/L的番茄红素对DPPH·的清除率。
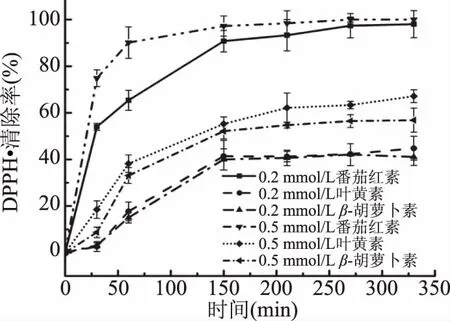
图2 番茄红素、叶黄素和β-胡萝卜素对DPPH·清除率随时间的变化
图3为不同浓度番茄红素、叶黄素和β-胡萝卜素在160 min时的DPPH·清除率,DPPH·清除率随着类胡萝卜素浓度的增大而增大,其中番茄红素对DPPH·的清除率最大。浓度为0.1 mmol/L的番茄红素对DPPH的清除率达到78.3%,浓度为0.1 mmol/L的β-胡萝卜素对DPPH·的清除率仅为30.1%,略高于0.1 mmol/L的叶黄素对DPPH·的清除率(25.2%)。但随着浓度的增大,叶黄素对DPPH·的清除率逐渐高于β-胡萝卜素,浓度达到0.6 mmol/L时,番茄红素、叶黄素和β-胡萝卜素对DPPH·的清除率分别为95.4%、76.7%和47.7%。这是由于共轭双键数越多自由基清除能力越强,番茄红素共轭双键数为13个,大于叶黄素和β-胡萝卜素,而虽然叶黄素与β-胡萝卜素共轭双键数均为10个,但叶黄素端环上的羟基提高了类胡萝卜素自由基清除活性[29]。
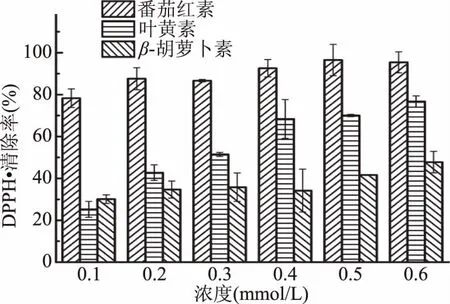
图3 不同浓度番茄红素、叶黄素和β-胡萝卜素对DPPH·的清除率(160 min)
利用UV-Vis法同样进行了DPPH·清除率测定。实验证明,三种类胡萝卜素自身在517 nm处均有不同程度的吸收(图4)。当作用时间为30 min时,扣除溶剂空白和类胡萝卜素自身吸收后,番茄红素、叶黄素和β-胡萝卜素对DPPH·的清除率分别为48.15%、17.83%和10.23%,与EPR等比例浓度测试结果(74.85%、18.49%、8.71%,见图2)相比,两种方法测得的三种类胡萝卜素抗氧化能力具有较高的相关性,但清除率有所差别,尤其是番茄红素。这可能是由于番茄红素在517 nm处有较强吸收,与DPPH光谱特征峰最大吸收严重重叠造成,即使进行了人为背景扣除,仍会对测试结果造成较大干扰。
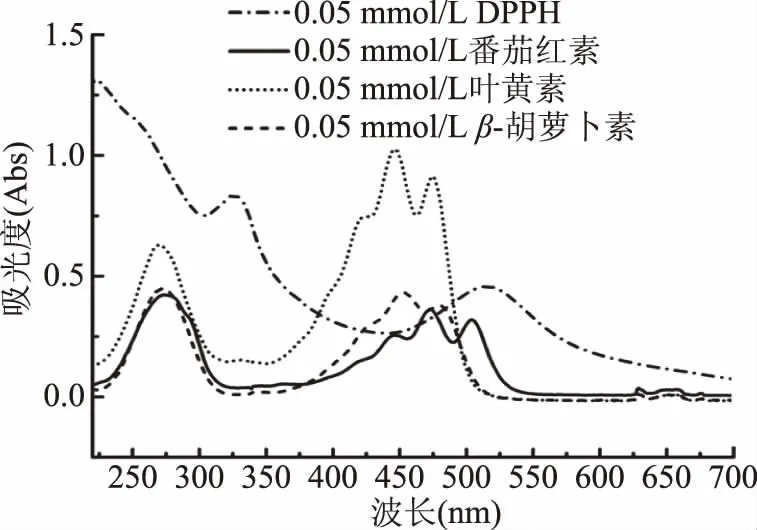
图4 番茄红素、叶黄素、β-胡萝卜素和DPPH的UV-Vis吸收光谱
2.2 番茄红素、叶黄素、β-胡萝卜素对·OH清除率
采用Fenton法产生·OH(Fe2++2H2O2=Fe3++2·OH+2H2O),Fe2+和H2O2比例不同会影响反应过程,产生的·OH量也不同。由于·OH是一种短寿命的氧自由基,在水溶液中寿命只有10-9s,不能直接在室温检测得到EPR信号,必须加入自由基捕获剂与其形成比较稳定的自由基加合物。DMPO是一种常用的羟基自由基捕获剂,与·OH结合后会生成DMPO-OH加和物,其EPR谱显示出强度比为1∶2∶2∶1的四线谱。图5是用DMPO作为自由基捕获剂得到的不同比例的Fe2+和H2O2反应后DMPO-OH的EPR谱图和信号强度图。在Fe2+浓度一定时,随着Fe2+∶H2O2比例的减小(即H2O2浓度的增大),DMPO-OH信号强度呈先增大后基本不变的趋势,因此本文羟基自由基清除实验所选用Fe2+∶H2O2浓度比为1∶10。
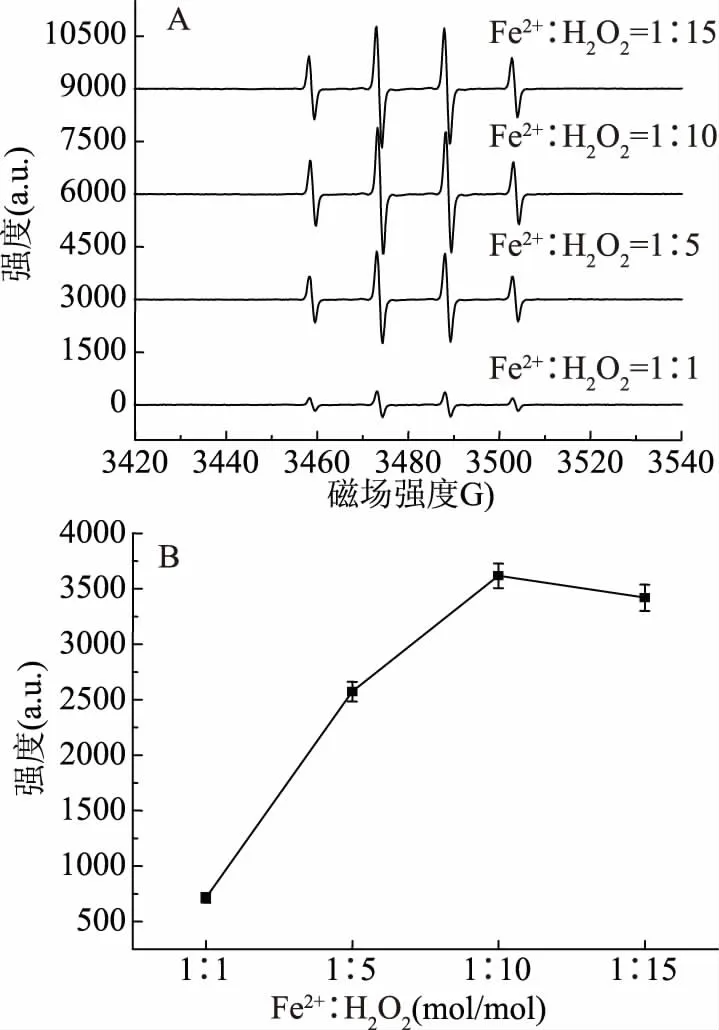
图5 不同比例的Fe2+和H2O2反应后DMPO-OH的EPR谱图(A)和信号强度图(B)
实验同时发现,当Fe2+∶H2O2比例固定时,DMPO-OH的信号强度会随Fe2+和H2O2浓度的增大而增加。以DMPO-OH第二条峰峰值强度对Fe2+浓度(Fe2+∶H2O2=1∶10)进行曲线拟合,结果如图6所示。由图可知,Fe2+浓度在0.05~0.30 mmol/L范围内与DMPO-OH强度呈良好的线性关系,线性方程I=8510.86C+321.27,相关系数R2=0.9914。说明Fe2+:H2O2比例固定时,Fe2+浓度与DMPO-OH信号强度成正比,即产生的·OH浓度与DMPO-OH信号强度呈正比,通过测定类胡萝卜素加入前后DMPO-OH强度变化,可用于计算·OH的清除率。实验时,固定Fe2+浓度为0.25 mmol/L用于类胡萝卜素对·OH清除率的测定。通过DMPO捕获剂捕获到的自由基加合物虽然比原有的·OH稳定,但也会在短时间内发生明显衰减(图7),对·OH清除率测定造成影响,因此实验加入DMPO捕获剂后需在5 min内完成EPR的检测。
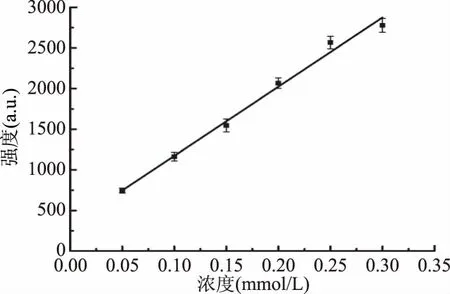
图6 DMPO-OH强度与Fe2+浓度关系曲线(Fe2+∶H2O2=1∶10)
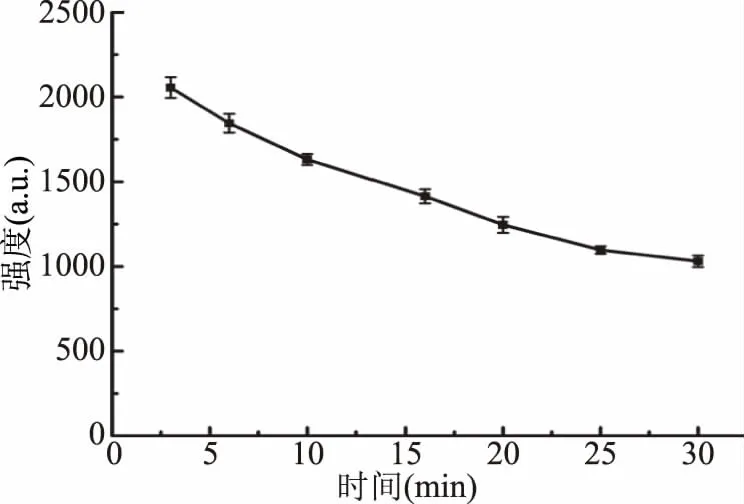
图7 DMPO-OH强度随时间变化曲线
图8为不同浓度番茄红素、叶黄素和β-胡萝卜素在5 min时的·OH清除率,由图8可知,·OH清除率随着类胡萝卜素浓度的增大而增大。低浓度时,叶黄素对羟基自由基清除能力最强,β-胡萝卜素次之,番茄红素最弱。浓度为0.1 mmol/L的叶黄素、β-胡萝卜素和番茄红素对·OH的清除率分别为13.1%、5.7%和3.7%。随着浓度的增大,番茄红素对·OH的清除能力显著增强,而叶黄素和β-胡萝卜素的清除能力增强较缓,浓度高于0.3 mmol/L时,三种类胡萝卜素对·OH的清除能力为:番茄红素>叶黄素>β-胡萝卜素。浓度为0.6 mmol/L的番茄红素对·OH的清除率达到56.6%,而相同浓度的叶黄素和β-胡萝卜素对·OH的清除率分别仅为29.1%和14.0%。此结果与刘科梅[29]利用UV-Vis法所测三种类胡萝卜素对·OH的清除能力趋势一致。类似的,对于·OH而言,其本身没有颜色特征峰,采用UV-Vis法检测时均需另加显色剂(如水杨酸钠,与·OH反应生成紫色产物,在510 nm波长处有最大吸收)[29-30],因此,类胡萝卜素自身的光谱干扰仍然会影响清除率的准确测定。
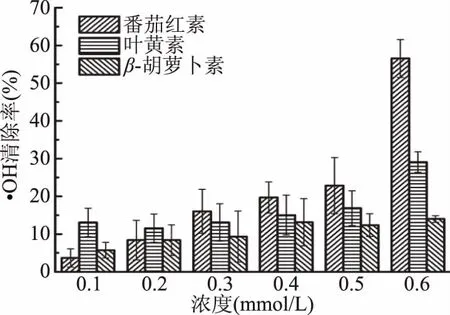
图8 不同浓度番茄红素、叶黄素和β-胡萝卜素对羟基自由基的清除率(5 min)
综上,三种类胡萝卜素对DPPH·和·OH均有一定的清除能力,在类胡萝卜素浓度大于0.3 mmol/L时对DPPH和羟基自由基的清除率均为:番茄红素>叶黄素>β-胡萝卜素,说明三种类胡萝卜素中番茄红素的抗氧化活性最强,叶黄素次之,β-胡萝卜素最弱。对比DPPH·与羟基自由基清除率,三种类胡萝卜素对·OH的清除率较低,且·OH清除率测定的误差较大,一方面是因为·OH的清除率测定是在5 min内完成的,由DPPH·不同时间清除率测定(图2)可知,三种类胡萝卜素对自由基的清除需要一定的时间,短时间内清除率较低;另一方面是因为类胡萝卜素是脂溶性的,而·OH产生体系是水相的,在水相中类胡萝卜素溶解性受到影响。与UV-Vis相比,EPR作为一种直接检测自由基变化的技术,不受溶液颜色和浊度的影响,在对于本文三种类胡萝卜素自由基清除能力表征方面,具有一定优势。
3 结论
本文基于电子顺磁共振波谱法测定,通过比较番茄红素、叶黄素和β-胡萝卜素对DPPH·和·OH清除能力的大小,研究了三种类胡萝卜素抗氧化活性能力。结果表明:两种自由基在一定浓度范围内与其EPR信号强度呈良好的线性关系,适合用于清除率测定。三种类胡萝卜素对两种自由基均有一定清除作用,且类胡萝卜素浓度越大,自由基清除率越高,抗氧化活性越强。其中,番茄红素的抗氧化活性能力最强,叶黄素次之,β-胡萝卜素最弱。该研究结果可为完善类胡萝卜素等天然食品添加剂的抗氧化能力评价方法提供依据。
