热稳定性高β-甘露聚糖酶产生菌的筛选、鉴定及酶学性质研究
2020-10-23高伟强陈晓波张春晓
田 庚,高伟强,陈晓波,张春晓
(河北科技大学生物科学与工程学院,河北石家庄 050018)
β-甘露聚糖酶(β-1,4-D-甘露聚糖甘露聚糖水解酶(β-1,4-D-mannan mannanohydrolases),EC.3.2.l.78)能够攻击甘露聚糖骨架的内部β-1,4糖苷键,释放甘露寡糖[1-2]。β-甘露聚糖酶广泛存在于细菌、真菌、放线菌、植物和动物中[3]。水解产物甘露寡糖(mannan-oligosaccharide,MOS)不仅能够刺激肠道正常菌群的增殖,抑制病原微生物的生长[1-4],对乳酸菌(Lactobacilli)和双歧杆菌(Bifidobacteria)生长有益[5],还具有多种生物学活性,如增强动物免疫、调节糖脂代谢、促生长和抗氧化等作用[6-7],MOS还通过调控肠道微生物增强了二甲双胍的降糖效果[8]。
β-甘露聚糖酶在食品行业应用广泛,如在面团中添加β-甘露聚糖酶处理15 min的2.0%魔芋葡甘聚糖,能够显著抑制二硫键的断裂和二级结构的变化,防止面团的水分散失,维持面团的拉伸能力[9];β-甘露聚糖酶对降低咖啡和果汁的黏度也非常有效[4]。此外,β-甘露聚糖酶作为饲料添加剂应用于养殖业,起到消除抗营养因子的作用[10-11],对提高饲料利用率有重要贡献;在造纸工业中,与β-木聚糖酶等半纤维素降解酶类协同使用,不仅能够减少化学漂白剂的用量,减少环境污染,还能提高纸浆白度,改善纸浆性能[12];在纺织工业中能有效去除纺织品所粘附的多余染料,Singh等[13]从KlebsiellapneumoniaeSS11菌株中鉴定了一种热和碱稳定的β-甘露聚糖酶,用做洗涤剂添加剂,对于去除因甘露聚糖导致的食品染色效果非常好。
β-甘露聚糖酶在工业化应用过程中,部分领域需要高温处理,如动物饲料制粒过程中需85 ℃处理约3 min[14],在将纤维素发酵生产糖的过程中,利用高温使原料变得松散[15]。由于大部分β-甘露聚糖酶的最适温度为40~75 ℃[14],高温下酶活性大大降低甚至完全失活,因此,筛选热稳定性高的β-甘露聚糖酶也是目前研究的热点,如B.subtilis(TBS2)β-甘露聚糖酶在60、70、80、90和100 ℃的半衰期分别为6 h、4.2 h、2 h、20 min和12 min[14];热和碱稳定的KlebsiellapneumoniaeSS11β-甘露聚糖酶,70 ℃时酶的半衰期为135.91 min[13],B.clausiiS10的β-甘露聚糖酶,其最适温度为75 ℃,70 ℃孵育3 h,残余酶活性大于50%,在80 ℃酶的半衰期为0.5 h[16]。尽管这些酶表现出一定的热稳定性,但在温度超过80 ℃时,热稳定性欠佳,限制了其在养殖业及再生能源等领域中的应用,因此开发耐高温、热稳定性高的β-甘露聚糖酶具有重要意义。本研究从土壤中分离得到一株降解魔芋胶的地衣芽孢杆菌,并对其产β-甘露聚糖酶的酶学性质进行了研究,为β-甘露聚糖酶的应用奠定了基础。
1 材料与方法
1.1 材料与仪器
土壤样品 采自河北科技大学校园内;魔芋胶 湖北惠葡生化科技有限公司;DNS试剂、刚果红染料、D-甘露糖 北京索莱宝科技有限公司;Trans Taq HiFi酶 北京全式金生物技术有限公司;PCR引物合成及测序 由英潍捷基(上海)贸易有限公司完成;其他试剂 均为国产分析纯。
SpectraMaxm i3x多功能酶标仪 美国Molecular Devices公司;My Cycler PCR仪和凝胶成像系统 美国Bio-Rad公司;BIFUGE STRATOS高速冷冻离心机 美国赛默飞世尔科技公司;SW-CJ-2FD超净工作台 苏州泰安空气技术公司;FA1004N分析天平 上海民桥仪器有限公司;HH-2型数显恒温水浴锅 金坛市海尔电器有限公司;ZWY-2102C振荡摇床 上海智诚分析仪器制造有限公司;DH6000电热恒温培养箱 河北泰斯特仪器有限公司。
1.2 实验方法
1.2.1 产β-甘露聚糖酶菌的分离及初筛 根据杨苗等[17]的方法并稍作修改,称5 g土样于无菌生理盐水中,在37 ℃、180 r/min摇床上培养2 h;取2 mL土壤悬液加入到富集培养基(魔芋胶5 g/L,蛋白胨5 g/L,KH2PO41 g/L,MgSO40.1 g/L,自然pH)中,37 ℃、180 r/min摇床上培养12 h。富集培养的菌液进行10-5、10-6和10-7稀释后,取适量菌液涂布于筛选平板培养基(魔芋胶5 g/L,蛋白胨5 g/L,KH2PO41 g/L,MgSO40.1 g/L,琼脂20 g/L,自然pH)中,37 ℃倒置24 h,每个稀释梯度设置3个平行。培养24 h后,向平板中加入适量0.1% 刚果红染液,静置30 min,观察水解圈大小,选取水解圈直径(D)与菌落直径(d)之比(D/d)较大的菌株,进行复筛,即在筛选培养基上继续稀释涂布进行菌种纯化,连续2次培养,点种到新的平板上进行刚果红染色。
1.2.2 菌种的分子鉴定 参照文献[18]进行基因组DNA提取。以基因组DNA为模版,细菌16S rDNA通用引物16S F1:5′-AGAGTTTGATCCTGGTCAG-3′ 和16S R1:5′-TACGGCTACCTTGTTACGACTTC-3′,使用HiFi Taq进行基因扩增。PCR扩增程序:95 ℃预变性5 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min 40 s,32个循环;72 ℃延伸10 min。
PCR产物测序由英潍捷基(上海)贸易有限公司完成。采用 BLAST软件对序列进行同源性比较,选取同源性较高菌株的16S rDNA序列,利用MEGA 6.0软件构建系统发育树[19-22]。
1.2.3β-甘露聚糖酶酶学性质研究 根据文献报道的方法稍作修改进行β-甘露糖苷酶的酶学性质研究[23]。
1.2.3.1 粗酶液的制备 将初筛得到的菌株接到种子培养基(蛋白胨10 g/L,酵母粉5 g/L,NaCl 10 g/L,自然pH)中[24],37 ℃、180 r/min培养12 h。按10%的接种量转接到发酵培养基(魔芋胶5 g/L,蛋白胨5 g/L,KH2PO41 g/L,MgSO40.1 g/L),同样条件下培养40 h。发酵液12000 r/min离心10 min,收集的上清液即为粗酶液[25]。
1.2.3.2 甘露糖标准曲线的制定 D-甘露糖标准曲线的制定[26]:1 g/L D-甘露糖标准溶液的配制,取六支试管分别加入1 g/L甘露糖标准溶液0、0.06、0.12、0.18、0.24、0.3 mL,依次分别加入ddH2O 0.3、0.24、0.18、0.12、0.06、0 mL。再加入0.6 mL的DNS混匀,沸水浴5 min,冷却后测定OD540。以D-甘露糖质量(mg)为横坐标x,以OD540为纵坐标y,绘制标准曲线。每组试验均设1次空白对照和3次重复试验,重复试验取平均值。
1.2.3.3β-甘露聚糖酶活性测定 将魔芋胶浸泡在75%酒精中处理,烘干以除去魔芋胶中含有的还原糖使其变为精魔芋胶,在酶活性测定时作为底物使用[27]。采用DNS法进行酶活性测定,将精魔芋胶溶于pH6.0磷酸钠缓冲液中配制5 g/L的溶液作为底物,于0.27 mL底物中加入0.03 mL粗酶液,60 ℃水浴10 min,加入DNS试剂0.6 mL,混匀后沸水浴5 min显色,立即以流动水冷却至室温,在540 nm处测定吸光值[28]。
酶活性定义:在一定温度和pH下,以每分钟催化底物水解生成1 μmol D-甘露糖所需的酶量定义为一个酶活性单位(U)[29]。
1.2.3.4 pH对酶活性影响 配制pH2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0、11.0和12.0缓冲液,与等体积的粗酶液混合,按1.2.3.3的方法测定β-甘露聚糖酶活性,以未经处理的粗酶液作为空白对照。以最适pH的酶活性为100%,计算不同pH的相对酶活性(%),即(特定pH酶活性/最适pH酶活性)×100。
1.2.3.5 酶的pH稳定性 取粗酶液分别在pH2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0、11.0和12.0的缓冲液下等体积混合,在37 ℃条件下保温30 min和2 h。取出酶液使其与0.5%的精魔芋胶底物混合,按1.2.3.3的方法测定剩余β-甘露聚糖酶活性。以最高酶活为100%,分别计算不同pH的相对酶活性(%),即(相同保温时间特定pH酶活性/该时间最适pH酶活性)×100。
1.2.3.6 温度对酶活性的影响 将粗酶液进行适当稀释,加入到0.5%的精魔芋胶底物中,置于不同温度(30、40、50、55、60、65、70、80、90和100 ℃)下保温10 min,按1.2.3.3的方法测定β-甘露聚糖酶活性。以最高酶活性为100%,分别计算不同温度的相对酶活性(%),即(特定温度酶活性/最适温度酶活性)×100。
1.2.3.7 酶的热稳定性 粗酶液分别在温度60、70、80 ℃下各保温(2、4、6和8 h),再进行适当稀释,按1.2.3.3的方法在最适温度测定β-甘露聚糖酶活性,以最高酶活性为100%,分别计算不同温度的相对酶活性,即(同一温度特定时间酶活性/该温度最大酶活性)×100。
1.2.3.8 金属离子对酶活性的影响 粗酶液适当稀释后,分别与10 mmol/L K+、Mn2+、Zn2+、Ca2+、Na+、Cu2+和Mg2+等不同金属离子溶液等体积混合。在37 ℃条件下保温1 h,以未加金属离子的粗酶液作为对照,再按1.2.3.3的方法测定β-甘露聚糖酶活性,以最高酶活为100%,分别计算不同pH的相对酶活性(%),即(特定金属离子酶活性/未加金属离子的酶活性)×100。
1.3 数据处理
对酶学性质研究的实验都进行了3次重复,根据测定数据的平均值和标准误,采用Origin 2017作图分析。
2 结果与分析
2.1 菌株的分离初筛
以魔芋胶为唯一碳源,并结合刚果红染色的方法,从初筛培养基中分离得到D/d比值较大的菌株,纯化后,菌落表面湿润,边缘不整齐。纯化后的菌株点种在筛选培养基上37 ℃培养24 h后进行刚果红染色,结果如图1所示,D/d比值平均为1.67。

图1 分离菌株刚果红染色结果
2.2 菌种的分子鉴定
菌株经16S rDNA测序,序列提交至NCBI网站(注册号:MT032348)将序列在NCBI网站上进行BLAST比对,结果表明,该菌株与地衣芽孢杆菌(B.licheniformis)相似性达99.65%。应用Mega6.0软件构建的系统发育树,结果如图2所示,该菌株与B.licheniformisATCC 14580在同一个进化分支上,表明二者亲缘关系最近,所以鉴定该菌株为地衣芽孢杆(B.licheniformis)KD-1。
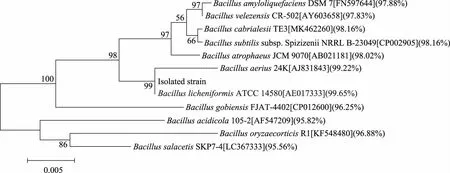
图2 基于16S rDNA序列构建的系统发育树
2.3 β-甘露聚糖酶酶学性质
2.3.1 pH对酶活性及稳定性影响 粗酶液与不同pH底物缓冲液等体积混合后,60 ℃保温10 min,研究pH对酶活性的影响。结果如图3A所示,β-甘露聚糖酶的最适pH为pH6.0,酶活性达到3.38 U/mL,在pH2.0时保持34%的相对酶活性。在pH3.0~6.0范围内,随pH增大,相对酶活性提高;在pH7.0~12.0范围内,随着pH增大,相对酶活性降低,但在pH12.0时仍保持49%的相对酶活性。β-甘露聚糖酶在pH5.0~10.0范围内,保持较高酶活性(大于70%),说明该酶具有较广的pH耐受范围(图3A)。一般来自细菌的β-甘露聚糖酶最适pH在中性范围[3],如B.licheniformisDSM 13的最适pH在6.0~7.0之间[30],与本研究结果相似;但同是枯草芽孢杆菌属,其β-甘露聚糖酶最适pH仍存在很大差异,如Bacilussp. N16-5最适pH为9.5[3]。
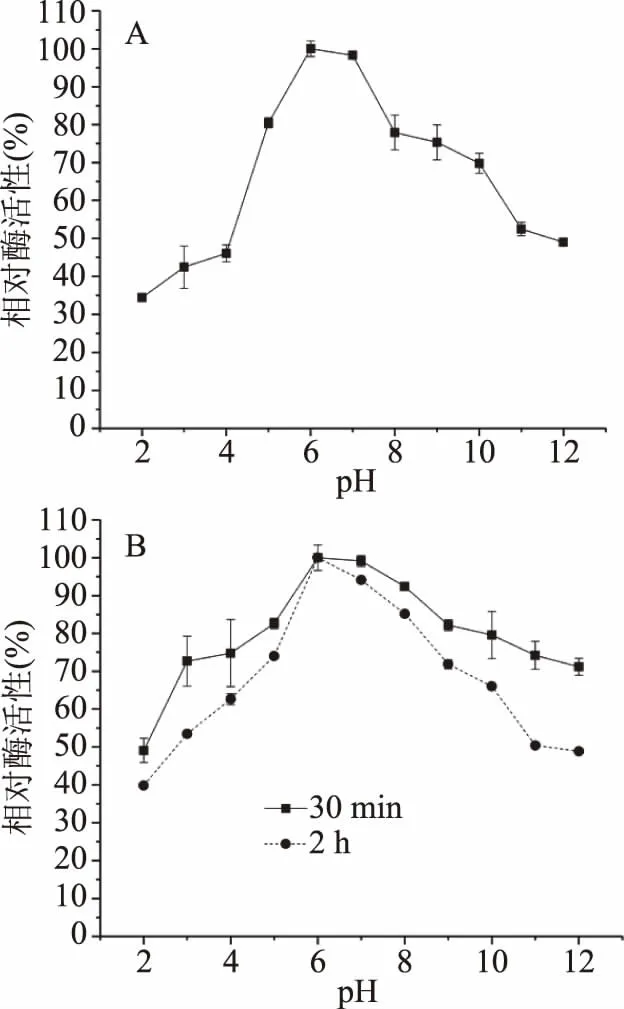
图3 pH对酶活性及稳定性的影响
酶液与不同pH底物缓冲液等体积混合后在37 ℃孵育30 min和2 h(图3B),研究pH对酶稳定性的影响。结果表明,该酶在37 ℃孵育30 min后,在pH3.0~12.0之间酶具有较高的稳定性,相对酶活性大于70%,与报道的B.licheniformisDSM 13β-甘露聚糖酶孵育30 min的pH稳定性(pH5.0~12.0)近似,K.pneumoniaeSS11β-甘露聚糖酶在40 ℃孵育30 min,在pH7.0~10.6之间,剩余相对酶活性大于70%[13];孵育2 h后,pH稳定性较30 min有所下降,在pH5.0~9.0之间相对酶活性大于70%,说明该酶在pH5.0~9.0具有较高的pH稳定性。
2.3.2 温度对酶活性及热稳定性影响 酶的最适温度为60 ℃(图4A),在30~100 ℃范围内,该酶都保持较高的酶活性,如在30和100 ℃,仍具有高于58%的酶活性,属于耐高温酶[31]。60 ℃酶的半衰期(τ1/2)为5.5 h,70和80 ℃酶的半衰期(τ1/2)分别为4.3和4.2 h(图4B);另外该酶在100 ℃孵育30 min,剩余酶活性仍有31%。以上结果表明该酶的热稳定性非常高。
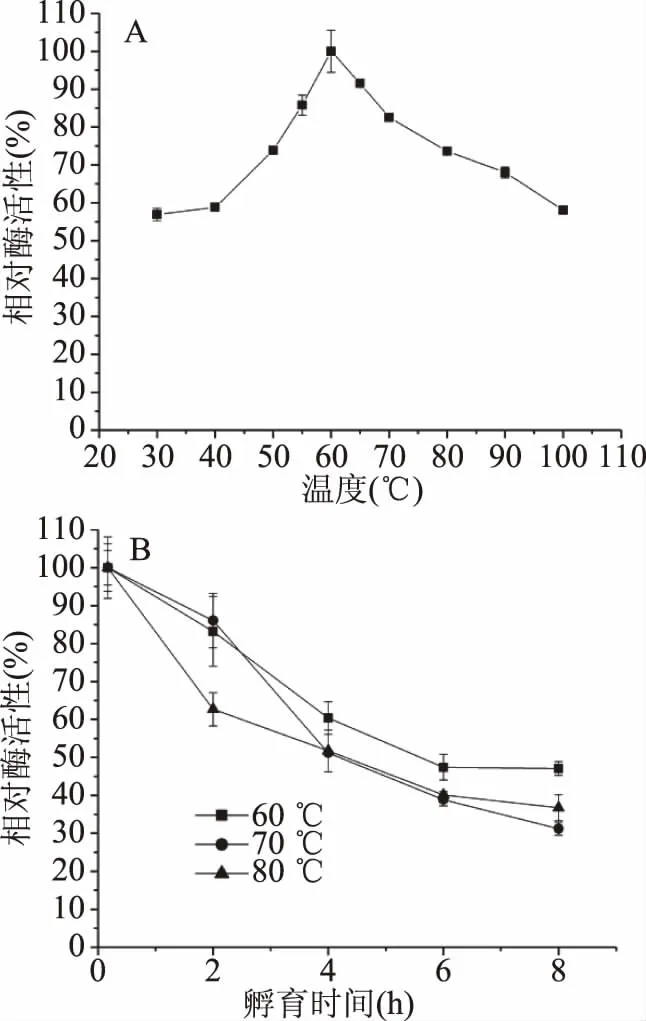
图4 温度对酶活性及稳定性影响
本研究β-甘露聚糖酶最适温度为60 ℃,与B.licheniformisDSM 13[30]、B.subtilisWL-3[32]和B.subtilis(TBS2)[14]等菌株β-甘露聚糖酶的最适温度接近。尽管这些酶的最适温度一致,但酶的半衰期有很大不同,如B.licheniformisDSM 13菌株的β-甘露聚糖酶50 ℃酶的半衰期为80 h,60 ℃酶的半衰期迅速下降,仅为3 min,超过70 ℃则酶活性丧失[30],而本研究的B.licheniformisKD-1,利用其发酵液测定的酶80 ℃的半衰期为4.2 h;B.subtilis(TBS2)所产β-甘露聚糖酶80 ℃半衰期为2 h[14],也低于本文报道的β-甘露聚糖酶的热稳定性,说明B.licheniformisKD-1所产β-甘露聚糖酶是目前报道热稳定性最高的酶,在饲料制粒中有很大应用潜力。
2.3.3 金属离子对酶活性的影响 Cu2+和Mg2+具有促进β-甘露聚糖酶活性的作用,分别使酶活性提高了40%和19%(图5),而其他离子,Mn2+、K+、Zn2+、Ca2+和Na+均对酶活性有不同程度的抑制作用,其中Mn2+对酶活性抑制程度最大,降低了51%的酶活性,Ca2+和Na+仅有微弱的抑制作用,因此在应用过程中或酶制剂制备时适当添加Cu2+或Mg2+有助于提高酶活性。
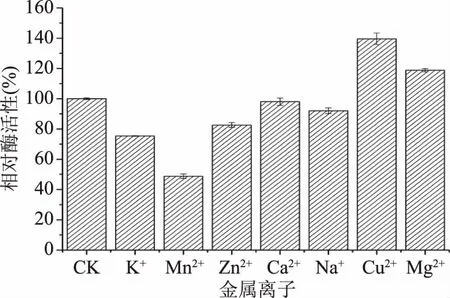
图5 金属离子对酶活性的影响
3 结论
本研究分离到一株降解魔芋胶的B.licheniformisKD-1,其产β-甘露聚糖酶的最适pH6.0,最适温度60 ℃;在pH5.0~9.0和60~80 ℃,酶的稳定性良好,60 ℃酶的半衰期(T1/2)为5.5 h,70和80 ℃酶的半衰期(T1/2)均超过4.2 h,是目前报道热稳定性最高的一种酶;10 mmol/L的Cu2+和Mg2+明显促进β-甘露聚糖酶活性,而10 mmol/L的Mn2+明显抑制酶活性。
