不同包埋处理对杨梅酚酸稳定性的影响
2020-10-23郜海燕房祥军吴伟杰陈杭君穆宏磊
胡 杰,郜海燕,房祥军,吴伟杰,陈杭君,穆宏磊
(1.浙江师范大学化学与生命科学学院,浙江金华 321004;2.浙江省农业科学院食品科学研究所,农业农村部果品产后处理重点实验室,中国轻工业果蔬保鲜与加工重点实验室,浙江省果蔬保鲜与加工技术研究重点实验室,浙江杭州 310021)
杨梅(Myricarubra(Lour.)S. et Zucc.)属杨梅科,多年乔木植物,多产于浙江、福建、四川等省份,是我国江南地区久富盛名的水果[1]。其营养丰富,色泽诱人,口感酸甜,含有大量的生物活性成分如花色苷、酚酸类化合物等,因而具有较好的保健功效和较高的经济价值[2]。酚酸类物质具有抗炎、抗过敏、保护血管、抗氧化、抗肿瘤及保肝等功效,有益于人体健康[3]。但酚酸结构不稳定,在高温、光照等环境下容易发生酯键水解、呋喃环断裂和脱羧反应[4]。同时,酚酸在人体胃肠等复杂生物环境中易发生降解,导致其在人体中的吸收利用率降低[5]。因此,提高酚酸稳定性对于杨梅营养成分的保持及利用至关重要。
目前保持生物活性的方法主要有包埋、乳化等。β-环糊精是常用的壁材之一,李延啸等[6]采用β-环糊精为壁材,通过过饱和溶液析出法包埋大蒜素,置于模拟胃液4 h后大蒜素的释放率为96%;大蒜素在pH1.0环境中处理4 h后,其分解率为39.48%,而经β-环糊精包埋的大蒜素分解率仅为12.20%,可见β-环糊精包埋能有效提高大蒜素的稳定性。
此外,近年的研究发现乳液为动力学稳定体系,可包裹相应的营养成分,避免其因外界环境的改变而遭到损失或破坏,被广泛应用于生物活性物质的包埋和递送中[7]。庄丰辰等[8]发现乳清蛋白是不饱和脂肪酸微胶囊的优质壁材,但是对敏感芯材的包埋效率和保护效果都存在一定的局限性,需要进一步改善以提高其应用性能。复合乳液具有热力学不稳定性,最近大量学者通过优化配方来研究复合乳液的稳定性[9]。蛋白质与多糖具有较高的化学和胶体稳定性,当与乳液结合使用时具有优异的乳化性能[10],蛋白质起主要稳定剂的作用[11],而多糖则通过其增稠和空间稳定行为来促进乳液的稳定性[12]。Huang等[13]采用乳清蛋白-果胶复合物乳液(1∶3)对熊果苷和香豆酸进行包埋,形成的涂层结构紧密,具有更强的凝胶网络结构,最高包埋率分别为91.08%和80.92%,表现出较好的粘度和稳定性。
本研究分别以乳清蛋白、β-环糊精、乳清蛋白-果胶为包材对杨梅酚酸进行包埋,在不同的环境条件(pH、温度、光照)下研究杨梅酚酸稳定性的变化情况,并测定包埋后的杨梅酚酸在体外模拟人体胃肠液中的稳定性。旨在确定一种提高杨梅酚酸在储藏和加工过程中稳定性的保持技术,并为其生产和综合开发利用提供依据。
1 材料和方法
1.1 材料与仪器
东魁杨梅(Myricarubra(Lour.)S. et Zucc.) 由浙江仙居县南峰水果专业合作社提供,经液氮冷冻粉碎至粉末,-30 ℃保存备用;高甲氧基果胶、乳清蛋白、β-环糊精 上海源叶生物科技有限公司;胃蛋白酶(3000 U/mg)、胰酶(3000 U/mg) 美国Genview公司。
BX51奥林巴斯显微镜 日本奥林巴斯株式会社;GL-3250磁力搅拌器 中国江苏其林贝尔仪器制造有限公司;UV-9000双光束紫外可见分光光度计 中国上海精密科学仪器有限公司;G70F20CN3L-C2(CO)型微波炉 中国广东格兰仕微波生活电器制造有限公司;KQ-3000TDE型高频数控超声波清洗器 昆山市超声仪器有限公司;Bifugo stratos型高速冷冻离心机 美国Thermo公司。
1.2 实验方法
1.2.1 杨梅酚酸的提取 参考魏欣等[14]的方法,称取杨梅粉末,按料液比1∶15 (w/v)加入50%(v/v)乙醇,微波辅助提取30 s(700 W)后,超声辅助提取15 min,在5000 r/min下离心10 min后取上清液,40 ℃真空浓缩至较少体积,加入等体积的乙醚/乙酸乙酯混合溶剂(1∶1,v/v)振荡提取分液(3~5次),获得杨梅酚酸有机溶剂提取液,40 ℃下真空浓缩至呈现油滴状后(得率为22 μg/g),取出溶解于乙醇中(100 μg/mL)备用。
1.2.2 乳液的制备 壁材乳液的制备:使用蒸馏水分别制备4%(w/w)乳清蛋白(WPC)乳液,4%(w/w)高甲氧基果胶(PEC)乳液和4%(w/w)β-环糊精(β-CD)乳液,将乳清蛋白乳液和高甲氧基果胶乳液按3∶1比例混合制备蛋白质-多糖复合物。将各乳液的酸碱度调至pH3.5,而后采用磁力搅拌器(23 ℃,1000 r/min)搅拌30 min,4 ℃保存过夜以使其完全水合[13]。
芯材的制备:将杨梅酚酸溶于水、并加入3%明胶(w/v)和3% NaCl(w/v),配制成10 mL含杨梅酚酸的乳液。橄榄油中加入8%聚甘油聚蓖麻油酸酯(v/v),55 ℃下搅拌10 min。将10 mL含杨梅酚酸的乳液逐滴加入30 mL含聚甘油聚蓖麻油酸酯的橄榄油中,55 ℃搅拌5 min后即为芯材。
复合乳液的制备(包埋过程):将10 mL芯材滴入30 mL壁材乳液(WPC,β-CD或WPC-PEC)中,25 ℃下搅拌10 min后,超声处理3 min即为复合乳液,4 ℃保存备用[13]。
1.2.3 酚酸含量的测定 参照陈燕霞[15]的方法,稍作修改。吸取样品1.0 mL置于25 mL量瓶中,加无水乙醇至5 mL,加0.3%十二烷基硫酸钠2 mL及0.6%三氯化铁-0.9%铁氰化钾(1∶0.9)混合溶液1 mL,混匀,在暗处放置5 min,加0.1 mol/L盐酸溶液至刻度,在暗处放置20 min,以显色剂为空白,在736 nm波长处测定吸收度。标准曲线y=0.3683x+0.0013,R2=0.998,其中x为酚酸含量(μg/mL),y为吸光度。以没食子酸来计算,根据标准曲线计算酚酸含量。
1.2.4 酚酸乳液的包埋率测定 将含有杨梅酚酸的复合乳液加入10 mL乙醇中混匀,超声(450 W)2 min后,离心(2000 r/min)10 min,取上清液,参照1.2.3方法计算酚酸浓度后再计算包埋率,计算公式如下:
式中:W表示包埋率,%;No表示根据吸光度值计算出未被包埋的杨梅酚酸浓度,μg/mL;Na表示添加到乳液中杨梅酚酸浓度,μg/mL。
1.2.5 酚酸在不同pH下的稳定性试验 参考卢召战等[16]方法,将一定量的杨梅酚酸乳液,乳清蛋白-果胶包埋的杨梅酚酸乳液,乳清蛋白包埋的杨梅酚酸乳液,β-环糊精包埋的杨梅酚酸乳液,分别置于pH3.0、5.0、7.0、9.0和11.0的环境中,避光静置120 min后检测,加入甲醇破坏乳化结构,并以初始总酚酸含量为100%,计算总酚酸相对含量。
1.2.6 酚酸在高温环境下的稳定性试验 参考郑亚明[17]方法,将一定量的杨梅酚酸乳液,乳清蛋白-果胶包埋的杨梅酚酸乳液,乳清蛋白包埋的杨梅酚酸乳液,β-环糊精包埋的杨梅酚酸乳液,分别置于60、90 ℃水浴120 min,间隔30 min取样检测,加入甲醇破坏乳化结构,以初始总酚酸含量为100%,计算总酚酸相对含量。
1.2.7 酚酸在不同光照下的稳定性试验 将一定量的杨梅酚酸乳液,乳清蛋白-果胶包埋的杨梅酚酸乳液,乳清蛋白包埋的杨梅酚酸乳液,β-环糊精包埋杨梅酚酸乳液,均置于光照(27000 lx)条件处理120 min,间隔30 min取样分析,加入甲醇破坏乳化结构,以初始总酚酸含量为100%,计算总酚酸相对含量。
1.2.8 人工胃液中稳定性试验 人工胃液:取8.54%稀盐酸16.4 mL,加水800 mL,胃蛋白酶(3000 U/mg)10 g,摇匀,加水稀释至1000 mL[18]。
在37 ℃人工胃液(pH2.0)中分别加入5 mL的杨梅酚酸乳液,乳清蛋白-果胶包埋的杨梅酚酸乳液,乳清蛋白包埋的杨梅酚酸乳液,β-环糊精包埋的杨梅酚酸乳液,以80 r/min进行搅拌。每30 min取消化液1 mL,加入6 mL甲醇,灭活胃蛋白酶并破坏乳化结构,检测供试样品液中的总酚酸含量,以初始总酚酸含量为100%,计算总酚酸相对含量[19]。
1.2.9 人工肠液中稳定性试验 人工肠液(pH6.8):取磷酸二氢钾6.8 g溶于500 mL蒸馏水中,用0.1 mol/L NaOH溶液调节pH至6.8,加入胰酶(250 U/mg)10 g,定容至1000 mL[18]。其余步骤同1.2.8。
1.2.10 包埋材料结构形态观察 分别将采用乳清蛋白、β-环糊精、乳清蛋白-果胶复合乳液包埋的杨梅酚酸乳液使用超纯水稀释100倍,置于光学显微镜下放大40倍进行观察[13]。
1.3 数据处理
采用Excel 2016对数据进行处理,试验数据均以平均值±标准偏差形式表示,试验重复三次,采用SAS软件8.0版本进行显著性差异分析。
2 结果与分析
2.1 杨梅酚酸乳液的包埋率
包埋率可表示产生微胶囊后核心化合物在壁材中的保留程度。不同材料杨梅酚酸的包埋率如图1所示,包埋率均在65%以上,但是不同乳状液杨梅酚酸的包埋效果存在差异,其中以乳清蛋白-果胶混合乳液的包埋效果最好,可达82.33%,与其余两种包埋方式相比存在显著性差异(P<0.05),β-环糊精的包埋率为72.12%,乳清蛋白包埋率为69.33%,两者无显著差异(P>0.05)。Choi等[20]也发现果胶与乳清蛋白结合使用可提高包埋率,原因是果胶和蛋白质之间可以发生静电吸引,产生厚的界面膜,保护核心化合物不受破坏。
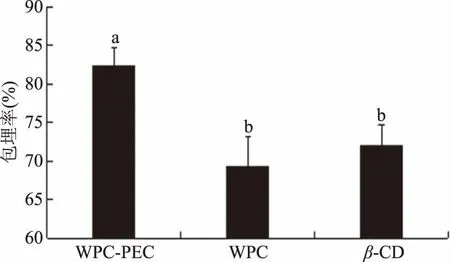
图1 不同壁材对杨梅酚酸包埋率的影响
2.2 pH对不同壁材包埋杨梅酚酸稳定性的影响
不同壁材包埋杨梅酚酸的酸碱稳定性如图2所示,杨梅酚酸的相对含量随pH的增加呈逐渐下降的趋势,表明在酸性条件下酚酸较为稳定,在碱性条件下酚酸易降解。Guo等[21]也发现酚酸的降解速率随pH的增加而迅速增大,这可能与酚酸的分子结构相关。pH=3.0时,杨梅酚酸是否包埋对其降解无显著作用(P>0.05);pH=5.0时,乳清蛋白-果胶混合乳液包埋的杨梅酚酸稳定性显著提高(P<0.05),而对照组与其他两种包埋材料处理的杨梅酚酸稳定性相比并无显著性差异(P>0.05);pH=7.0时,三种材料包埋的酚酸稳定性均显著高于对照组(P<0.05),其中乳清蛋白-果胶混合乳液包埋的杨梅酚酸稳定性最佳;pH=11.0时,对照组中杨梅酚酸相对含量最低,剩余酚酸相对含量仅为25.46%,乳清蛋白-果胶混合乳液包埋的杨梅酚酸含量最高为52.23%,β-环糊精包埋组为41.35%,乳清蛋白包埋组为42.88%。在中性和碱性条件下,包埋处理对杨梅酚酸的保护作用显著(P<0.05),其中乳清蛋白-果胶混合乳液的包埋效果最佳,与其他两种包埋处理相比,杨梅酚酸稳定性显著增加(P<0.05),而乳清蛋白包埋组与β-环糊精包埋组并无显著性差异(P>0.05)。
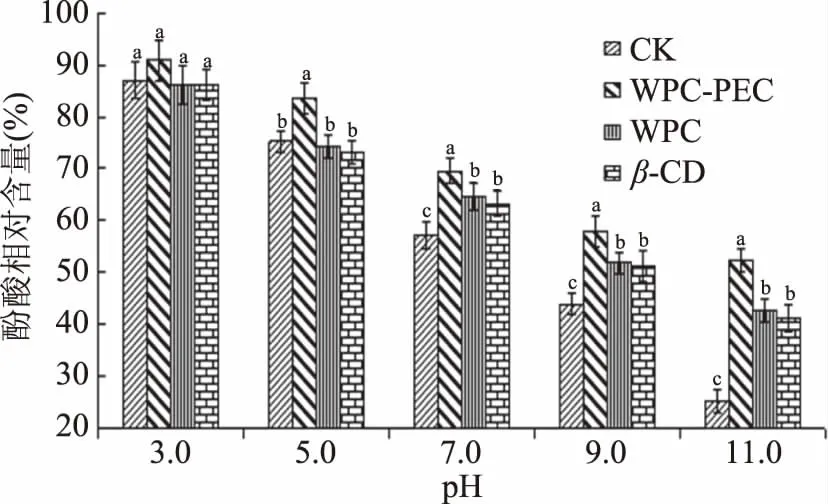
图2 不同pH环境对不同包埋处理的杨梅酚酸稳定性的影响
2.3 高温环境对不同壁材包埋杨梅酚酸稳定性的影响
不同壁材包埋的杨梅酚酸的温度稳定性如图3所示,高温条件下生物活性物质易降解,因而其功能活性随之降低。60 ℃时,随着处理时间的延长,各组杨梅酚酸的相对含量呈下降趋势,其中乳清蛋白-果胶包埋的杨梅酚酸降解速率最为缓慢,60 ℃水浴120 min,酚酸相对含量为88.45%,其次是乳清蛋白包埋乳液为81.94%,无包膜处理的杨梅酚酸乳液稳定性最差,相对含量仅为76.86%。90 ℃处理120 min后,各组杨梅酚酸剩余相对含量均低于60 ℃处理组(P<0.05)。由此可见,温度的升高加速了杨梅酚酸的降解,黄世超[22]也发现高温条件会加速丹酚酸B的降解。90 ℃处理120 min后,乳清蛋白-果胶混合物包埋的杨梅酚酸组稳定性最好,酚酸剩余相对含量为68.28%,显著高于对照组的52.39%(P<0.05)。郑利琴[23]以耐热性物质乙基纤维素为壁材包埋杨梅多酚,包埋后能够有效降低杨梅多酚在高温中的变性损失。以上结果表明,包埋处理能提高杨梅酚酸的热稳定性,且以乳清蛋白-果胶混合物包膜效果最佳。
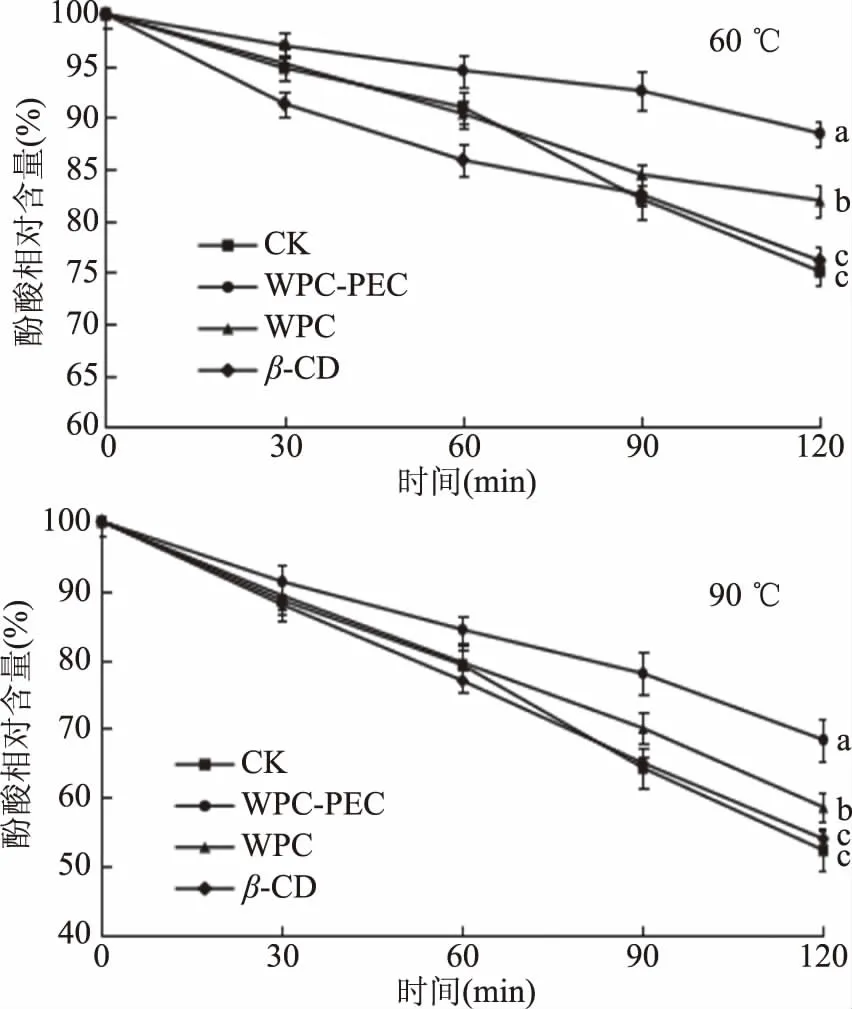
图3 不同温度对不同包膜处理的杨梅酚酸稳定性的影响
2.4 光照对不同壁材包埋杨梅酚酸稳定性的影响
不同壁材包埋的杨梅酚酸的光照稳定性如图4所示,对照组光照处理120 min后酚酸剩余相对含量为68.20%,而黑暗条件下酚酸相对含量(98.25%)显著高于其他组(P<0.05),可见光照会加速杨梅酚酸的降解。这与郑亚明[17]关于丹酚酸B的分离纯化及稳定性研究结果一致。本实验结果显示,乳清蛋白-果胶包埋处理能有效缓解杨梅酚酸在光照条件下的降解作用,酚酸剩余相对含量为77.67%,显著高于对照组(P<0.05),乳清蛋白与β-环糊精包膜的杨梅酚酸相对含量与对照组无显著性差异(P>0.05)。可能是因为乳清蛋白-果胶复合物乳液形成的涂层结构更紧密,可有效抵挡光照,提高酚酸光稳定性。
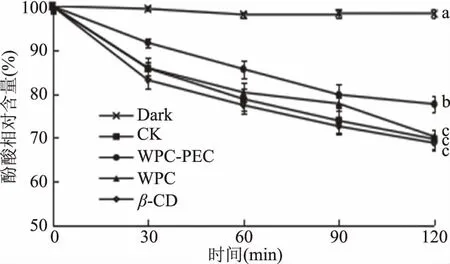
图4 光照对不同包膜处理的杨梅酚酸稳定性的影响
2.5 不同壁材包埋杨梅酚酸在人工胃液中的稳定性
不同壁材包埋的杨梅酚酸在体外模拟人工胃液中的稳定性如图5所示,随着时间的延长,不同处理的杨梅酚酸在人工胃液中的相对含量逐渐降低,但乳清蛋白-果胶、乳清蛋白、β-环糊精等包埋的杨梅酚酸乳液均高于对照组乳液中杨梅酚酸的相对含量。陈芳宁等[19]发现丹酚酸B脂化乳、脂化乳粒能提高所包载药物在人工胃肠液中的稳定性。在本实验中,人工胃液处理120 min后,对照组中酚酸的相对含量(60.78%)显著(P<0.05)低于乳清蛋白-果胶包埋组(71.39%)、乳清蛋白包埋组(66.12%)和β-环糊精包埋组(63.77%),结果说明包膜体系有助于提高酚酸在人工胃液中的稳定性,其中乳清蛋白-果胶混合物能最大程度提高所包埋杨梅酚酸的稳定性,有效抵抗外界不利环境,从而减少杨梅酚酸的降解。

图5 人工胃液对不同包膜处理的杨梅酚酸稳定性的影响
2.6 不同壁材包埋杨梅酚酸在人工肠液中的稳定性
不同壁材包埋的杨梅酚酸在体外模拟人工肠液中的稳定性如图6所示,不同包埋处理的杨梅酚酸含量均随着处理时间的延长而逐渐降低。与图5在模拟胃液中的结果对比可知,杨梅酚酸在人工肠液中的稳定性显著(P<0.05)低于同条件下在人工胃液中的稳定性。前期研究也发现丹酚酸在空腹胃液中处理4 h仅降低了11.20%,而在大肠液中处理4 h,其含量降低40.65%[24]。可能是由于人工肠液的pH高于人工胃液,碱性环境加剧了杨梅酚酸的降解,该结果与不同壁材包埋杨梅酚酸的酸碱稳定性一致(图2)。在本实验中,经人工肠液处理120 min后,乳清蛋白-果胶包埋组、乳清蛋白包埋组和β-环糊精包埋组的酚酸剩余相对含量分别为65.12%、57.50%和50.13%,均显著高于对照组杨梅酚酸的45.62%(P<0.05)。说明包埋体系有助于提高杨梅酚酸在人工肠液中的稳定性,其中乳清蛋白-果胶混合物的包埋效果最佳,能最大程度提高杨梅酚酸在人工肠液中的稳定性。

图6 人工肠液对不同包膜处理的杨梅酚酸稳定性的影响
2.7 光学显微镜观察
通过光学显微镜观察包埋乳液形态,结果发现乳液呈被包裹状,内部水相被油滴包围,油滴被外层结构覆盖,证明乳液液滴上存在包膜。与用乳清蛋白(图7B)或β-环糊精(图7C)包埋的乳液相比,乳清蛋白-果胶复合物(图7A)包埋的乳液具有更大的粒径,但是粒径大并不是因为涂层结构疏松引起的,而是因为乳清蛋白-果胶复合物在水-油-水乳液表面形成了更强的凝胶网络和更厚的涂层结构。Huang等[13]也发现乳清蛋白-果胶复合物包埋亲水性熊果苷和疏水性香豆酸形成的乳液粒径更大,且具有良好的稳定性,可能是因为包裹更紧密所致。Faridi等[25]发现,虽然乳清蛋白-果胶复合物包埋乳液粒径大于其他包埋物乳液,但是可以有效地保持乳液稳定性,该发现与本研究结果一致。相反,单独的乳清蛋白包埋或乳清蛋白-阿拉伯胶复合物包埋乳液在保存过程中粒径会逐渐变大,稳定性逐渐下降[26]。综上所述,乳清蛋白-果胶包埋是一种能有效提高杨梅酚酸稳定性的方式。

图7 不同包埋处理的杨梅酚酸显微镜图片
3 结论
蛋白质在其等电点以下(pI≈5)具有正电荷,可以通过静电相互作用吸引多糖上的阴离子基团,从而形成稳定的蛋白质-多糖复合物乳液包埋以抵抗各种不利的环境压力,保证内包物的稳定[13]。本研究以乳清蛋白、β-环糊精和乳清蛋白-果胶混合物为壁材包埋杨梅酚酸,结果显示乳清蛋白-果胶混合乳液对于杨梅酚酸包埋效果最好,包埋率可达82.33%,显著高于乳清蛋白(69.33%)和β-环糊精(72.12%)的包埋率。乳清蛋白多以颗粒状聚集,形成纤维聚集的网络结构,同时高甲氧基果胶与乳清蛋白发生静电相互作用形成氢键,从而实现高度稳定的凝胶网络。
酚酸在极端环境中(高pH、高温和光照)以及人体的胃肠条件中稳定性较差且易分解[27-28]。通过研究不同壁材包埋杨梅酚酸在高温、高pH、光照下稳定性,发现乳清蛋白-果胶混合乳液所包埋的杨梅酚酸在pH11.0,90 ℃及光照等极端环境中都呈现出较好的稳定性,且效果显著优于乳清蛋白或β-环糊精包埋(P<0.05)。此外,本实验还模拟了人工胃肠环境对杨梅酚酸稳定性的影响,发现乳清蛋白-果胶混合乳液对杨梅酚酸稳定性的保持效果最佳,处理120 min后剩余相对含量仍在70%以上,有效提高了酚酸在胃肠道中的稳定性。而且本研究还进行了各包埋乳液的形态观察,结果显示乳清蛋白-果胶复合物包埋的乳液粒径较大,表面有更牢固的凝胶网络和更厚的涂层结构,这可能与强静电相互作用和界面膜的形成有关。综上所述,乳清蛋白和高甲氧基果胶作为杨梅酚酸的包膜材料能明显提高杨梅酚酸的稳定性,为后续研究开发富含酚酸的食品提供了理论基础。
