基于氯化血红素/G-四链体比色分析检测食品中赭曲霉毒素A
2020-10-23孙怀霞林郑忠洪诚毅黄志勇
孙怀霞,林郑忠,洪诚毅,黄志勇
(集美大学食品与生物工程学院,福建厦门 361021)
赭曲霉毒素(Ochratoxin,OT)是由苯丙氨酸与异香豆素缩合的衍生物[1],由曲霉如赭曲霉、丝状霉、碳曲霉和青霉如疣状青霉等产生[2-4],主要有A、B、C、D四种结构类似的化合物,其中赭曲霉毒素A(Ochratoxin A,OTA)毒性最大、分布最广。OTA易感染谷物、豆类、坚果和酒类等多种食物[5-7],可通过肾毒性、肝毒性、神经毒性和免疫毒性以及致癌、致畸等损害人体健康[8-9]。欧盟规定OTA在谷物和速溶咖啡限量为5.0和10 μg/kg[10],我国卫生部也规定OTA在谷物及其制品限量为5.0 μg/kg、干果为5.0 μg/kg[11]。目前,OTA检测方法有薄层色谱法[12]、高效液相色谱法[13]、高效液相色谱-质谱联用法[14]、酶联免疫吸附法[15]等。但是这些方法存在检测仪器昂贵、预处理繁琐和对操作人员要求高以及抗体价格昂贵、稳定性差等问题[16-17],限制了其应用。因此,寻找成本低、稳定好,操作简便的OTA检测方法至关重要。
核酸适配体由体外富集技术获得[18],具有成本低、毒性小、易于合成和修饰等优点[19],已应用于多种检测探针的构建,如荧光适体探针[20]、比色适体探针[21]、基于差示伏安脉冲法的适配体传感探针[22]、比例荧光共振能量转移适体探针[23]和SYBR金作为探针的无标记适体探针[24]等,其中比色适体探针因其可视化检测而广受关注。氯化血红素(Hemin)是许多天然酶的重要催化辅助因子,调节其催化活性是检测信号和开发分析方法常用的手段[25]。如在还原氧化石墨烯(Reduced graphene oxide,RGO)表面修饰Hemin得到Hemin-RGO二元复合物,再还原氯金酸,可获得具有过氧化物酶活性的Hemin-RGO-Au复合材料[26]。此外,Hemin在水溶液中溶解性较差,极易聚集导致其催化活性被抑制。而当溶液中存在富含鸟嘌呤(guanine,G)的DNA序列时,Hemin可以和富G序列结合形成具有高催化活性的Hemin/G-四链体模拟酶[27],使Hemin的过氧化物酶活性大大增强。
因此,文章基于Hemin/G-四链体的过氧化物酶活性构建了一种无标记DNA比色分析探针,利用Hemin/G-四链体催化2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)(2,2′-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS)-过氧化氢(H2O2)体系产生肉眼可见的深绿色溶液,以期通过观察溶液颜色并测定420 nm处的吸光度值实现对OTA的定量分析,为食品中OTA检测提供新方法和思路。
1 材料与方法
1.1 材料与仪器
DNA链1序列为5′-CTG GGA GGG AGG GAG GGA TCG GGT GTG GGT GGC GTA AAG GGA GCA TCG GAC A-3′,其中OTA的适配体序列为5′-GAT CGG GTG TGG GTG GCG TAA AGG GAG CAT CGG ACA-3′[9],DNA链2序列为5′-CCC GAT CCC TCC-3′ 上海生工生物技术有限公司;98%赭曲霉毒素A(OTA)、95%盐酸土霉素(Oxytetracycline,OTC)、≥80%盐酸金霉素(Chlortetracycline,CTC)、盐酸四环素(Tetracycline,TET) 上海阿拉丁生化科技股份有限公司;ABTS、磺胺(sulfanilamide,SE) 北京百灵威科技有限公司;30% H2O2、六水合氯化镁(MgCl2·6H2O)、氯化钾(KCl)、三(羟甲基)氨基甲烷(Tris) 国药集团化学试剂有限公司;盐酸(HCl) 西陇科学股份有限公司;十二水合磷酸二氢钠(NaH2PO4·12H2O)、二水合磷酸氢二钠(Na2HPO4·2H2O) 西陇化工股份有限公司;氯化血红素(Hemin,≥95%)、黄曲霉毒素B1(Aflatoxins B1,AFB1,≥98%) 上海麦克林生化科技有限公司;赭曲霉毒素B(Ochratoxin B,OTB) 北京百奥莱博科技有限公司;所有试剂 均为国产分析纯;花生、核桃、速溶咖啡、挂面、鲜玉米、红豆 当地超市;鸡饲料 网上店铺;面包 当地面包店。
SpectraMax plus 384型酶标仪 美国Molecular Devices公司;PDA UV/VIS Lambda 265型紫外分光光度计 美国PerkinElmer公司;Arium bagtank 50水纯化系统 德国赛多利斯公司;DHG-9146A型电热恒温鼓风干燥箱 上海精宏实验设备有限公司。
1.2 实验方法
1.2.1 OTA的检测 分别取两条单链DNA(0.2 μmol/L)分别于90 ℃条件下加热5 min后缓慢冷却至室温,于37 ℃孵育30 min以形成DNA双链,再加入适量Hemin、OTA(或样品提取液)和Tris-HCl缓冲液(10 mmol/L,100 mmol/L NaCl,pH7.5),于37 ℃再次温育30 min以形成Hemin/G-四链体结构。然后加入适量ABTS、H2O2和磷酸盐缓冲液(PBS,100 mmol/L NaH2PO4,100 mmol/L Na2HPO4,pH7.0),在室温条件下振荡使其显色充分。反应150 min后观察颜色变化并测定420 nm波长下的吸光度值。
1.2.2 实际样品预处理 对于花生和核桃样品先进行研磨,然后按样品重量加入石油醚(1∶2,w/V)浸提12 h,弃石油醚层以除油脂,干燥样品并再次研磨至粉末状,过0.5 mm筛。准确称取5 g过筛样品,加25 mL 80%甲醇溶液(甲醇∶水=80∶20,V/V)室温振荡1 h,样品溶解后于8000 r/min离心15 min,选取上清液并加入1.5 g活性炭脱色,振荡30 min后,8000 r/min离心15 min除去活性炭,取上清液过两次0.45 μm有机微孔滤膜以去除未沉淀的活性炭颗粒,所得滤液即为样品提取液,将其保存在4 ℃待用。其他样品无需去除油脂,可直接进行上述研磨、过筛、溶解、离心、脱色和过滤等步骤处理。此外对于速溶咖啡样品脱色时添加2.5 g活性炭,且重复两次,其余处理步骤相同。对提取液按1.2.1 OTA检测方法进行测定,将测得吸光度值代入标准曲线计算OTA浓度。
1.2.3 加标回收试验 选择核桃和花生样品进行OTA的加标回收试验,原因是此两种样品处理方式相同且易研磨成粉、易脱色,每种样品选择3个加标水平,每个水平平行3份,此两种样品的加标水平分别为1、5、10 nmol/L和0.1、0.2、0.3 μmol/L。按1.2.2的样品处理方法进行处理,将处理后的样品溶液按1.2.1中OTA检测方法测定,计算回收率。
1.3 数据处理
将三次平行实验测得的数据先经WPS 2019表格处理,再将处理后的数据用Origin 9.0绘图软件绘制成图。
2 结果与分析
2.1 检测探针的构建
如图1所示,无OTA时,DNA保持双链结构,Hemin由于聚集而降低其过氧化物酶活性,无法催化ABTS发生氧化反应,此时溶液呈浅绿色且420 nm处的吸光度值低(图2a);而当存在OTA时,OTA与适配体特异性结合,DNA双链因解链暴露出富G序列,当加入Hemin后,富G序列与Hemin结合形成稳定的G-四链体结构,并呈现较高的过氧化物酶活性,可催化H2O2氧化ABTS,使溶液由浅绿色变成深绿色且420 nm处吸光度值较大(图2b),说明该方法可用于OTA检测。
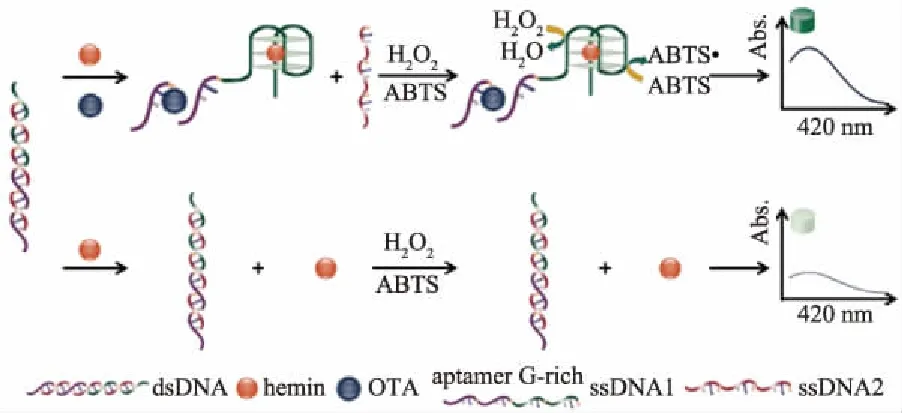
图1 基于氯化血红素/G-四链体比色分析检测OTA的示意图
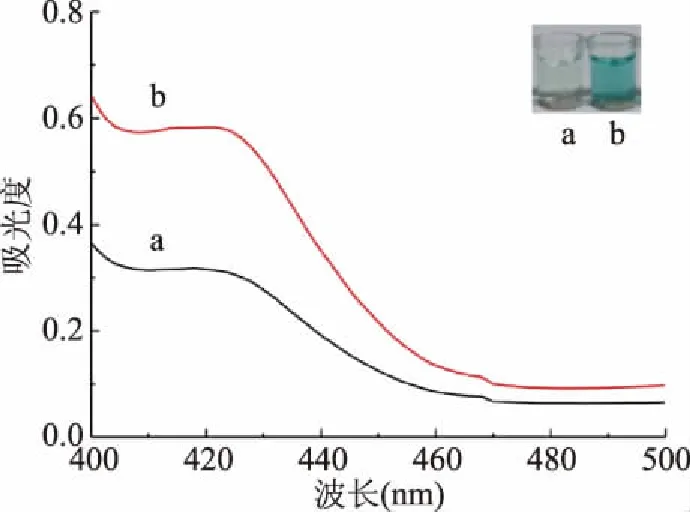
图2 体系中不存在(a)及存在(b)2 μmol/L OTA的吸光度
2.2 检测条件优化
实验对反应时间、反应缓冲体系、pH以及Hemin、ABTS和H2O2的浓度分别进行了优化。如图3A所示,随着显色时间延长,420 nm处吸光度随之增加,并在150 min时达到稳定,因此显色时间设定为150 min。图3B表明,以PBS缓冲液为介质,其吸光度最大,因此,该实验使用PBS作为缓冲液。此外,PBS在pH7.0时信号与背景的比值(信背比,A/A0)最大(图3C)。图3D~图3F表明,当Hemin浓度为1 μmol/L、ABTS浓度为4 mmol/L和H2O2浓度为2 mmol/L时A/A0最大。综上,优化条件为:在pH7.0的PBS缓冲液中,加入1 μmol/L Hemin、4 mmol/L ABTS和2 mmol/L H2O2并在室温下反应150 min后于420 nm检测吸光度。
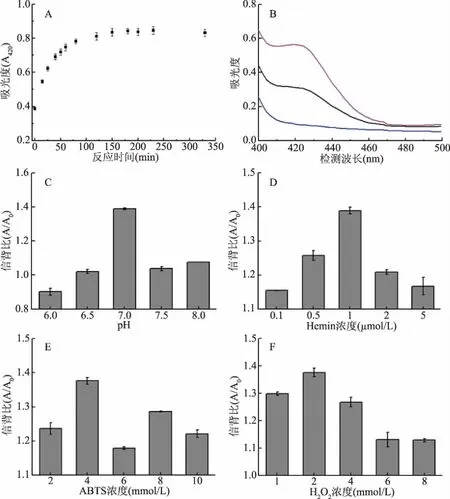
图3 检测条件对OTA检测的影响
2.3 线性关系
实验在优化条件下考察了DNA探针在OTA浓度与吸光度及溶液颜色的响应关系,由图4A可知,在0.001~2.5 μmol/L范围内,随着OTA浓度的增加,底物溶液呈现出由浅绿色到深绿色的颜色变化,420 nm的吸光度值也逐渐增加(图4B~图4C),可能的原因是OTA与适配体序列特异性结合,导致双链解开而暴露出富G序列,富G序列可与Hemin结合成具有过氧化物酶活性的Hemin/G-四链体结构,该结构可催化氧化H2O2-ABTS显色。随着加入的OTA浓度增大,与其结合的适配体浓度也随之增大,被解开的双链浓度亦随之增多,则会形成更多的Hemin/G-四链体结构,催化更多底物显色。图4D表明,OTA在0.001~0.01 μmol/L范围内,吸光度与OTA浓度呈现良好的线性关系,线性方程为y=4.567x+0.312,决定系数R2为0.998;图4E表明,在0.01~2.5 μmol/L范围内,吸光度与OTA呈现良好的线性关系,线性方程为y=0.111x+0.356,决定系数R2为0.994,以3倍标准偏差计算检出限(LOD)为70.3 pmol/L(3α/κ,n=10)。对比其他基于适配体的OTA检测方法(表1),该方法的线性范围较宽,检测限较低。

表1 对比其他适配体检测OTA的方法
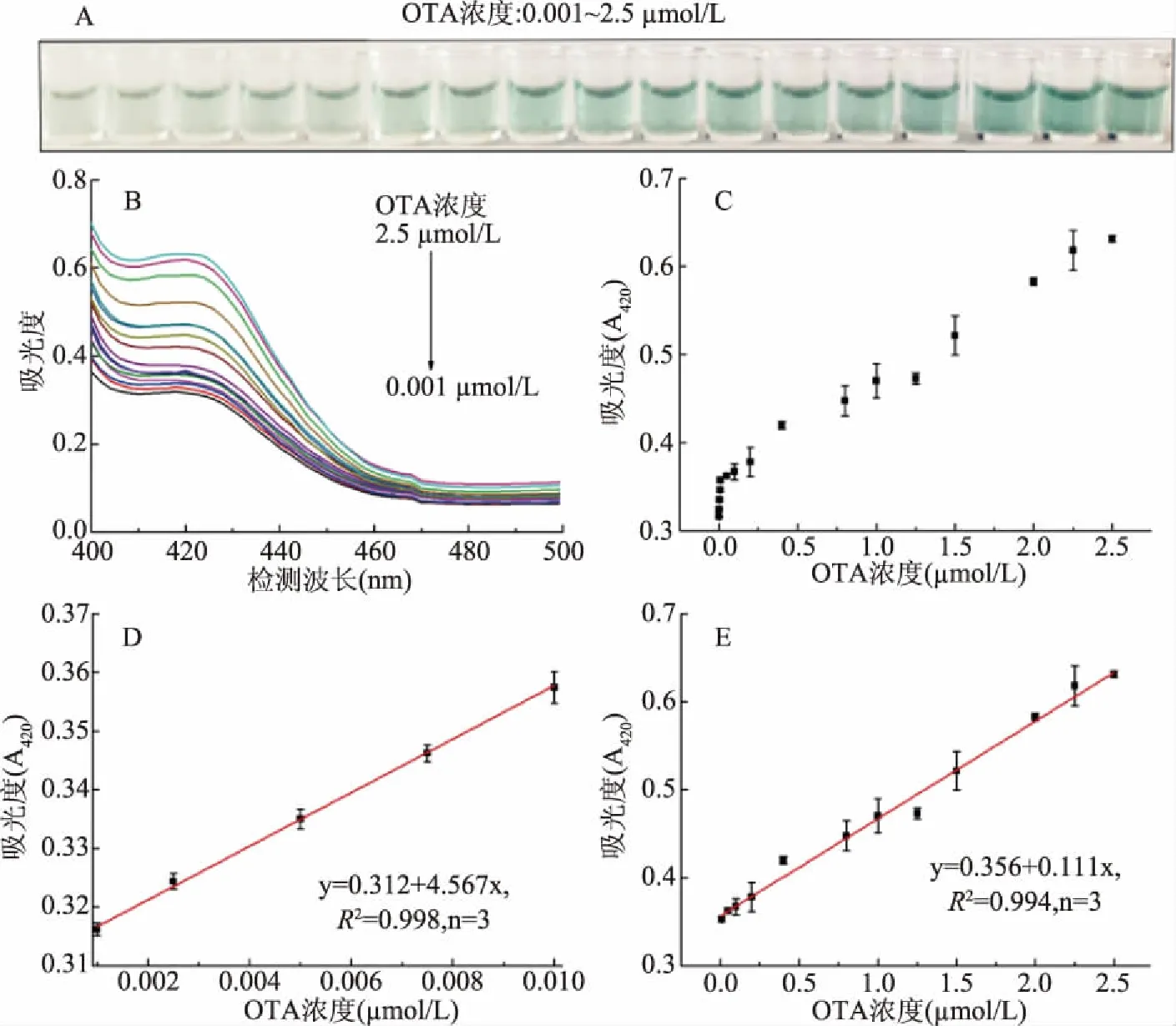
图4 氯化血红素/G-四链体与不同浓度OTA反应
2.4 选择性
实验选取了1 μmol/L的黄曲霉毒素B1(AFB1)、赭曲霉毒素B(OTB)、磺胺(SE)、盐酸金霉素(CTC)、盐酸四环素(TET)和盐酸土霉素(OTC)等物质,研究其对OTA检测的影响。试验结果如图5所示,在相同浓度下,这些物质的信背比(即信号与背景的吸光度比值)都较低,而只有加入OTA时,信背比较大,说明该方法能够特异性地检测OTA,将这些物质与OTA混合加入反应,信背比没有产生明显的变化,说明这些物质对OTA的检测没有明显的干扰。综上,该方法对OTA的检测具有良好的选择性。
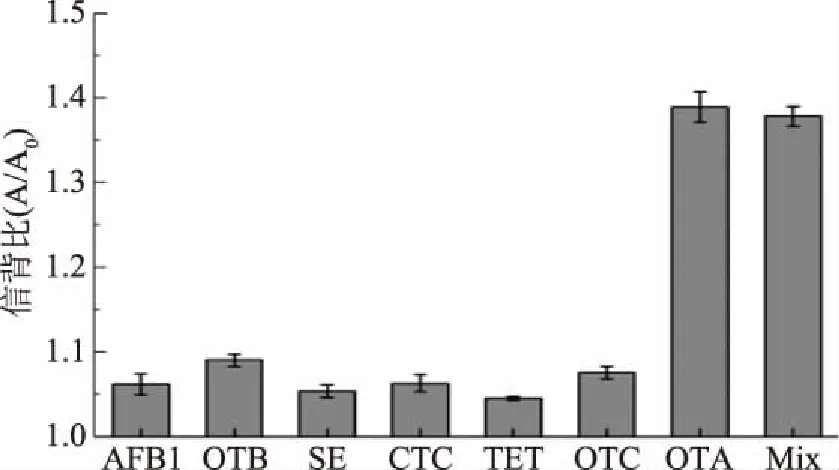
图5 AFB1、OTB、SE、CTC、TET和OTC对检测OTA的影响与干扰
2.5 样品的检测
为了考察该方法在实际样品中检测OTA的性能,实验选取了10种食品样品进行试验,结果如图6所示。花生、挂面、面包1、红豆、鸡饲料和速溶咖啡1等样品中均有OTA检出,其中挂面、面包1、红豆、花生样品和鸡饲料中OTA含量超出国家标准(5.0 μg/kg即0.012 μmol/L)[11],速溶咖啡1中OTA含量较低且符合国家标准,原因可能是这些样品保存不当被霉菌污染(挂面系购回放至过期,面包1、红豆和花生均为购回放至发霉),而霉菌可产生赭曲霉毒素A[28-30],但鲜玉米、核桃、面包2(保质期内)和速溶咖啡2(保质期内)等样品均未检出。
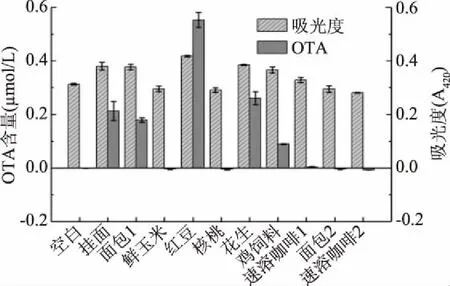
图6 实际样品中OTA检测
2.6 加标回收率
核桃(未检出)和花生(检出)样品的加标回收试验结果如表2所示,OTA的加标回收率范围分别为91.9%~109.0%和94.3%~107.0%,表明该方法可用于实际样品中OTA的检测。
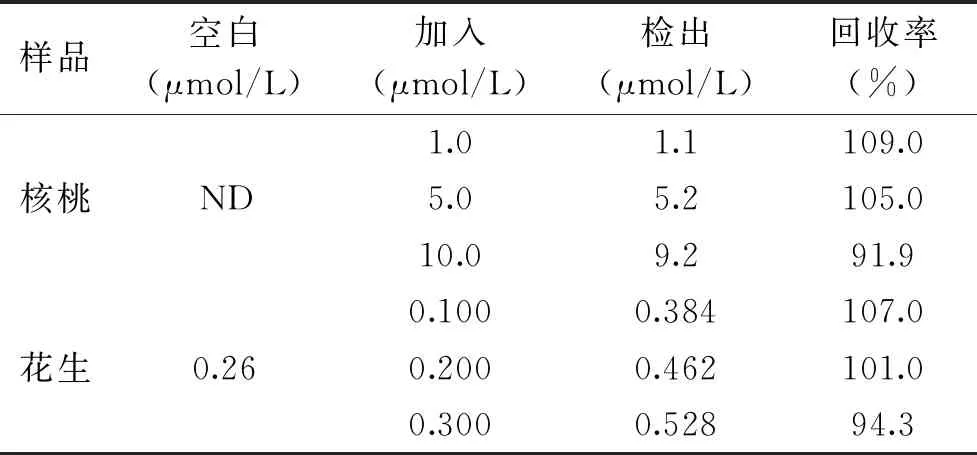
表2 核桃和花生样品中OTA加标回收试验
3 结论
文章设计了一种基于氯化血红素/G-四链体比色分析检测食品中赭曲霉毒素A的方法。方法通过OTA与适配体的特异性结合,调节氯化血红素的模拟酶活性,从而检测食品中OTA的含量。本方法检测OTA的线性范围为0.001~2.5 μmol/L,最低检出限为70.3 pmol/L,将OTA标准溶液加入食品样品中,测得加标回收率范围为91.9%~109.0%。对于实际样品中OTA的检测,该方法具有成本低、操作简便、结果可视的特点。但是该方法未能达到真正意义上的可视化定量分析OTA含量,定量分析主要通过仪器测得,未来可考虑建立OTA精确定量的可视化分析方法。
