苍术挥发油对溃疡性结肠炎大鼠的改善作用
2020-10-23刘晓兰张永忠张俊玲聂晓博贾琳刘会丽
刘晓兰,张永忠,张俊玲,聂晓博,贾琳,刘会丽△
溃疡性结肠炎(ulcerative colitis,UC)是一种慢性非特异性结肠炎症性疾病,其发病机制尚不清楚。近年来研究发现,细胞自噬与炎症细胞因子相互作用造成肠道内环境紊乱,可能是引起慢性肠道炎症的原因之一[1-2]。苍术为中医临床治疗UC的常用药材,挥发油为其主要有效成分[3]。本研究对苍术挥发油干预大鼠实验性UC的作用进行观察,并从细胞自噬基因和炎症反应角度探讨本药对UC的保护作用机制。
1 材料与方法
1.1材料 SPF级雄性SD大鼠85只,7~9周龄,体质量(200±20)g,购自斯贝福(北京)生物技术有限公司,实验动物许可证号SCXK(京)2019-0010。苍术购自河北省中医院,经医院药剂科鉴定为菊科植物茅苍术[Atractylodeslancea(Thunb.)DC.];以水蒸气蒸馏法提取其中挥发油性成分,出油率为4.5%;实验时配成0.4 g生药/mL,存储于-4℃。美沙拉嗪购自上海艾迪发制药有限公司(批号171013)。2,4,6-三硝基苯磺酸(TNBS)5%(W/V)水溶液购自美国Sigma公司,使用前用50%乙醇配成10%(W/V)溶液。大鼠白细胞介素(IL)-6、肿瘤坏死因子(TNF)-α酶联免疫吸附测定(ELISA)试剂盒购自上海森雄科技实业有限公司。SYBR®Green Master Mix购自美国Thermo公司,微管相关蛋白1轻链3(LC3)兔抗大鼠多克隆抗体(ab51520)购自英国Abcam公司;实时荧光定量逆转录聚合酶链反应(qPCR)引物由生工生物工程(上海)有限公司合成,序列见表1。
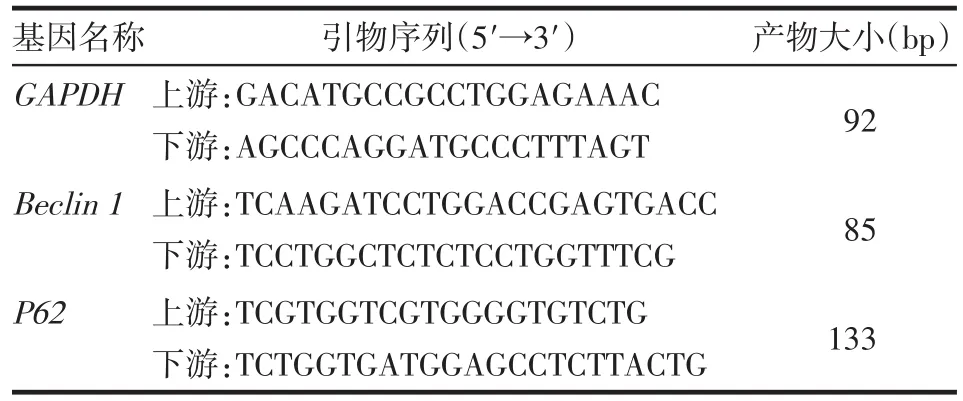
Tab.1 Sequences of primers for qPCR表1qPCR引物序列
1.2实验方法
1.2.1模型制备 大鼠适应性饲养3 d后,禁食12 h。乙醚轻度麻醉后将直径为2 mm的无菌聚乙烯管插入肛门,深约8cm,将0.25 mL TNBS溶液灌入,结束后维持肛门高位约30 s。另取10只大鼠作为空白对照组,用0.25 mL生理盐水灌肠。模型制备后第5天,若见大鼠大便次数增多,且多为稀便或黏液便,动物体质量减轻,精神萎靡不振则为模型制备成功,实验共制备模型75只,成功50只(67%)。
1.2.2分组与给药 模型制备后第6天,将模型制备成功的大鼠编号后按照随机数字表法分为5组,分别为模型组、阳性对照组、高剂量组、中剂量组和低剂量组,每组10只。实验按照体表面积比,用人体临床剂量折算出大鼠的剂量,对应的高、中、低剂量组每日分别灌胃苍术挥发油4、2及1 g生药/kg体质量,阳性对照组每日灌胃美沙拉嗪0.36 g/kg体质量,每日1次,每次10 mL/kg,连续10 d。空白对照组和模型组大鼠每日灌胃等体积蒸馏水。
1.2.3体质量检测及取材 模型制备前、给药前和末次给药后分别记录大鼠体质量,观察一般情况和粪便性状。末次给药后,大鼠禁食12 h。将大鼠麻醉后,仰面固定,开腹,快速剪取结肠,部分用10%福尔马林固定,剩余部分快速置于液氮中冻存。
1.2.4苏木精-伊红(HE)染色观察结肠病理形态 将甲醛固定的结肠以石蜡包埋,切成4 μm薄片,常规HE染色,光学显微镜下观察形态学变化。
1.2.5ELISA检测结肠组织中IL-6和TNF-α含量 将所取结肠组织约500 mg在匀浆管中匀浆,用ELISA法检测IL-6和TNF-α含量。
1.2.6qPCR检测结肠组织中Beclin 1和P62mRNA表达水平 取约200 mg结肠组织在液氮中充分研磨,Trizol法提取RNA,测定浓度和纯度后反转录得到cDNA。最后加入相应的引物和SYBR®Green Master Mix后扩增,扩增条件:50℃2min;95 ℃ 2 min,95 ℃ 15 s,60 ℃ 30 s,45个循环。记录Ct值后采用2-ΔΔCt法计算目的基因的相对表达量。
1.2.7Western blot法检测结肠组织中LC3水平 取约500 mg结肠组织,加入2 mL蛋白裂解液、2 μL蛋白酶抑制剂和2 μL磷酸酶抑制剂,均浆,离心后取上清,进行蛋白质含量测定。配制10%SDS PAGE凝胶,取约30 μg上样,120 V恒压电泳约2 h。转膜后以5%BSA封闭2 h,分别加入1∶1 000稀释的一抗液4℃过夜。次日加入1∶10 000稀释的二抗,室温孵育1 h后化学发光,以LC3Ⅱ和LC3Ⅰ的光密度比值作为LC3蛋白相对表达量。
1.3统计学方法 所有数据采用SPSS 23.0进行统计分析,符合正态分布的计量资料以均数±标准差(±s)表示。多组间比较采用单因素方差分析,组间多重比较采用LSD-t法,以P<0.05为差异有统计学意义。
2 结果
2.1 6组大鼠体质量变化 模型制备前各组大鼠体质量差异无统计学意义(P>0.05)。给药前,模型组和各给药组间体质量差异无统计学意义(P>0.05),但均低于空白对照组(P<0.05)。给药后,与空白对照组相比,模型组大鼠和低、中、高剂量组大鼠体质量均明显降低(P<0.05),阳性对照组差异无统计学意义(P>0.05);与模型组相比,苍术挥发油中、高剂量组和阳性对照组大鼠体质量升高(P<0.05),低剂量组差异则无统计学意义(P>0.05);与低剂量组相比,高剂量组和阳性对照组大鼠体质量显著提高(P<0.05),中剂量组差异无统计学意义(P>0.05),见表2。
Tab.2 The changes of body weights during the experiment in six groups表2 6组大鼠实验期间体质量变化 (n=10,g,±s)
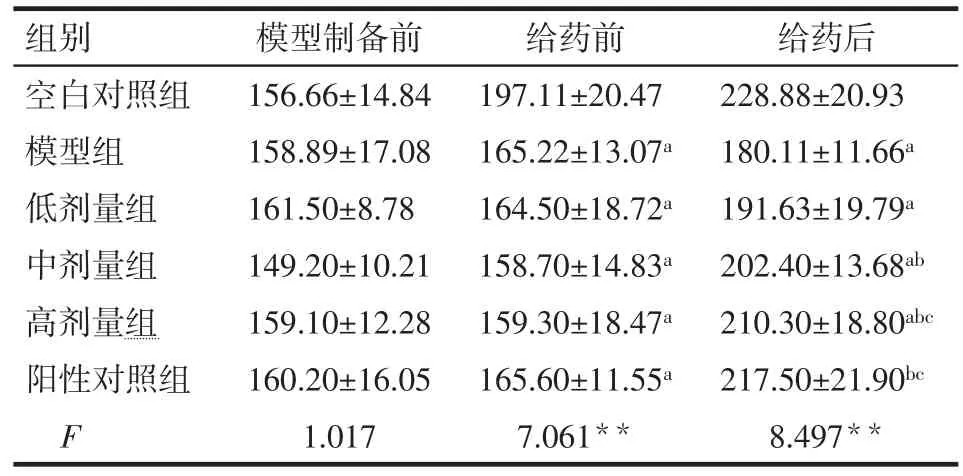
Tab.2 The changes of body weights during the experiment in six groups表2 6组大鼠实验期间体质量变化 (n=10,g,±s)
**P<0.01;a与空白对照组比较,b与模型组比较,c与低剂量组比较,均 P<0.05;表2~4,图2同
组别空白对照组模型组低剂量组中剂量组高剂量组阳性对照组F模型制备前156.66±14.84 158.89±17.08 161.50±8.78 149.20±10.21 159.10±12.28 160.20±16.05 1.017给药前197.11±20.47 165.22±13.07a 164.50±18.72a 158.70±14.83a 159.30±18.47a 165.60±11.55a 7.061**给药后228.88±20.93 180.11±11.66a 191.63±19.79a 202.40±13.68ab 210.30±18.80abc 217.50±21.90bc 8.497**
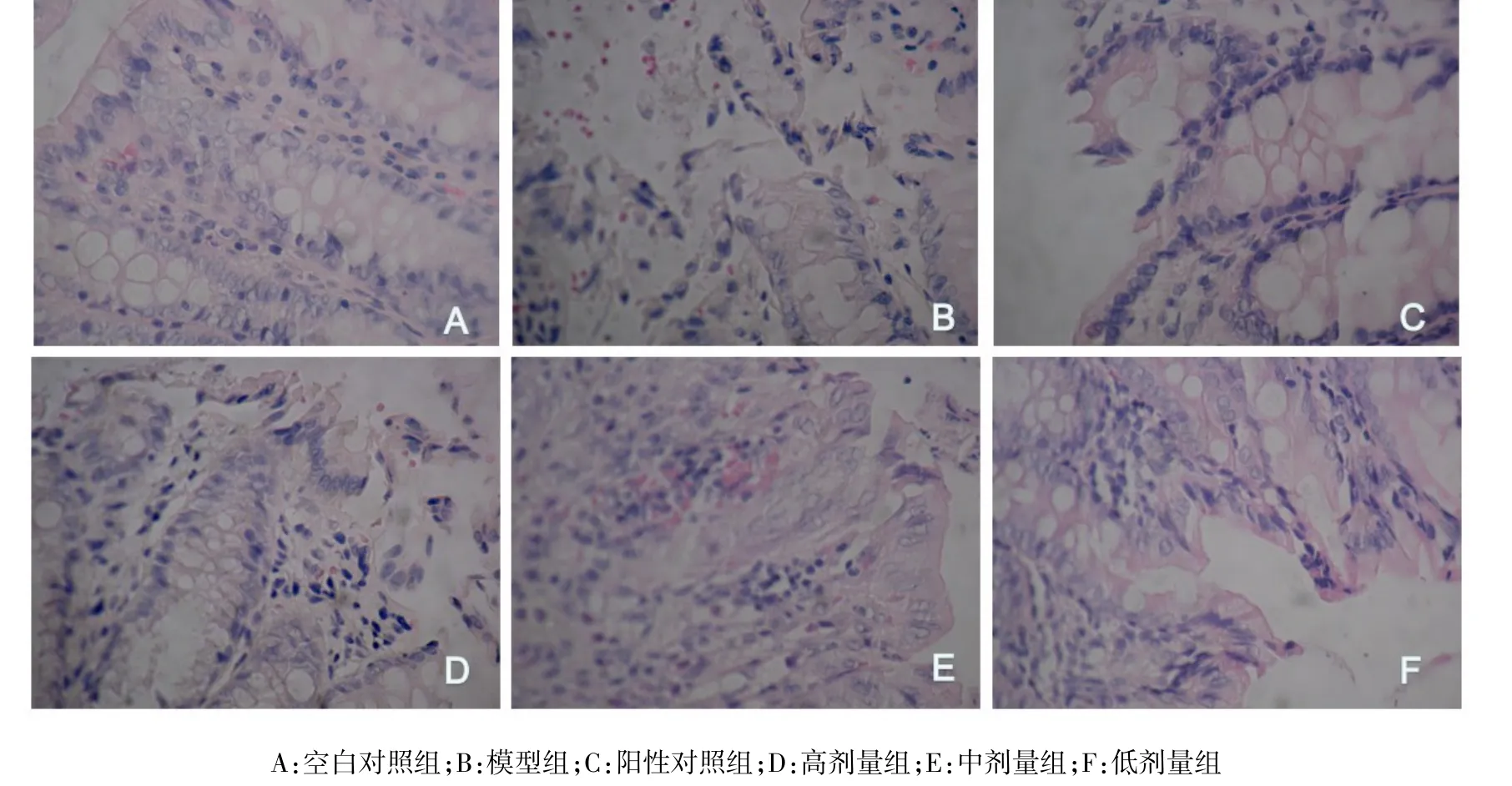
Fig.1 The pathological changes of colon tissues in six groups of rats(HE staining,×400)图1 6组大鼠结肠组织病理学变化(HE染色,×400)
2.2 6组大鼠结肠形态变化 光镜下可见,空白对照组大鼠结肠黏膜的上皮细胞完整,隐窝排列整齐(图1A);模型组大鼠结肠黏膜上皮细胞脱落,隐窝扭曲或萎缩,可见炎症细胞浸润(图1B);阳性对照组大鼠结肠上皮细胞仅有轻微损伤,隐窝排列规则(图1C)。以苍术挥发油治疗,各剂量组均表现出不同程度上皮细胞虽有脱落或隐窝扭曲,但程度较模型组减轻(图1D、E、F)。
2.3 6组大鼠结肠组织IL-6和TNF-α含量比较 与空白对照组相比,模型组大鼠结肠组织IL-6和TNF-α含量升高(P<0.05);与模型组相比,苍术挥发油中、高剂量组和阳性对照组大鼠结肠组织IL-6和TNF-α含量下降(P<0.05),低剂量组差异无统计学意义(P>0.05)。与低剂量组相比,高剂量组和阳性对照组结肠组织IL-6含量明显降低(P<0.05),中剂量组、高剂量组和阳性对照组的TNF-α含量差异无统计学意义(P>0.05),见表3。
Tab.3 The changes of IL-6 and TNF-α levels in colon tissues of the six groups表3 6组大鼠结肠组织IL-6和TNF-α含量的变化(n=10,±s)

Tab.3 The changes of IL-6 and TNF-α levels in colon tissues of the six groups表3 6组大鼠结肠组织IL-6和TNF-α含量的变化(n=10,±s)
组别空白对照组模型组低剂量组中剂量组高剂量组阳性对照组F IL-6(ng/g)12.85±4.03 22.22±2.81a 21.21±5.24a 18.14±4.69ab 16.83±4.72abc 16.95±4.13abc 5.398**TNF-α(ng/g)15.70±2.87 26.06±3.00a 23.47±2.58a 22.30±4.73ab 20.83±3.56ab 20.52±2.44ab 9.762**
2.4 6组大鼠结肠组织中Beclin 1和P62mRNA表达水平变化 与空白对照组相比,模型组大鼠结肠组织中Beclin 1和P62mRNA表达水平升高(P<0.05)。与模型组相比,苍术挥发油高剂量组和阳性对照组Beclin 1和P62 mRNA表达明显升高(P<0.05),中剂量组Beclin 1mRNA表达升高(P<0.05),低剂量组的Beclin 1、P62mRNA和中剂量组的P62mRNA表达差异无统计学意义(P>0.05)。与低剂量组相比,高剂量组和阳性对照组的Beclin 1、P62mRNA表达显著升高(P<0.05),中剂量组差异无统计学意义(P>0.05),见表4。
Tab.4 Comparison of the Beclin 1 and P62 mRNA expression levels in colon tissues between the six groups表4 6组大鼠结肠组织中Beclin 1和P62 mRNA表达水平比较 (n=10,±s)
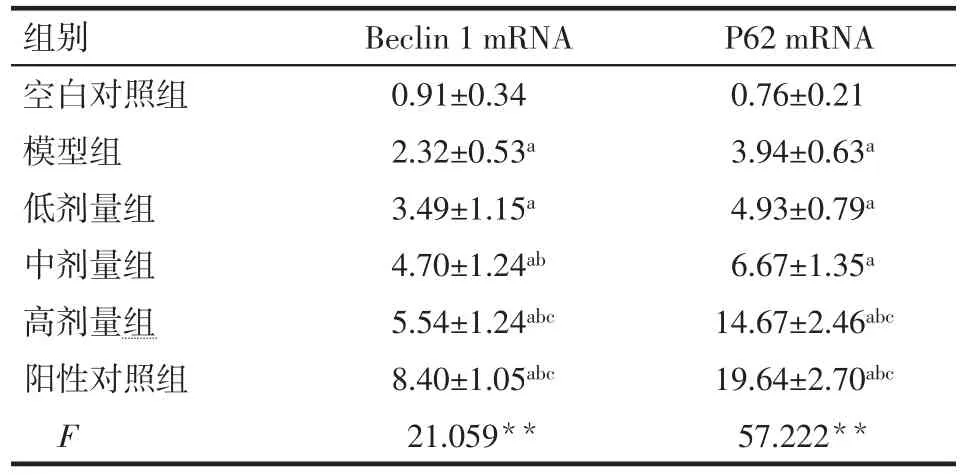
Tab.4 Comparison of the Beclin 1 and P62 mRNA expression levels in colon tissues between the six groups表4 6组大鼠结肠组织中Beclin 1和P62 mRNA表达水平比较 (n=10,±s)
组别空白对照组模型组低剂量组中剂量组高剂量组阳性对照组F Beclin 1 mRNA 0.91±0.34 2.32±0.53a 3.49±1.15a 4.70±1.24ab 5.54±1.24abc 8.40±1.05abc 21.059**P62 mRNA 0.76±0.21 3.94±0.63a 4.93±0.79a 6.67±1.35a 14.67±2.46abc 19.64±2.70abc 57.222**
2.5 6组大鼠结肠组织中LC3Ⅱ/Ⅰ蛋白表达水平变化 与空白对照组相比,模型组大鼠结肠组织中LC3Ⅱ/Ⅰ蛋白表达差异无统计学意义(P>0.05),苍术挥发油低、中、高剂量组和阳性对照组大鼠结肠组织中LC3Ⅱ/Ⅰ蛋白表达均显著上调(P<0.05)。与模型组相比,苍术挥发油中剂量组、高剂量组和阳性对照组大鼠结肠组织中LC3Ⅱ/Ⅰ蛋白表达均显著上调(P<0.05),低剂量组差异无统计学意义(P>0.05)。与低剂量组相比,高剂量组和阳性对照组的LC3II/I蛋白表达显著上调(P<0.05),中剂量组差异无统计学意义(P>0.05),见图2。
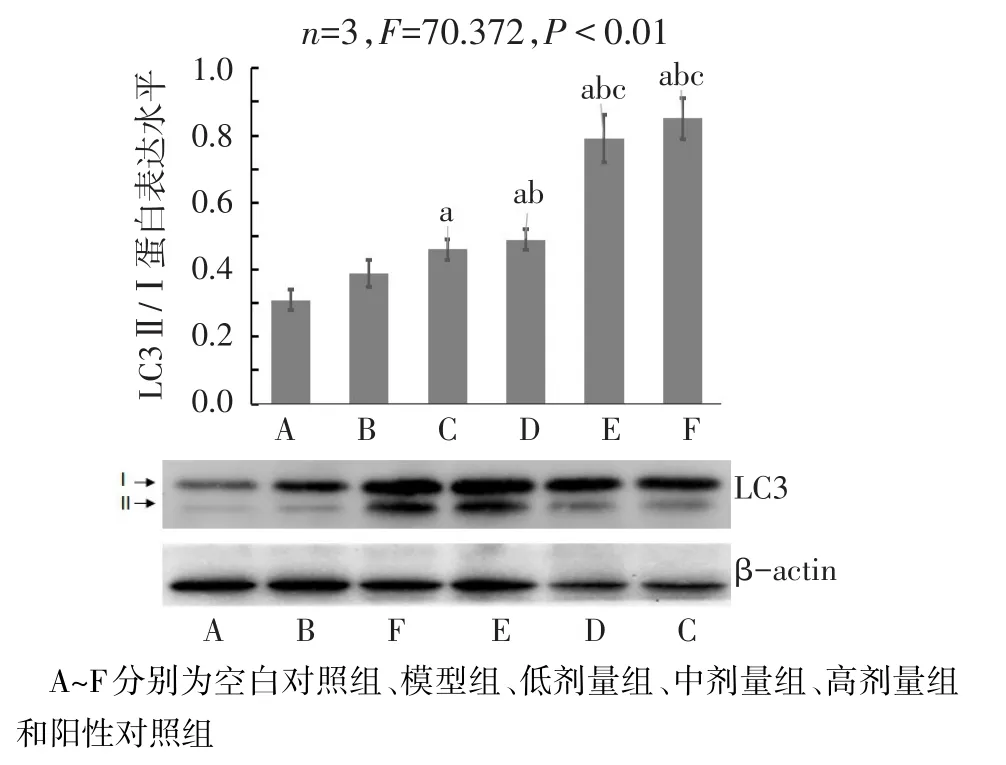
Fig.2 Changes of the LC3 Ⅱ/Ⅰ protein expression levels in colon tissues of the six groups图2 6组大鼠结肠组织中LC3Ⅱ/Ⅰ蛋白表达水平变化
3 讨论
UC是结肠黏膜层和黏膜下层的连续性炎症反应,其病变主要累及直肠和远端结肠,可引起腹痛、腹泻及黏液脓血便。虽已经过多年研究,但其发病机制至今仍未完全清楚,多数学者认为本病与自身免疫异常有关[4],而巨噬细胞在机体的免疫调节中充当着重要的角色。巨噬细胞可通过自噬与溶酶体相结合等方式吞噬、消化过多的蛋白质以及衰老、变性、受损的细胞器,实现机体物质再循环,维持细胞代谢平衡和内稳态[5-6]。在肠道炎症反应过程中,炎症细胞因子IL-6、TNF-α等大量分泌,诱导自噬功能缺乏的肠上皮细胞凋亡,使肠道屏蔽功能降低,病变加重[7]。而自噬的形成和调节是受相关基因严格调控的复杂过程。Beclin 1是哺乳动物参与自噬的特异性基因,能介导自噬相关蛋白在自噬泡上定位,调控自噬体的形成与成熟,其表达上调能够刺激自噬的发生[8]。P62则是自噬机制和自噬底物之间的适配器,常被用作检测自噬通路通畅与否[9]。LC3是分布于自噬体膜上的标记蛋白,多以LC3Ⅰ和LC3Ⅱ的形式共存。原本散布于细胞质中的LC3Ⅰ在自噬体形成后会通过偶联磷酸酰乙醇胺形成LC3Ⅱ,定位于自噬体的膜上,直至与溶酶体融合,因此LC3Ⅱ/Ⅰ在一定程度上反映了机体的自噬水平[10]。本研究中,通过5%TNBS灌肠制备UC模型大鼠,可见结肠组织中IL-6、TNF-α等炎症因子水平升高,结肠组织中Beclin 1和P62表达上调,LC3Ⅱ/Ⅰ蛋白表达上调,均表明UC大鼠自噬功能受到抑制,肠道内环境紊乱,与临床报道相一致[11-12]。
目前临床UC常以水杨酸制剂、糖皮质激素类药物治疗,虽有一定疗效,但不良反应较大,限制了其应用。近年来,中医药治疗UC因疗效显著,不良反应轻微而受到关注。中医认为UC病机是由于机体正气虚衰,阴阳失衡,造成体内“湿”“热”“瘀”邪兼夹转化,邪伏于里,出现缠绵难愈的表现[13]。从现代医学角度来看,UC“正虚邪实”可能与机体免疫功能低下引起的自噬功能异常,炎性因子堆积有关[14]。苍术为常用芳香化湿药,具有燥湿健脾,祛风散寒功效,临床常以苍术为君药治疗UC[15]。宁海荣等[16]研究发现苍术水煎液具有抗大鼠UC的作用,其机制与抗氧化、抑制肠道氧化应激损伤有关。本研究结果表明,苍术挥发油对大鼠结肠组织损伤有明显保护作用,其作用与抑制IL-6、TNF-α释放,上调自噬基因Beclin1、P62mRNA表达和LC3Ⅱ/Ⅰ蛋白表达有关。
