血红素氧合酶-1对哮喘小鼠模型IL-25和MUC5AC表达的影响
2020-10-23詹倩杜丽君戴曦袁竞刘贲王荣丽
詹倩,杜丽君,戴曦,袁竞,刘贲,王荣丽△
支气管哮喘(asthma)是一种由多种细胞及细胞组分参与的气道慢性炎症性疾病,是最常见的慢性呼吸系统疾病之一,有3亿多儿童和成人患病[1]。哮喘的具体机制尚不完全清楚,免疫反应导致树突状细胞、T淋巴细胞、B淋巴细胞、嗜酸性粒细胞、肥大细胞等浸润气道黏膜下层,产生一系列病理过程是目前的主流观点[2]。白细胞介素(IL)-25在哮喘气道炎症中发挥重要作用。IL-25不仅可诱导典型的嗜酸性炎症和气道高反应性[3],还可促进杯状细胞增生、上皮下胶原沉积和血管生成,最终导致气道重构[4],杯状细胞增生是导致气道黏液高分泌的重要环节。过度产生的黏蛋白聚集在气道导致阻塞,显著增加哮喘患者,尤其是重症患者的病死率[5]。血红素氧合酶-1(hemeoxygenase,HO-1)是血红素分解代谢的限速酶,也是一种应激反应蛋白[6],广泛参与机体炎症反应,具有抗氧化,保护重要组织、器官和细胞的功能[7]。然而,HO-1在哮喘中的抗炎作用机制尚不完全清楚。血晶素是一种高效HO-1敏化剂,能有效促进体内HO-1的释放和表达。本实验通过观察血晶素在哮喘小鼠模型中的作用,进一步探讨HO-1与IL-25诱导的气道炎症和黏液高分泌的关系,以期发掘新的哮喘病理机制和诊疗靶点。
1 材料与方法
1.1实验材料 6~8周龄SPF级雌性Balb/c小鼠28只,体质量18~22 g,购自重庆腾鑫比尔实验动物有限公司,在西南医科大学SPF级动物实验室饲养,维持室温在(22±1)℃、相对湿度40%~50%,昼夜光照节律,自由进食及饮水。卵清蛋白(OVA)、血晶素(Hemin)均购自美国Sigma公司;福多司坦片(Fudosteine)购自江苏正大丰海公司;兔抗鼠黏蛋白5AC(MUC5AC)多克隆抗体、生物素化山羊抗兔IgG购自北京博奥森公司;IL-25、MUC5AC酶联免疫吸附测定(ELISA)试剂盒均购自中国上海西唐生物公司;酶标仪购自美国Thermo公司;高速离心机购自美国Sigma公司;光学显微镜购自日本OLYMPUS公司;BQ-318石蜡切片机购自湖北伯纳医疗公司。
1.2方法
1.2.1实验分组 将28只小鼠根据随机数字表法分成4组:对照组、哮喘组、血晶素组、福多司坦组,每组7只。
1.2.2干预方案 (1)哮喘组、血晶素组和福多司坦组小鼠于第1天和第14天腹腔注射 20 μg OVA+500 μg Al(OH)3+0.2 mL PBS致敏,第25、26、27、28天,将小鼠置于封闭的塑料盒(26 cm×19 cm×17 cm)中,用5%OVA溶液经超声雾化吸入激发气道高反应制备小鼠哮喘模型,每日1次,每次持续30min,对照组均以等量生理盐水代替。(2)血晶素组致敏前1、2 d,致敏后12、13、23、24、27 d腹腔注射血晶素75 μmol/kg。(3)福多司坦组分别于致敏前25、26、27 d灌胃给药福多司坦(200 mg/kg)。
1.2.3标本收集 各组小鼠于末次激发后24 h内用戊巴比妥钠腹腔注射麻醉,眼眶取血并处死小鼠,收集的血液于4℃,1 500 r/min条件下离心10 min,取上清液置于-80℃冰箱保存;左肺组织以4%多聚甲醛固定用于HE染色及免疫组化染色;右肺组织保存于-80℃冰箱备用。
1.2.4组织病理学观察 左肺组织用4%多聚甲醛固定24h,标本脱水、石蜡包埋、5 μm连续切片,常规行HE染色,显微镜下观察病理形态学改变。
1.2.5免疫组化染色检测肺组织中MUC5AC的表达 取处死后小鼠肺组织,用4%多聚甲醛磷酸盐缓冲溶液固定48 h,流水冲洗30 min后,梯度乙醇脱水,石蜡包埋、切片,采用链霉素过氧化物酶(SP)法,抗原修复后,滴加兔抗鼠抗MUC5AC抗体(1∶100)4℃孵育过夜,室温复温漂洗后,滴加生物素标记二抗37℃孵育30 min,PBS冲洗3次,DAB显色,复染、脱水、透明封片后光镜下观察MUC5AC表达情况,以胞浆棕黄染色为阳性反应,应用Image-Pro Plus图像处理系统测量MUC5AC的平均吸光度值。
1.2.6ELISA法检测IL-25、MUC5AC表达水平 将ELISA试剂盒于室温下放置半小时,取出预先冻存于-80℃冰箱的血清和肺组织,置于冰上融化,按照ELISA试剂盒说明书操作测定血清中IL-25表达水平。每份肺组织中加入1 mL PBS,置于研钵中,冰上研磨肺组织,收集匀浆,4℃,1 500 r/min条件下离心20 min,收集上清。按照ELISA试剂盒说明书操作测定肺组织中MUC5AC的水平。
1.3统计学方法 采用SPSS 22.0进行统计学处理,计量数据采用均数±标准差(±s)表示,多组样本间的比较采用单因素方差分析,组间多重比较采用LSD-t检验,相关性分析采用Pearson相关分析。P<0.05为差异有统计学意义。
2 结果
2.1 各组肺组织形态学改变观察 对照组气道上皮结构完整,未见明显结构改变及炎症细胞浸润。哮喘组肺组织可见大量炎症细胞浸润、气管黏膜增厚、黏膜下水肿。血晶素组和福多司坦组可见少量炎症细胞浸润及渗出,病理改变较哮喘组轻,见图1。
2.2 免疫组化染色检测各组肺组织MUC5AC的表达 与对照组相比,哮喘组肺组织MUC5AC的表达明显增加(P<0.05)。在支气管、支气管上皮细胞、气道基底层、肺泡间隔血管周围呈黄色、棕色或褐色强阳性表达;与哮喘组相比,血晶素组和福多司坦组肺组织黄染明显减弱,MUC5AC的表达明显降低,且血晶素组较福多司坦组降低更明显(P<0.05),见图2、3。
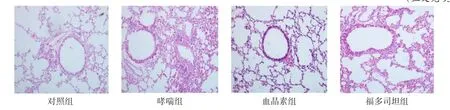
Fig.1 Histological observation of lung tissues of mice(HE,×200)图1 各组小鼠肺组织形态学观察(HE,×200)
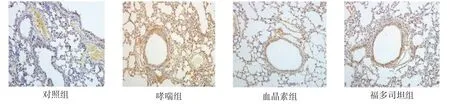
Fig.2 The expressions of MUC5AC in lung tissues of mice(IHC,×200)图2 各组肺组织中MUC5AC的表达情况(免疫组化,×200)
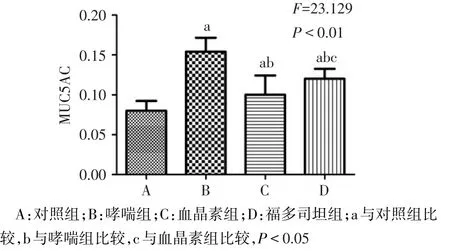
Fig.3 The average OD-value of MUC5AC positive expression cells in lung tissues of mice in each group by immunohistochemical staining图3 各组小鼠肺组织免疫组化染色MUC5AC阳性表达细胞的平均光密度值
2.3 ELISA法检测各组肺组织MUC5AC和血清IL-25水平 与对照组相比,哮喘组、血晶素组、福多司坦组MUC5AC和IL-25的表达水平明显升高(P<0.05);与哮喘组相比,血晶素组和福多司坦组MUC5AC和IL-25降低,且血晶素组较福多司坦组降低更明显(P<0.05),见表1。
Tab.1 Contents of IL-25 in serum and MUC5AC in lung tissues表1 各组肺组织MUC5AC和血清中IL-25含量(n=7,ng/L,±s)
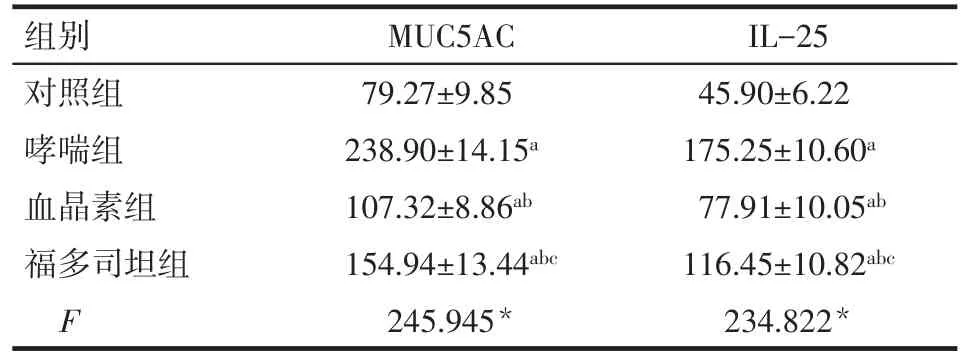
Tab.1 Contents of IL-25 in serum and MUC5AC in lung tissues表1 各组肺组织MUC5AC和血清中IL-25含量(n=7,ng/L,±s)
*P<0.05;a与对照组比较;b与哮喘组比较;c与血晶素组比较,P<0.05
组别对照组哮喘组血晶素组福多司坦组F MUC5AC 79.27±9.85 238.90±14.15a 107.32±8.86ab 154.94±13.44abc 245.945*IL-25 45.90±6.22 175.25±10.60a 77.91±10.05ab 116.45±10.82abc 234.822*
2.4 MUC5AC与IL-25的相关性分析 MUC5AC与IL-25的表达水平呈正相关(r=0.932,P<0.01),见图4。
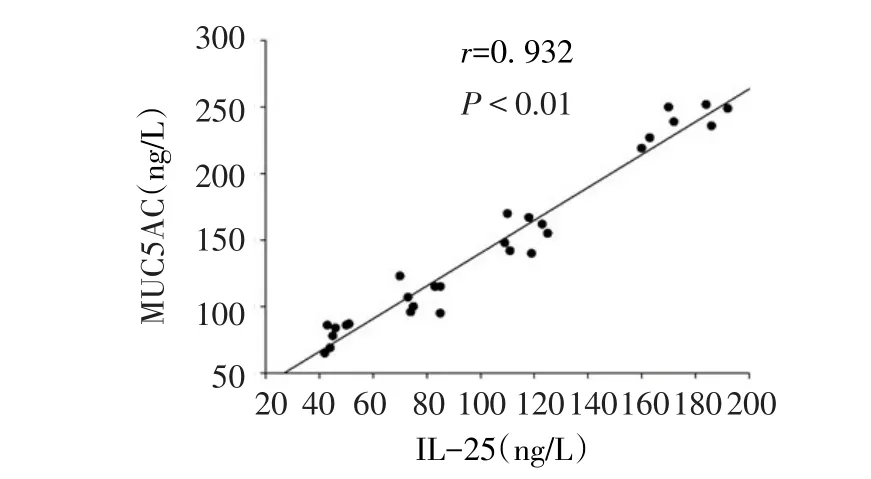
Fig.4 The correlation analysis of MUC5AC in lung tissue and IL-25 in serum图4 血清中IL-25和肺组织中MUC5AC的相关性分析
3 讨论
哮喘被认为是由2型辅助性T细胞(Th2)介导的免疫功能紊乱引起,可导致气道慢性炎症、黏液分泌过多和细胞凋亡[8-9]。其中,气道黏液高分泌是许多哮喘患者的共同特点,黏液阻塞被认为是致死性哮喘气道阻塞的机制之一[10]。因此,减少气道黏液的产生和分泌是控制和治疗哮喘的重要手段。HO-1是热休克蛋白(HSP)家族的一员,其生理功能与血红素分解代谢中的酶活性有关,其抗氧化和抗炎特性在多种炎症疾病中发挥着不可或缺的作用[11]。近年来,越来越多的研究显示,HO-1可减轻肺和其他器官的过敏性炎症,抑制Th2和Th17细胞分化[12-13]。Chen等[14]发现,HO-1可能通过氧化应激途径、转录因子和免疫细胞功能介导变态反应。HO-1不仅具有抗炎作用,还可通过靶向哮喘的促炎性核苷酸结合寡聚化结构域样受体蛋白3-视黄醇X受体(NLRP3-RXR)轴保护气道上皮细胞免于凋亡[15]。Lee等[16]研究发现HO-1的上调可减弱OVA诱导的哮喘小鼠活性氧的产生。但目前HO-1对于哮喘小鼠黏蛋白表达的影响研究较少。本研究结果显示,与哮喘组比较,血晶素组及福多司坦组气道炎症细胞与管腔分泌物明显减少,气道上皮结构相对完整,黏膜下水肿减轻,提示血晶素及福多司坦可改善支气管哮喘气道炎症及黏液分泌,减轻哮喘炎症反应。
慢性气道炎症和黏液高分泌是哮喘气道重塑的主要病理标志,导致严重哮喘患者的肺功能降低和死亡风险增加[17-18]。黏液是由一种被称为黏液素的高度糖基化的蛋白质组成,其中MUC5AC和黏蛋白5B(MUC5B)是参与哮喘的主要黏液素[19-20]。研究发现MUC5AC在哮喘患者气道内的表达水平呈持续上升,是导致气道黏液高分泌的主要因素[21]。在尘螨致敏的小鼠哮喘模型中,MUC5AC也有增加[22]。因此,抑制气道黏液的高分泌及气道重塑可能是哮喘治疗的目标。本研究结果显示,哮喘状态下小鼠的MUC5AC表达明显增加,而血晶素治疗后,MUC5AC的表达减少,提示血晶素能在一定程度上抑制MUC5AC,表明HO-1调控哮喘气道炎症与重塑的机制可能是通过抑制MUC5AC表达实现的。
研究表明,通过刺激,气道上皮释放相应的炎症介质、抗菌肽(如IL-25、IL-33、IL-13、IL-5、胸腺基质淋巴细胞生成素等),参与氧化应激、气道高反应、黏液高分泌和气道重塑[23]。IL-25是IL-17细胞因子家族的成员,主要通过白细胞介素17B型受体(IL-17RB)发挥作用。IL-25参与包括哮喘在内的多种气道慢性炎症疾病,可通过诱导气道炎症、气道杯状细胞变性、黏液高分泌、气道高反应性,从而进一步促进气道重构[24]。Gregory等[25]发现抗IL-25单克隆抗体可减轻尘螨诱发的哮喘性气道炎症反应,减轻气道重构。本研究结果显示,哮喘状态下小鼠血清中IL-25的水平明显升高,这与Zhang等[26]研究结果一致。而经血晶素或福多司坦处理后,IL-25的表达减少,提示血晶素及福多司坦能在一定程度上抑制IL-25的表达,且血晶素较福多司坦作用明显,表明HO-1可能通过抑制IL-25的表达,减轻哮喘气道炎症。笔者推测这种潜在的可能机制为:维持气道对氧化应激的不敏感性,减少炎症细胞的浸润;HO-1抑制促炎因子的产生,从而防止触发和放大炎症效应,减轻气道炎症。但本研究并未探讨HO-1对哮喘小鼠气道重构改善的影响,有待进一步研究。
综上所述,HO-1可降低MUC5AC及IL-25的表达,具有改善哮喘小鼠气道炎症反应,减轻哮喘气道黏液高分泌及炎症损伤的作用,其作用机制可能与IL-25介导的炎症反应信号通路密切相关,但具体机制尚未完全明确,还需要进一步的深入研究。
(图1、2见插页)
