猴STLV1抗体免疫梳检测方法的建立及应用
2020-10-21李丹丹王乃福王绥家刘忠梅周晓黎高慎阳凌宗帅李应国
李丹丹,王乃福,王绥家,刘忠梅,王 昱,周晓黎,艾 军,高慎阳,凌宗帅,李应国
(1.中华人民共和国海口海关,海南 海口 570311;2.中华人民共和国天津海关,天津 和平 300457;3.中华人民共和国哈尔滨海关,黑龙江 哈尔滨 150000;4.中华人民共和国重庆海关,重庆 渝北 400020;5.中华人民共和国昆明海关,云南 昆明 650228;6.锦州医科大学,辽宁 锦州 121001;7.中华人民共和国济南海关,山东 济南 250014)
嗜T淋巴细胞病毒I型(Simian T-lymphotropic virus 1,STLV1)属于逆转录病毒科正逆转录病毒亚科δ逆转录病毒属[1],主要侵害猴的免疫系统,引起免疫器官的病变及免疫机能紊乱,从而干扰试验研究[2],是普通级和SPF级实验猴的必须筛查的重要病原之一。STLV1-30蛋白结构具有保守性和种属特异性[1],本研究利用基因工程技术制备的重组STLV1-30蛋白作为诊断抗原,建立了免疫梳方法(ICA)用于对实验猴血清中STLV1 IgG抗体进行特异性检测,为STLV1抗体快速检测提供有力的技术支持。
1 材料与方法
1.1 质粒、菌株、试剂及临床样品 感受态细胞(Copetent cell)、pMD18-T载体、E.coliDH5α和pGEX-4T-1,均购自宝生物工程(大连)有限公司;BL21(DE3)pLysS感受态表达菌,购自天根生化科技(北京)有限公司;2×TaqMaster Mix、DL-2 000 DNA Marker、质粒小提试剂盒和快速琼脂糖凝胶DNA回收试剂盒,均购自康为世纪生物科技有限公司;碱性磷酸酶显色底物液(BICP/NBT)、IPTG和NC膜为北京索莱宝科技有限公司产品;EcoR Ⅰ、T4 DNA连接酶、SmaI为NEB产品;兔抗猴IgG二抗为上海优宁维生物科技股份有限公司产品;商品化的STLV抗体ELISA试剂盒为苏州西山生物技术有限公司产品;猴D型反转录病毒(Simian type-dretro virus,SRV)、猴B病毒(Monkey B virus,BV)、猴免疫缺陷病毒(Simian immunodeficiency virus,SIV)、麻疹病毒(Measles virus,MeV)和猴T淋巴细胞白血病病毒(Simian T-lymphotropic virus,STLV)这5种病毒的阳性血清及临床血清样品均来源于海南某实验猴场。
1.2 引物的设计与合成 根据GenBank登录的STLV1的核酸序列(GenBank:KY655313.1)进行初步理论筛选并标识目标序列,见表1。

表1 STLV1目标抗原表位序列的确定Table 1 Determination of antigenic epitopes sequence
在确定目标抗原表位序列位置大小之后,为提高目标抗原表位的合成效率利用OLIGO 7软件设计重复串联抗原表位基因序列,如下:5′-GAATTCCACCTCACTTATGATGCAGTCCCCACGGTACCTAT-ACGGTCCCGCTGGCACCTCACTTATGATGCAGTCC-CCACGGTACCTATACGGTCCCGCTGGCTCGAG-3′。利用交叠延伸PCR(SOE-PCR)的原理设计扩增猴STLV1病毒STLV1表位序列的SOE-PCR扩增引物[4-5],引物由生工生物工程(上海)股份有限公司合成,序列如下:
SRV1F:5′-GAATTCAATAATCAAAACCTCATTATA-GCAGGCTGTCCCGAAAATAAAAAGGGCAATAA-3′
SRV1R:5′-CTCGAGGCCCTTTTTATTTTCGGGACA-GCCTGCTATAATGAGGTTTTGATTATTGCCCT-3′
1.3 STLV1-30蛋白的表达与鉴定
1.3.1 目的基因的扩增与重组表达质粒的构建 反应体系:引物各2 μL,2×TaqMaster Mix 15 μL,超纯水13 μL,总体系30 μL。PCR扩增条件为:95 ℃ 预变性5 min;94 ℃变性1 min,63 ℃退火30 s,72 ℃延伸1 min,30个循环;72 ℃总延伸10 min。用DNA回收试剂盒回收交叠式PCR扩增产物后,用SmaⅠ与EcoRⅠ同时分别双酶切含有猴STLV1表位基因的克隆质粒pMD18T- STLV1和表达载体pGEX-4T-1,用T4 DNA 连接酶进行连接,16 ℃过夜,转入表达菌BL21(DE3)pLysS感受态细胞中,筛选阳性菌落并提取质粒进行酶切鉴定,阳性菌体命名为pGEX-4T-STLV1。
1.3.2 重组质粒的诱导表达及鉴定 将阳性重组菌pGEX-4T-STLV1/BL21(DE3)10 μL接种到5 mL含有25 μg的氨苄西林的LB液体培养基中,37 ℃、200 r/min过夜培养后,加入终浓度为0.5 mmol/L的IPTG继续诱导培养5 h;取诱导表达后的菌体超声破碎,SDS-PAGE电泳分析。
1.3.3 目的蛋白的纯化和Western Blot鉴定 采用KCl染色切胶纯化方法进行表达产物的纯化[6-7]。
1.3.4 Western Blot确定最佳抗原包被量 将阳性血清按1∶50固定浓度稀释,将纯化定量后的目的蛋白进行10倍递增稀释后包被NC膜,然后进行Western Blot分析[6-7],筛选抗原最佳包被量。
1.3.5 表达蛋白的Western Blot特异性检测 以1.3.4中抗原最佳包被量为标准,进行方法的特异性验证。选择将猴STLV1阳性血清作为待检一抗进行Western Blot特异性检测。
1.3.6 表达蛋白的Western Blot敏感性检测 将猴STLV1阳性参照血清进行2倍倍比稀释(1∶25、1∶50、1∶100、1∶200、1∶400、1∶800)后分别进行敏感性检验,确定最大检测稀释度。
1.3.7 免疫梳检测试纸的制备、使用方法与判定方法 免疫梳检测试纸的制备、使用方法与判定方法参照文献[8]进行。
1.3.8 免疫梳检测的特异性鉴定 利用制备好的免疫梳检测试纸分别对STLV1、SRV1、BV、SIV和MeV阳性血清1∶50倍稀释后进行检测,验证本方法的特异性。
1.3.9 免疫梳检测的敏感性试验 将阳性对照和阴性对照血清分别进行50倍稀释,再将猴STLV1阳性血清分别进行1∶25、1∶50、1∶100、1∶200、1∶400倍比稀释,根据优化后的免疫梳操作程序进行检测,验证该方法的灵敏度。
1.3.10 免疫梳的重复性与稳定性检测 将制备好的猴STLV1抗体免疫梳,进行批内和批间重复性,每份样品重复3次,统计分析批内和批间重复试验变异系数情况;再将同一批次的检测试纸分别4 ℃保存1个月、3个月和6个月后进行稳定性验证,统计分析免疫梳的特异性与敏感性变化情况,比较分析其稳定性。
1.3.11 免疫梳实际应用评价 利用制备好的免疫梳与商品化的ELISA检测试剂盒分别进行检测比较,以此验证其可靠性。
2 结果
2.1 猴嗜T淋巴细胞趋向性病毒I型抗原表位基因的PCR扩增 根据GenBank登录的猴STLV1的核酸序列(GenBank:KY655313.1),生物合成基因片段作为模板,STLV1-30基因特异性引物经PCR 扩增后,得到了约108 bp 的目的片段,与预计片段大小相符(见图1)。
2.2STLV1-30基因测序 DNA 序列测定结果表明,所获得序列长度为108 bp,与GenBank 上登录的相应序列完全一致。
2.3 重组表达质粒pGEX-4T-STLV1的鉴定 将表达质粒pGEX-4T-STLV1经SmaⅠ/EcoR Ⅰ双酶切和电泳后,获得的条带大小符合预期,结合最终的测序结果进一步验证,表明重组表达质粒构建正确,结果见图2所示。
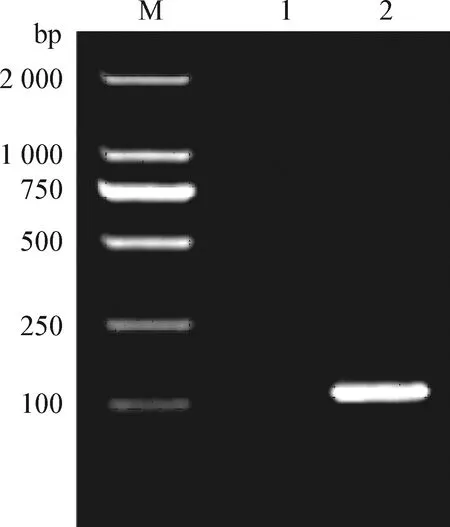
图1 扩增片段产物Fig.1 Amplified fragment productsM:DL-2 000 Marker;1:阴性对照;2:扩增片段M:DNA Marker 2 000;1:Negative control;2:Amplified fragment
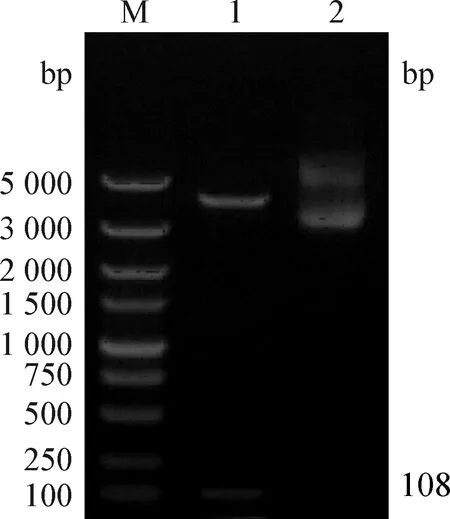
图2 STLV1抗原表位基因重组表达载体的酶切鉴定结果 Fig.2 Enzyme digestion result of STLV1 epitope gene recombinant expression vectorM:DNA Marker DS 5 000 Ladder;1:Sma I/EcoR Ⅰ 双切质粒pGEX-4T-STLV1;2:质粒pGEX-4T-STLV1M:DNA Marker DS 5 000 Ladder;1:Sma I/EcoR Ⅰ double cut plasmid pGEX-4T-STLV1;2:Plasmid pGEX-4T-STLV1
2.4 STLV1表位抗原蛋白的SDS-PAGE分析 经IPTG诱导后的重组菌BL21(DE3)pLysS通过SDS-PAGE分析,结果如图3所示,目的病毒表位抗原获得表达,大小为29 ku,符合预期(见图3)。
2.5 STLV1表位抗原蛋白的纯化 将STLV1重组表位抗原表达产物进行SDS-PAGE电泳,结果见图4,STLV1-30蛋白成功回收且纯度均一。
2.6 Western Blot确定STLV1抗原最佳包被量 对抗原包被量优化结果如图5所示,从肉眼可见度判定,以102稀释倍数的量浓度(0.02 mg/mL)确定为最佳包被量。
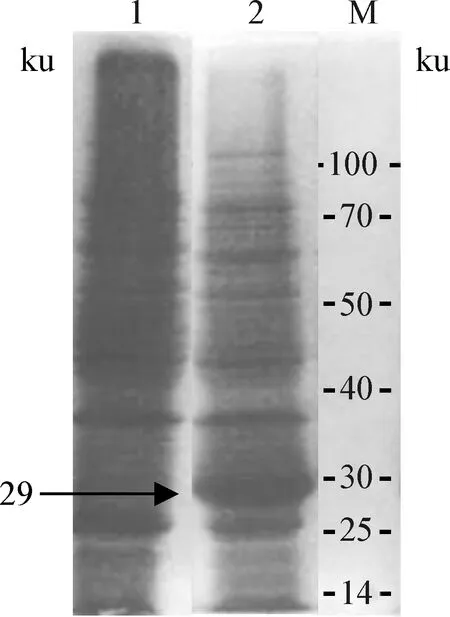
图3 STLV1-30蛋白的SDS-PAGE分析结果Fig.3 Results of STLV1-30 protein SDS-PAGE analysis1:空载体菌诱导对照;2:重组菌表达蛋白;M:蛋白分子量标准1:Vector control induced by bacteria;2:Expression protein of recombinant bacteria;M:Protein marker

图4 STLV1-30蛋白的纯化结果Fig.4 Results of STLV1-30 protein purificationM:蛋白分子量标准;1:切胶纯化后的重组表达蛋白STLV1-30M:Protein marker;1:Purified protein STLV1-30
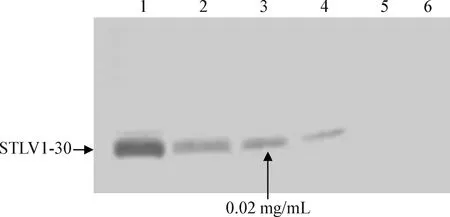
图5 重组STLV1-30蛋白抗原最佳包被量确定Fig.5 Determine the amount of STLV1-30 recombinant protein antigen1~6:STLV1-30蛋白包被浓度依次分别为2 mg/mL、0.2 mg/mL、0.02 mg/mL、2 μg/mL、200 ng/mL、20 ng/mL和2 ng/mL1~6:STLV1-30 protein coating concentration,2 mg/mL,0.2 mg/mL,0.02 mg/mL,2 μg/mL,200 ng/mL,20 ng/mL and 2 ng/mL,respectively
2.7 重组STLV1-30蛋白抗原特异性分析 特异性分析结果如图6所示,STLV1-30蛋白能够特异性地识别STLV1阳性血清而不与其他参考的猴病毒阳性血清发生交叉反应,说明了STLV1-30抗原具有良好的特异性。
2.8 重组STLV1-30蛋白抗原敏感性分析 敏感性分析结果如图7所示,STLV1-30能够敏感地检测到1∶200倍稀释的STLV1阳性血清,说明重组STLV1-30抗原敏感性良好。
2.9 STLV1抗体检测免疫梳的特异性检验 特异性验证结果如图8所示,STLV1抗体免疫梳均能够特异性检测到相应的STLV1阳性血清而不与其他病毒阳性血清间发生交叉反应,由此说明设计制备的STLV1免疫梳特异性良好。
2.10 STLV1抗体检测免疫梳的敏感性检验 敏感性验证结果如图9所示,STLV1抗体免疫梳的最大血清阳性检测稀释度为1∶400,说明了STLV1免疫梳敏感性良好达到了预期。

图8 STLV1抗体免疫梳的特异性检测结果Fig.8 Specificity of STLV1 antibody immune-comb assay+/-:1∶50 STLV1阳性/阴性血清抗体对照;1:抗猴1∶50 STLV1病毒阳性血清;2~6:抗猴1∶25的BV、SRV1、SIV、MeV病毒阳性血清对照和1∶25的STLV1病毒阴性血清对照;7~10:抗猴1∶50的BV、SRV1、SIV和MeV病毒阳性血清对照+/-:STLV1 positive/negative serum antibody control of 1∶50;1:STLV1 positive serum of 1∶50;2~6:BV/SRV1/SIV/MeV positive serum control of 1∶25 and STLV1 negative serum control of 1∶25;7~10:BV,SRV1,SIV and MeV positive serum control of 1∶50

图9 制备的STLV1抗体检测免疫梳的敏感性检验结果Fig.9 Sensitivity of STLV1 antibody immune-comb assay+/-:1∶50STLV1阳性/阴性血清抗体对照;1~9:1∶25/50/100/200/400/800/1 600/3 200/6 400倍稀释的抗STLV1阳性血清;10:空白对照+/-:STLV1 positive/negative serum antibody control of 1∶50;1~9:Diluted positive serum of STLV1 virus of 1∶25/50/100/200/400/800/1 600/3 200/6 400;10:Blank control
2.11 免疫梳重复性和稳定性 重复性和稳定性结果如表2所示,批间重复试验CV为 5.183 051%,小于6%,批内重复试验变异系数(CV)为6.666 667%,小于7%,说明免疫的重复性良好;稳定性结果,免疫梳的特异性与敏感性没有明显变化,对同一份样品平行作3次进行比较,CV为5.033 223%,小于6%,说明免疫梳的稳定性良好。
2.12 临床测试比较和应用结果 用制备的免疫梳与商品化的ELISA试剂盒对11只实验猴的STLV血清抗体进行对比检验分析,结果如表3所示,新建立的免疫梳(IC-猴STLV1-Ab)方法与参考的ELISA检测结果一致率为100.0%,Kappa=1.000,这说明建立的免疫梳(IC-猴STLV1-Ab)方法与商品化试剂盒结果完全一致,显示出良好的实用性和可靠性。
3 讨论
1992年,我国卫生部颁布的《医学实验动物标准》就已明确规定STLV是SPF实验猴必须排除的病毒。STLV1与人嗜T淋巴细胞病毒I型(Human T-lymphotropic virus 1,HTLV1)有很多相似性,核酸序列上同源性高达90%~95%。STLV1最初从亚洲和非洲猴体内分离到[2],受STLV1感染的非洲绿猴出现了与受HTLV感染的人相似的贫血症;人工繁殖猴和野生猴均可被STLV1感染,但无临床症状表现。STLV1的存在不仅影响猕猴的实验等级,而且对饲养人员和实验人员的健康也存在很大的隐患。李绍东等[3]对我国恒河猴的STLV1流行病学调查发现,我国野生和人工饲养的恒河猴的血清中普遍存在着STLV1抗体,因此对STLV1抗体的常规监测意义重大。免疫梳方法(Immune-comb assay,ICA)是一项新型抗体体外定性、定量检测技术,该方法简便、快捷、成本低、不需要贵重仪器等,适用于样品的快速初筛和野外现场实地检测,达到快速诊断的目的,能够满足口岸检疫快速通关的要求,在基层具养猴场也具有良好的运用推广前景。

表2 ICA重复性和稳定性试验Table 2 The repeatability and stability evaluation of the ICA

表3 临床测试结果Table 3 The results of clinical test
由于非人灵长类动物与人类的生物及行为特征相似,成为了医学研究中理想的动物模型,我国是灵长类实验动物重要出口基地之一。随着医学的不断进步,对用于试验的非人灵长类动物的质量要求也在不断提高,无特定病原体(SPF)猴的需求量逐年增加,STLV病毒是SPF猴必须排除的病原之一。目前,根据贸易合同要求或输入国家检疫要求或途经国家要求对进实验猴必须进行STLV1检测;另外,Hayami M等[9]对世界各地41种灵长类动物血清抗体的调查表明,在亚洲的猕猴中有较高的STLV-1抗体阳性率,其中恒河猴为20.4%,在猴群中进行STLV1血清抗体检测,是防止病毒传播流行的有效途径[10]。
目前,国内有很多学者致力于STLV1血清抗体检测方面的研究。季芳等[11]研制出了STLV1 双抗原夹心试剂盒,用人的HTLV1 env 蛋白作为诊断抗原,临床验证结果表明,存在一些假阳性反应或非特异反应。卢爱桃等[12]通过生物技术手段原核表达了STLV1的gag重组蛋白,作为诊断抗原建立了间接ELISA,检测效果良好。但是ELISA方法存在一些局限:每次仅能检测一种病毒抗体,如果需要同时检测多种病毒抗体时,则检测费用较为昂贵并且费时,完成检测所需的样本量较大,非常浪费,对于一些量少的样本就比较困难。美国VRL公司现已研制出对STLV1抗体进行检测的商品化检测试剂盒,虽然准确率较高,但价格非常昂贵且仅限于实验室使用,若对大量的实验猴的血清进行STLV病毒抗体的监测,国内实验猴养殖单位难以承受。ICA与传统玻片法及ELISA方法相比,特异性抗原的使用克服了玻片法所用抗原质量问题所导致的假阳性和假阴性问题;染色结束后的免疫梳结果直观,肉眼即可观察判断,无需用酶联免疫检测仪测定OD值,而且该免疫梳可以长期保存以便后期复查。该方法快速、简便、经济,不需任何特殊仪器,保留了常规ELISA的敏感、特异的优点,又克服了许多繁琐的操作,节省了操作时间,缩短了实验周期,完全可在野外进行实地诊断检测,达到快速诊断的目的,能够满足口岸机场、码头的快速通关检测,在基层具有良好的运用推广前景。
