猪繁殖与呼吸综合征病毒和猪鼻支原体双重PCR检测方法的建立
2020-10-21修晓娜李天芝于新友
修晓娜,李天芝,于新友
(1.中国农业大学烟台研究院,山东 烟台 264670;2.山东绿都生物科技有限公司,山东 滨州 256600)
猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)能感染猪引起猪繁殖与呼吸综合征(PRRS)[1]。PRRS临床表现主要为母猪繁殖障碍及生长猪呼吸道症状[2-4]。PRRSV感染猪后,导致猪免疫系统受损,形成免疫抑制,从而继发各种疾病,致猪死亡率增加[5]。猪鼻支原体(Mycoplasmahyorhinis,Mhr)感染猪后能引起猪肺炎、关节炎、多发性浆膜炎、中耳炎、结膜炎等多种疾病[6],3~10周龄仔猪多发[7],与其他猪病混合感染后,加重病情[8]。Mhr是猪鼻腔、气管、支气管黏液中的常在菌,10%母猪和40%断奶仔猪呼吸道黏液中均有该菌存在[9]。近年来,Mhr引起的疾病增加,对猪场危害严重[10-11]。Mhr和PRRSV常发生混合感染,导致猪发病严重[12]。有必要建立一种快速、准确、同时检测PRRSV 和Mhr的方法,以便及时采取合理措施进行科学防控。笔者根据PRRSVORF7和MhrP37基因序列设计引物,建立了同时检测2种病原的方法,并应用于临床病料检测,报告如下。
1 材料与方法
1.1 菌毒株及检测样品 猪繁殖与呼吸综合征病毒(PRRSV)、猪圆环病毒2型(PCV2)、伪狂犬病病毒(PRV)、猪瘟病毒(CSFV)、猪鼻支原体(Mhr)、猪胸膜肺炎放线杆菌(APP)、猪肺炎支原体(Mhp)、副猪嗜血杆菌(Hps)、猪链球菌(S.suis)由本实验室保存;大肠杆菌感受态DH5α,购自百泰克生物科技有限公司;临床检测样品为2018年1月-2018年11月采自鲁北地区猪场疑似PRRSV和Mhr感染的猪肺脏组织。
1.2 主要试剂 AxyPrep体液病毒核酸小量提取试剂盒,购自爱思进生物技术(杭州)有限公司;Premix Tag、PrimeScriptTMOne Step RT-PCR Kit Ver.2,购自宝生物工程(大连)有限公司;DNA Marker DL-2 000,购自百泰克生物科技有限公司;细菌基因组提取试剂盒、高纯质粒小量制备试剂盒和多功能DNA纯化回收试剂盒,均购自北京百泰克生物科技有限公司;pMD18-T载体,购自生工生物工程(上海)股份有限公司;LB液体培养基、1×TAE电泳缓冲液,均由本实验室配制。
1.3 引物的设计与合成 应用DNASTAR软件分别对GenBank中收录的PRRSVORF7基因和MhrP37基因序列进行分析比对后,分别设计1对特异性引物,引物由通用生物系统(安徽)有限公司合成,引物序列信息见表1。

表1 PCR引物Table 1 PCR Primer
1.4 病原核酸提取 分别吸取PRRSV、CSFV、PCV2、PRV共4种病毒液200 μL,按照病毒核酸提取试剂盒的说明书提取病毒核酸,最后用40 μL洗脱液洗脱。分别吸取Mhr、Mhp、APP、Hps、S.suis共5种菌液,按照试剂盒说明书提取细菌基因组DNA,最后用100 μL洗脱液洗脱,-20 ℃保存备用。
1.5 单项PCR检测方法的建立 首先用无核酸酶灭菌纯化水分别稀释引物PRRSV-F、PRRSV-R和Mhr-F、Mhr-R,使得其终浓度均15 μmol/L,分别以PRRSV-F和PRRSV-R为引物,PRRSV RNA为模板,Mhr-F和Mhr-R为引物,Mhr基因组DNA为模板,优化反应条件,建立了PRRSV和Mhr单项PCR检测方法。
1.6 双重PCR检测方法的建立 按照OneStep RT-PCR Kit Ver.2说明书进行反应体系的配制,总体系20 μL,其中2×1 Step Buffer 10 μL,PrimeScriptTMOne Step Enzyme Mix 0.8 μL,PRRSV RNA 1 μL,Mhr基因组DNA 1 μL,引物在反应体系中的加入量不断优化,并用水补充剩余体系,瞬时离心后,放入 PCR仪进行扩增反应,反应扩增程序为:反转录50 ℃ 30 min,预变性 95 ℃ 3 min,变性95 ℃ 25 s,退火55 ℃ 25 s,延伸72 ℃ 30 s,35个循环。分别采用48~60 ℃的退火温度(每次递增1 ℃)。筛选最佳引物加入量和最佳退火温度。
1.7 特异性试验 分别取PRRSV和Mhr核酸1.0 μL,混合后作为PCR反应模板,另取PRRSV、Mhr、CSFV、PCV2、PRV、Mhp、APP、Hps、S.suis核酸各2 μL。采用本试验建立的PRRSV和Mhr双重PCR方法进行扩增,反应结束后以1.5%琼脂糖凝胶电泳检测PCR产物,以确定所建方法的特异性。
1.8 敏感性试验 分别回收1.6中PRRSV和Mhr扩增产物234 bp和737 bp目的基因片段,连接pMD18-T载体后,转化大肠杆菌感受态DH5α,37 ℃过夜培养,挑取单菌落接种LB液体培养基,提取质粒后,并送测序公司进一步验证,测序正确后,紫外分光光度计测定质粒浓度以及纯度,作阳性标准品,分别作10倍倍比梯度系列,取相应稀释度等量混合,用优化后PCR检测方法进行双重PCR扩增,1.5%琼脂糖凝胶电泳PCR产物,确定方法的敏感性。
1.9 重复性试验 分别选取6份确定为PRRSV细胞毒和4份确定为Mhr培养液,提取核酸后,采用本试验建立的PRRSV和Mhr双重PCR进行检测,每种样品均重复3次,以确定方法的稳定性和重复性是否良好。
1.10 临床样品的检测 从鲁北地区猪场采集疑似PRRSV、Mhr感染病例的肺脏作为病料样品,共采集85份病料样品。病料样品处理后,提取总核酸,采用所建方法进行PRRSV和Mhr的检测,并同时进行单项PCR检测,比较检测结果。
2 结果
2.1 PRRSV和Mhr单项PCR检测方法的建立 PRRSV单项PCR的引物加入量为1.5 μL PRRSV-F(15 μmol/L)、1.0 μL PRRSV-R(15 μmol/L),反应程序为:反转录50 ℃ 30 min,预变性 95 ℃ 30 min,变性95 ℃ 15 s,退火54 ℃ 20 s,延伸72 ℃ 20 s,35个循环。Mhr单项PCR引物加入量为0.8 μL Mhr-F(15 μmol/L)、2.1 μL Mhr-R(15 μmol/L)。反应程序为:预变性 95 ℃ 30 min,变性95 ℃ 10 s,退火52 ℃ 20 s,延伸72 ℃ 30 s,35个循环。
2.2 双重PCR检测方法 通过不断优化反应体系中引物加入量和扩增反应程序,最终确定的PRRSV和Mhr双重PCR检测方法的最佳引物的加入量为1.2 μL PRRSV-F(15 μmol/L)、1.4 μL PRRSV-R(15 μmol/L)、0.6 μL Mhr-F(15 μmol/L)、1.8 μL Mhr-R(15 μmol/L)。优化后最佳的扩增反应程序为:反转录50 ℃ 30 min,预变性 95 ℃ 30 min,变性95 ℃ 15 s,退火53 ℃ 20 s,延伸72 ℃ 30 s,35个循环。
2.3 特异性试验 采用建立的双重PCR方法对PRRSV+Mhr、PRRSV、Mhr、CSFV、PCV2、PRV、APP、Mhp、Hps、S.suis核酸扩增,结果显示,PRRSV+Mhr可扩增2条特异性基因片段,大小约234 bp和737 bp,以单一的PRRSV核酸为模板时扩增出1条特异性基因片段,大小约234 bp,以Mhr DNA为模板时可扩增出约737 bp基因片段,而CSFV、PCV2、PRV、APP、Mhp、Hps、S.suis核酸,则无任何扩增条带,说明所建立的方法特异性好(图1)。
2.4 敏感性试验 分别根据PRRSV和Mhr质粒标准品浓度计算拷贝数,PRRSV和Mhr质粒拷贝数分别为4.2×1010拷贝/μL和1.8×1010拷贝/μL。PRRSV质粒稀释为4.2×109、4.2×108、4.2×107、4.2×106、4.2×105、4.2×104、4.2×103、4.2×102拷贝/μL和4.2×101拷贝/μL共9个不同的稀释度。Mhr质粒稀释为1.8×109、1.8×108、1.8×107、1.8×106、1.8×105、1.8×104、1.8×103、1.8×102拷贝/μL和1.8×101拷贝/μL共9个不同的稀释度,分别取108~101拷贝/μL的PRRSV和Mhr质粒标准品,同等稀释度等量混合后作为模板。用双重PCR方法进行扩增,结果显示,该法对PRRSV的最低检测限度为420 拷贝/μL,对Mhr的最低检测限度为180 拷贝/μL(图2),与单项PCR检测敏感性一致(图3,图4),表明所建方法具有很好的敏感性。

图1 特异性试验Fig.1 Specificity determinationM:DL-2 000 DNA相对分子量标准;1:PRRSV和Mhr;2:PRRSV;3:Mhr;4:CSFV;5:PCV2;6:PRV;7:APP;8:Mhp;9:Hps;10:S.suisM:DL-2 000 DNA Marker;1:PRRSV and Mhr;2:PRRSV;3:Mhr;4:CSFV;5:PCV2;6:PRV;7:APP;8:Mhp;9:Hps;10:S.suis
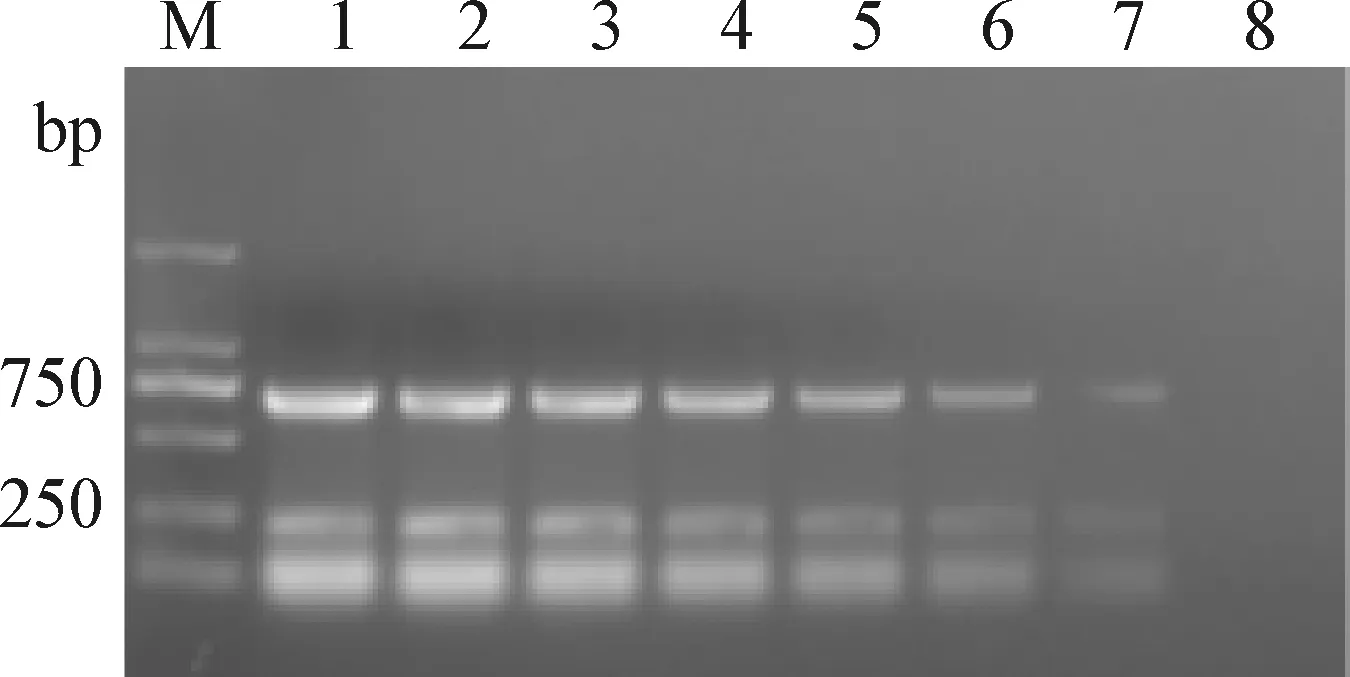
图2 双重PCR敏感性试验Fig.2 Sensitivity determination of the duplex PCRM:DL-2 000 DNA相对分子量标准;1~8:PRRSV和Mhr质粒标准品拷贝数分别为108~101 拷贝/μLM:DL-2 000 DNA Marker;1~8:The copies of PRRSV and Mhr plasmids were 108~101 copies /μL

图3 PRRSV单项PCR敏感性试验Fig.3 Sensitivity determination of PRRSV single PCRM:DL-2 000 DNA相对分子量标准;1~8:PRRSV质粒标准品拷贝数分别为108~101 拷贝/μLM:DL-2 000 DNA Marker;1~8:The copies of PRRSV plasmids were 108~101 copies /μL
2.5 重复性试验 用核酸提取试剂分别提取6份 PRRSV细胞毒和4份Mhr培养液核酸,以所建立的双重PCR检测方法检测,并重复3次,结果显示,3次结果一致,均为阳性,表明所建方法稳定性好。
2.6 临床样品的检测 对采集的85份临床疑似PRRSV、Mhr感染肺脏样品,分别用PRRSV和Mhr双重PCR进行检测,并且每份核酸同时做PRRSV单项PCR、Mhr单项PCR检测,检测结果分析,双重PCR和单项PCR的检测结果一致,符合率为100%,共检测PRRSV阳性样品25份,Mhr阳性样品13份,其中6份为PRRSV和Mhr混合感染样品(表2),表明所建立的双重PCR检测PRRSV和Mhr效果好,可用于临床样品的检测。

图4 Mhr单项PCR敏感性试验Fig.4 Sensitivity determination of Mhr single PCRM:DL-2 000 DNA相对分子量标准;1~8:Mhr质粒标准品拷贝数分别为108~101 拷贝/μLM:DL-2 000 DNA Marker;1~8:The copies of PRRSV plasmids were 108~101 copies /μL

表2 单项PCR与双重PCR检测对比试验结果Table 2 The results of single PCR and double PCR detection comparative test
3 讨论
自2006年高致病性PRRSV暴发以来,PRRS成为影响我国养猪业发展的重要疾病之一[13]。随着疫苗的广泛应用,猪场PRRSV每年都在发生变异,但发生变异的基因主要是NSP2基因[14],当前猪场呈现PRRSV多毒株共存的局面,PRRSV的防控工作变得更复杂[15]。本试验根据PRRSV变异小的ORF7基因设计引物,能覆盖猪场各种类型PRRSV毒株,避免漏检。PCR检测为PRRSV阳性时并不能说明猪场暴发PRRS,要得出可靠的结果还需要根据猪场PRRS疫苗的免疫情况和猪场的状态,有时还需要配合病理切片,才能做出科学的判断。不同PRRS疫苗有不同带毒和排毒期,当猪场不稳定,猪群有PRRS相关症状和病变,同时PCR检测为PRRSV核酸阳性时,可以按PRRS暴发采取相应紧急防控措施。
猪支原体病主要由肺炎支原体、滑液支原体和Mhr等3种支原体引起[16],3种支原体间交叉保护性差。目前猪肺炎支原体有商品化的灭活疫苗和活疫苗,在猪肺炎支原体病的防控中发挥了很好的作用。滑液支原体主要影响大猪,发生关节病变,一般不会致死猪,Mhr可导致猪呼吸道疾病,1~3月龄猪多发,没有疫苗预防[17],因此,猪场必须重视。对Mhr引起的疾病,虽可用林可霉素、大环内酯类药物治疗,但容易产生耐药性,效果不理想[18]。只能采取综合性防控措施,如加强饲养管理,提高猪只机体抗病力。饲喂优质饲料,禁止喂霉变饲料。猪舍做好保温和通风工作,保持猪舍清洁卫生,做好消毒工作,定期通风、降低氨气浓度、减少饲养密度、减少应激以降低Mhr相关疾病发病率和病情的严重程度。
笔者根据PRRSVORF7基因和Mhr最为保守的种属基因P37基因,分别设计1对特异性引物,优化体系中引物加入量和反应程序,首次建立了PRRSV和Mhr双重PCR检测方法,对PRRSV和Mhr的最低检测限度分别为420 拷贝/μL和180 拷贝/μL,与单项PCR检测,敏感性一致,说明同一体系中扩增2种病原并未产生严重抑制作用,具有较高的灵敏性,大大简化了操作步骤,节约了时间,提高了检测效率。在病料检测中有一些创新,更加实用,按以往的观念需要PRRSV提取RNA、猪支原体提取DNA,并分开进行扩增,操作非常繁琐,不但需要提取2种核酸,扩增时还需要分开加样,分开扩增,需要时间长,或同时占用2台PCR仪器。而笔者进行了创新,病料研磨后,1 000 r/min低速离心,保证大的组织块下沉,而上清内含病毒和支原体,后用吸附柱式法同时提取PRRSV和Mhr核酸,配合小型高速离心机,操作简便,半小时内即能提完核酸,提取的核酸质量较高,能达到PCR反应的质量要求,不存在PCR反应抑制物,且所有试剂均能常温保存和运输。通过对85份临床疑似病料样品检测结果显示,所建立的PRRSV和Mhr双重PCR和单项PCR结果一致,符合率为100%,说明所建方法检测临床样品效果好。下一步笔者打算将除模板外试剂冻干,适合常温保存和运输,使用时只要加入灭菌水和模板即能进行扩增反应,进一步简化加样步骤,使得病原检测更便捷。
