特布他林联合噻托溴铵对慢性阻塞性肺疾病患者HIF1、γ-GCS水平的影响
2020-10-20王莉汪诚叶盛冯起甲蒋鹏
王莉,汪诚,叶盛,冯起甲,蒋鹏
慢性阻塞性肺疾病(COPD)是一种慢性呼吸系统疾病,具有较高的发病率与病死率,严重威胁人们身心健康,患者肺功能呈进行性减退,导致患者日常生活质量与劳动力明显降低[1]。缓解期COPD是其发展的主要阶段,改善患者肺功能、预防急性发作,是目前临床对COPD治疗的主要原则,由于多发于老年人群,病情迁延且易反复发作[2]。特布他林是一类短效β2受体激动剂,作用于小气道β2肾上腺素受体,可降低气道高反应性及减轻呼吸道痉挛,舒张支气管平滑肌[3]。噻托溴铵可改善COPD患者运动耐力,有助于改善患者临床症状,是临床上治疗COPD患者的主要药物之一[4]。现观察特布他林联合噻托溴铵对COPD患者低氧诱导因子-1(HIF1)、γ-谷氨酰半胱氨酸合酶(γ-GCS)水平的影响,报道如下。
1 资料与方法
1.1 临床资料 选取2018年1月—2019年5月南京医科大学附属南京明基医院呼吸科收治的COPD患者120例作为研究对象,按照随机数字表法分为噻托溴铵组、联合用药组,每组60例。噻托溴铵组男39例,女21例,年龄43~75(56.1±12.3)岁;病情程度:轻度12例,中度32例,重度16例;发病诱因:吸烟24例,环境因素25例,呼吸道家族病史11例。联合用药组男33例,女27例,年龄44~73(55.6±10.9)岁;病情程度:轻度10例,中度31例,重度19例;发病诱因:吸烟27例,环境因素24例,呼吸道家族病史9例。2组患者一般资料比较差异无统计学意义(P>0.05),具有可比性。本次研究经医院伦理委员会批准,患者及家属知情同意并签署同意书。
1.2 选择标准 (1)纳入标准:均符合2013年“慢性阻塞性肺疾病诊治指南”中相关诊断标准[5];胸部X线出现肺纹理紊乱、增粗等非特异性改变;胸部CT可见小气道发生明显病变。(2)排除标准:合并其他慢性呼吸系统疾病;合并严重心脑血管系统、肝肾、内分泌及造血系统疾病;合并睡眠呼吸障碍;有心理疾病与精神障碍;严重的免疫缺陷与免疫系统疾病。
1.3 治疗方法 2组患者均常规控制咳嗽、祛痰及平喘等对症治疗。噻托溴铵组在常规治疗的基础上给予噻托溴铵(Boehringer Ingelheim Pharma GmbH & Co. KG),每次吸入18 μg, 1次/d。联合用药组在噻托溴铵组的基础上予特布他林(AstraZeneca AB)2.5 mg,加入0.9%氯化钠注射液10 ml中压缩雾化吸入,15 min/次,2次/d。2组治疗疗程均为4周。
1.4 观测指标与方法
1.4.1 血清γ-GCS及HIF1水平检测:治疗前、治疗4周后清晨空腹采集患者肘静脉血5 ml,置于一次性真空无抗凝剂的采血管中。在20~25℃环境下凝血60 min,之后离心获得血清,-20℃环境中保存。采用VT900A气流分析仪以双抗体夹心法检测γ-GCS、酶联免疫吸附试验检测HIF1水平。
1.4.2 肺功能检测:治疗前后采用日本CHESTGRAPH肺功能检测仪检测FEV1/FVC、FEV1及FVC水平。
1.4.3 血氧检测: 上述血液采用VT900A气流分析仪(北京康高特仪器设备有限公司)检测PaCO2、PaO2水平。
1.4.4 炎性因子检测:上述血清采用酶联免疫吸附试验检测CRP、TNF-α水平。
1.4.5 不良反应:统计2组患者出现便秘、眩晕、心悸及胃肠障碍等不良反应发生率。
1.5 临床疗效评价标准[6]:显效,患者痰液量明显减少,肺部啰音明显减少,气促、咳嗽与咯痰的临床症状明显改善;有效,痰液量较多但很稀薄,肺部啰音减少,气促、咳嗽与咯痰的临床症状有所好转;无效,患者未达到以上标准。总有效率=(显效+有效)/总例数×100%。

2 结 果
2.1 2组临床疗效比较 治疗后,联合用药组总有效率为93.33%,高于噻托溴铵组的78.33%(P<0.05),见表1。
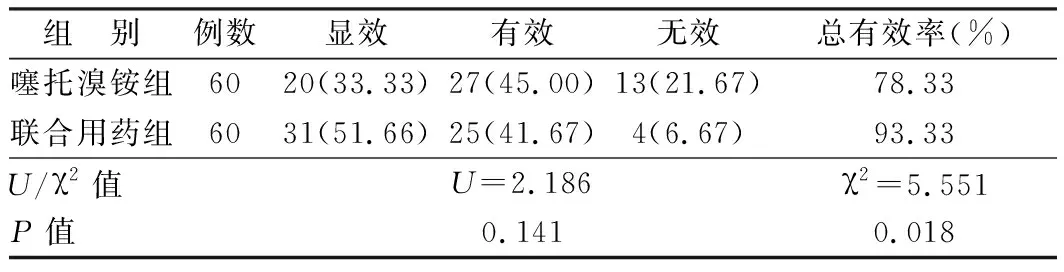
表1 2组患者临床疗效比较 [例(%)]
2.2 2组治疗前后血清γ-GCS及HIF1表达水平比较 治疗前2组患者γ-GCS及HIF1表达比较,差异无统计学意义(P>0.05);治疗4周后2组均降低,且联合用药组低于噻托溴铵组(P<0.05),见表2。
2.3 2组治疗前后FEV1/FVC、FEV1及FVC水平比较 治疗前2组患者FEV1/FVC、FEV1及FVC水平比较,差异无统计学意义(P>0.05);治疗4周后2组患者FEV1/FVC、FEV1及FVC水平升高(P<0.01),且联合用药组高于噻托溴铵组(P<0.05),见表3。

表2 2组患者治疗前后血清γ-GCS及HIF1水平比较

表3 2组患者治疗前后FEV1/FVC、FEV1及FVC水平比较
2.4 2组治疗前后PaCO2、PaO2水平比较 治疗前2组患者PaCO2、PaO2水平比较,差异无统计学意义(P>0.05);治疗4周后2组患者PaCO2均降低,PaO2均升高,且联合用药组降低/升高幅度大于噻托溴铵组 (P<0.01),见表4。

表4 2组患者治疗前后PaCO2、PaO2水平比较
2.5 2组治疗前后血清CRP、TNF-α水平比较 治疗前2组患者CRP、TNF-α水平比较,差异无统计学意义(P>0.05);治疗4周后2组均降低,且联合用药组低于噻托溴铵组(P<0.01),见表5。

表5 2组患者治疗前后血清CRP、TNF-α水平比较
2.6 2组不良反应发生率比较 治疗后,联合用药组治疗不良反应发生率为15.00%,高于噻托溴铵组的6.67%,但差异无统计学意义(χ2=2.157,P=0.142),见表6。
3 讨 论
慢性阻塞性肺疾病高发病率与病死率是世界上最严重的公共问题,其持续发作会导致患者的生活质量与肺功能下降[7]。其病理基础为慢性气道炎性反应所引起的气道壁结构重塑、修复与损伤,主要以持续存在的气流受限为特征[8]。COPD是由多种炎性介质与细胞因子介导并且相互作用的一种疾病,其临床主要表现为气短、慢性咳嗽、呼吸困难与咯痰等,严重影响患者的生活质量,可出现多种并发症,甚至危及患者生命,临床上主要治疗方法为药物治疗[9]。COPD的发生与发展过程中气道慢性非特异性炎性反应起到重要的作用,其最主要的治疗措施是改善肺功能与呼吸功能,减轻炎性反应[10]。COPD的主要发病机制与氧化应激反应、肺血管炎性反应、免疫反应及肺实质具有紧密联系,引发各种程度肺功能障碍,导致患者呼吸受阻,严重影响正常生活与免疫力[11]。
本研究结果显示,特布他林联合噻托溴铵明显改善FEV1/FVC、FEV1及FVC水平。噻托溴铵为长效抗胆碱药物,可改善患者肺功能,可以抗炎,同时可调节支气管痉挛[12]。特布他林可舒张支气管平滑肌,抑制内源性的致痉挛物质释放,及时调节血液微循环,改善通气,提升支气管黏膜纤毛上皮廓清能力,纠正低氧血症。γ-GCS是COPD中最重要的抗氧化酶,其水平能够反映机体细胞抗氧化能力,受GSH反馈调节,是抗氧化剂GSH生物合成限速酶[13]。本研究中,联合用药组可降低PaCO2、γ-GCS水平,升高PaO2水平。相关研究表明,COPD患者肺组织内存在氧化应激,参与局部抗氧化作用,通过促进抗氧化剂GSH合成增加,氧化应激诱导抗氧化酶γ-GCS代偿性上调,本研究结果与其保持一致[14]。CRP是一种肝脏合成的急性时相反应蛋白,是系统炎性反应有效的标志物[15]。TNF-α是一种炎性反应发生的诱导因子,可激活中性粒细胞,释放大量蛋白酶、氧自由基,造成肺组织损伤,可诱导血管内皮细胞表达黏附因子[16]。HIF1是一种调节氧稳态的核心转录因子,是低氧条件下维持细胞氧稳态相关的关键因子,其在患者肺组织中高表达,可促进气道内黏液高分泌,还可促进趋化因子释放,介导气道炎性反应与气道重构[17-18]。本研究结果显示,特布他林联合噻托溴铵显著降低患者炎性反应。

表6 2组患者不良反应发生率比较 [例(%)]
特布他林可起到气道平滑肌松弛效果,有助于促进机体β2受体兴奋,提升患者肺功能,具有抑制嗜酸性细胞与促嗜酸性细胞凋亡的作用,使患者呼吸困难、肺过度充气等症状显著改善[19]。噻托溴铵可选择性地对气道平滑肌M3受体进行阻断,对胆碱能形成强大的阻滞作用,发挥长效的支气管扩张效应。噻托溴铵在联合其他药物治疗的过程中降低神经张力,抑制副交感神经信号传递,促使气道松弛,提高肺泡通气量,提高治疗效果。
综上所述,特布他林联合噻托溴铵对COPD患者治疗效果显著,能够显著降低血清HIF1、γ-GCS水平,改善患者肺功能,值得推广。
利益冲突:所有作者声明无利益冲突
作者贡献声明
王莉:设计研究方案,实施研究过程,论文撰写;汪诚:提出研究思路,分析试验数据,论文审核;叶盛:实施研究过程,资料搜集整理,论文修改;冯起甲:进行统计学分析;蒋鹏:课题设计,论文撰写
