消岩汤抑制WISP2/CCN5基因敲减的MCF-7细胞增殖的分子机制*
2020-10-15吕艳张畅李小江郑旭韩燕燕高珊李翀耿强
吕艳, 张畅, 李小江, 郑旭, 韩燕燕, 高珊, 李翀, 耿强
天津中医药大学第一附属医院 1病理科, 3肿瘤科, 4实验中心(天津 300381); 2天津中医药大学研究生院(天津 301608)
乳腺癌是全球最常见的女性恶性肿瘤,我国乳腺癌发病率已居女性恶性肿瘤首位[1],探索乳腺癌发生和进展机制对乳腺癌治疗具有重大意义。消岩汤是天津中医药大学第一附属医院院内制剂,是在“解毒祛瘀,扶正抗癌”的治则基础上,依据现代药理研制出的中药制剂。方剂以生黄芪、太子参为君药;蛇舌草、夏枯草、生牡蛎为臣药;郁金、姜黄为佐药;蜂房为使药。诸药合用,共奏清热解毒、扶正驱邪之功[2]。前期研究表明:消岩汤通过介导Wnt通路,上调凋亡因子表达,抑制肺腺癌细胞增殖和转移[3],并且,Wnt/CCN5通路调控WISP2 and β-Catenin抑制胃癌的发生和进展[4],WISP-2/CCN5(Wnt-1 induced secreted proteins-2, Wnt 诱导分泌蛋白2),具有诱导肿瘤细胞凋亡,抑制肿瘤细增殖的作用[5]。然而,消岩汤抑制乳腺癌细胞增殖的分子机制尚不明确,所以,2018年7月至2019年12月我们的研究采用高、中、低浓度消岩汤干预WISP2/CCN5基因敲减的MCF-7细胞,观察孵育不同时间段(24、36和48 h),细胞增殖抑制率的差异,以及WISP2/CCN5、Skp2和p27Kip1 mRNA和蛋白水平变化,探寻消岩汤抑制WISP2/CCN5基因敲降的乳腺癌细胞增殖的分子机制,探索消岩汤抑制细胞增殖与药物浓度和孵育时间的相关性。
1 材料与方法
1.1 细胞株 人乳腺癌细胞株MCF-7细胞购于江苏凯基生物技术股份有限公司。
1.2 实验药物 消岩汤颗粒剂为天津中医药大学第一附属医院院内制剂,由天津中医药大学第一附属医院药厂提供。主要成分有黄芪、太子参、夏枯草、生牡蛎、白花蛇舌草、蜂房、姜黄和郁金。
1.3 试剂 WISP2/CCN5 shRNA慢病毒质粒由北京合生基因生物技术有限公司合成提供。MTT细胞增殖及细胞毒性检测试剂盒购于北京索莱宝生物科技有限公司。Western blot相关试剂盒,总RNA提取试剂盒(离心柱型)、cDNA第一链合成试剂盒以及荧光定量SYBR Green PCR试剂盒购于天根生化科技(北京)有限公司。
1.4 方法
1.4.1 MCF-7细胞培养 用含10%灭活胎牛血清的DMEM[Dulbecco′s Modified Eagle Medium]、1×105U/L青霉素 和100 mg/L链霉素作为培养基,将 MCF-7细胞置于含5% CO2、37℃细胞培养箱内培养,每3 d传代1次。取对数生长期的细胞用于实验。
1.4.2 病毒转染构建WISP2/CCN5基因敲减的MCF-7细胞 设计3条针对目的基因WISP2/CCN5的小分子shRNA1、shRNA2和shRNA3),根据RT-PCR实验筛选有效干扰序列。设计空质粒的小分子shRNA4,未携带WISP-2 shRNA,作为空载组。碱基序列如表1所示。

表1 碱基序列
用高糖DMEM完全培养基稀释MCF-7细胞至(3~5)×104cell/mL,制成混悬液,并接种2 mL细胞到6孔板中。24 h后更换1 mL转染液,含有病毒浓度为1.38×108TU/mL(Transducing Units,转导单位)的WISP2/CCN5 shRNA慢病毒质粒15 μL,助转染剂200 μL以及高糖DMEM完全培养基875 μL。8 h后更换为高糖DMEM完全培养基,继续培养48 h,荧光显微镜下观察慢病毒转染效率。
1.4.3 消岩汤颗粒剂溶解液配制和溶解 称取消岩汤颗粒剂0.27 mg,溶于3 mL PBS中,并在40℃水浴锅中加热溶解,生物安全柜紫外线照射15 min,采用孔径0.22 μm的无菌过滤器过滤溶解液,获得浓度为0.09 μg/uL的消岩汤颗粒溶解液,倍比稀释后,制成浓度分别为0.045 μg/μL(原液∶稀释液之比=1∶2)和0.022 5 μg/μL(原液∶稀释液之比=1∶4)的消岩汤颗粒剂溶解液。
1.4.4 MTT法观察消岩汤对MCF-7细胞增殖的抑制作用 收集对数生长期MCF-7细胞和WISP2/CCN5敲减的MCF-7细胞,调整细胞悬液浓度,分于96孔板。在5% CO2的37℃孵育箱中培养24 h后,共分4组,分组处理如下:空白组(MCF-7细胞),空载组和WISP2/CCN5基因敲减组,均加入100 μL DMEM培养基,每组设置6个平行孔;消岩汤干预WISP2/CCN5基因敲减的MCF-7细胞组:在另行培养的WISP2/CCN5基因敲减的MCF-7细胞中分别加入100 μL高浓度(0.09 μg/μL),中浓度(0.045 μg/μL)和低浓度(0.022 5 μg/μL的消岩汤颗粒剂溶解液,3个浓度各6个平行孔,共18孔。复制3块相同的细胞培养板,在5%CO2,37℃孵育箱中分别培养24、36 和48 h后,采用460 nm/480 nm分光光度计进行细胞增殖活性检测,计算细胞增殖抑制率。计算公式如下:细胞增殖抑制率=1-干预组OD值/对照组OD值。
1.4.5 荧光定量RT-PCR法检测相关因子mRNA水平 分组处理、收集细胞悬液。提取总RNA,进行gDNA去除反应,反应体系如下:5×gDNA Buffer 2 μL,Total RNA,RNase-Free ddH2O补足反应体系至10 μL,42℃,3 min后,置于冰上。RT(Reverse Transcription,逆转录反应),体系如下: 10×King RT Buffer 2 μL, Fast King RT Enzyme Mix 1 μL,FQ-RT Primer Mix 2 μL,RNase-Free ddH2O 补足反应体系至10 μL,并与gDNA去除反应体系混合,形成20 μL反应体系。PCR反应体系如下:SYBR Premix Ex Taq Ⅱ [Tli RNaseH Plus](2×)12.5 μL,Primer F [10 μmol/L] 1 μL;Primer R [10 μmol/L] 1 μL,cDNA 2 μL,dH2O 8.5 μL,反应体系25 μL。选择β-actin作为内参。引物序列如表2所示。

表2 引物序列
1.4.6 采用Western blot检测相关因子蛋白水平 分组处理、收集细胞悬液,加入1 mL蛋白裂解液PMSF裂解细胞,裂解20~30 min。取上清液,BCA法测蛋白浓度,每个样品蛋白终浓度均调整为2 μg/μL,100℃加热5 min后上样、电泳,经15% SDS-PAGE电泳后转PVDF 膜 90 min, WISP2/CCN5 (稀释比例1∶1 000),Skp2(稀释比例1∶500)和p27Kip1(稀释比例1∶150)各1 mL,4℃过夜,二抗[稀释比例1∶500],室温孵育2 h,漂洗、发显影和成像。以β-actin检测作为内对照。

2 结果
2.1 消岩汤抑制WISP2/CCN5基因敲减的MCF-7细胞增殖,并与消岩汤浓度和作用时间相关 采用高、中、低浓度消岩汤孵育WISP2/CCN5基因敲减的MCF-7细胞后,细胞增殖数量和融合度有不同程度下降,并且,浓度0.09 μg/μL,孵育48 h的细胞增殖抑制最显著。见图1。MTT实验数据显示(图2),WISP2/CCN5基因敲减组增殖抑制率低于空白组和空载组,即:WISP2/CCN5基因敲减组细胞增殖能力高于空白组和空载组(P<0.05)。消岩汤干预WISP2/CCN5基因敲减组的增殖抑制率高于WISP2/CCN5基因敲减组(P<0.05),即:消岩汤干预WISP2/CCN5基因敲减组的细胞增殖能力低于WISP2/CCN5基因敲减组。空白组和空载组与消岩汤干预WISP2/CCN5基因敲减组的增殖抑制率差异无统计学意义(P>0.05)。高浓度消岩汤(0.09 μg/μL)孵育48 h组的增殖抑制率显著高于24 h组(P<0.05);中浓度消岩汤(0.045 μg/μL)孵育36 h的增殖抑制率与24 h组和48 h组差异无统计学意义(P>0.05);低浓度消岩汤(0.022 5 μg/μL)孵育48 h组与36、24 h组的增殖抑制率差异无统计学意义(P>0.05)。高浓度消岩汤(0.09 μg/μL)孵育48 h组的增殖抑制率显著高于低浓度(0.022 5 μg/μL)(P<0.05);消岩汤孵育36 h,高、中、低浓度之间差异无统计学意义(P>0.05);消岩汤孵育24 h,高、中、低浓度之间差异无统计学意义(P>0.05)。高浓度(0.09 μg/μL)孵育48 h组的细胞增殖活性抑制最显著,所以,采用该组测定消岩汤在mRNA水平和蛋白水平对WISP2/CCN5,Skp2和p27Kip1的调控作用。
2.2 消岩汤在mRNA水平对WISP2/CCN5、Skp2和p27Kip1的调控作用WISP2/CCN5基因敲减组的Skp2mRNA水平高于空白组和空载组(P<0.05),p27Kip1低于空白组和空载组(P<0.05)。消岩汤干预WISP2/CCN5基因敲减的MCF-7细胞组的Skp2mRNA水平低于WISP2/CCN5基因敲减组(P<0.05),p27Kip1mRNA水平高于WISP2/CCN5基因敲减组(P<0.05)。见表3。
2.3 消岩汤在蛋白水平对WISP2/CCN5、Skp2和p27Kip1的调控作用 与空白组和空载组相比,WISP2/CCN5基因敲减组Skp2蛋白电泳条带灰度较深,p27Kip1蛋白电泳条带较浅。与WISP2/CCN5基因敲减组相比,消岩汤干预组的WISP2/CCN5蛋白和p27Kip1蛋白电泳条带灰度较深,Skp2蛋白电(表4)显示:与空白组和空载组相比,WISP2/CCN5基因敲减组的Skp2蛋白水平升高(P<0.05),p27Kip1蛋白水平下降(P<0.05)。与WISP2/CCN5基因敲减组相比,消岩汤干预组的WISP2/CCN5和p27Kip1蛋白水平升高(P<0.05),Skp2蛋白水平下降(P<0.05)。
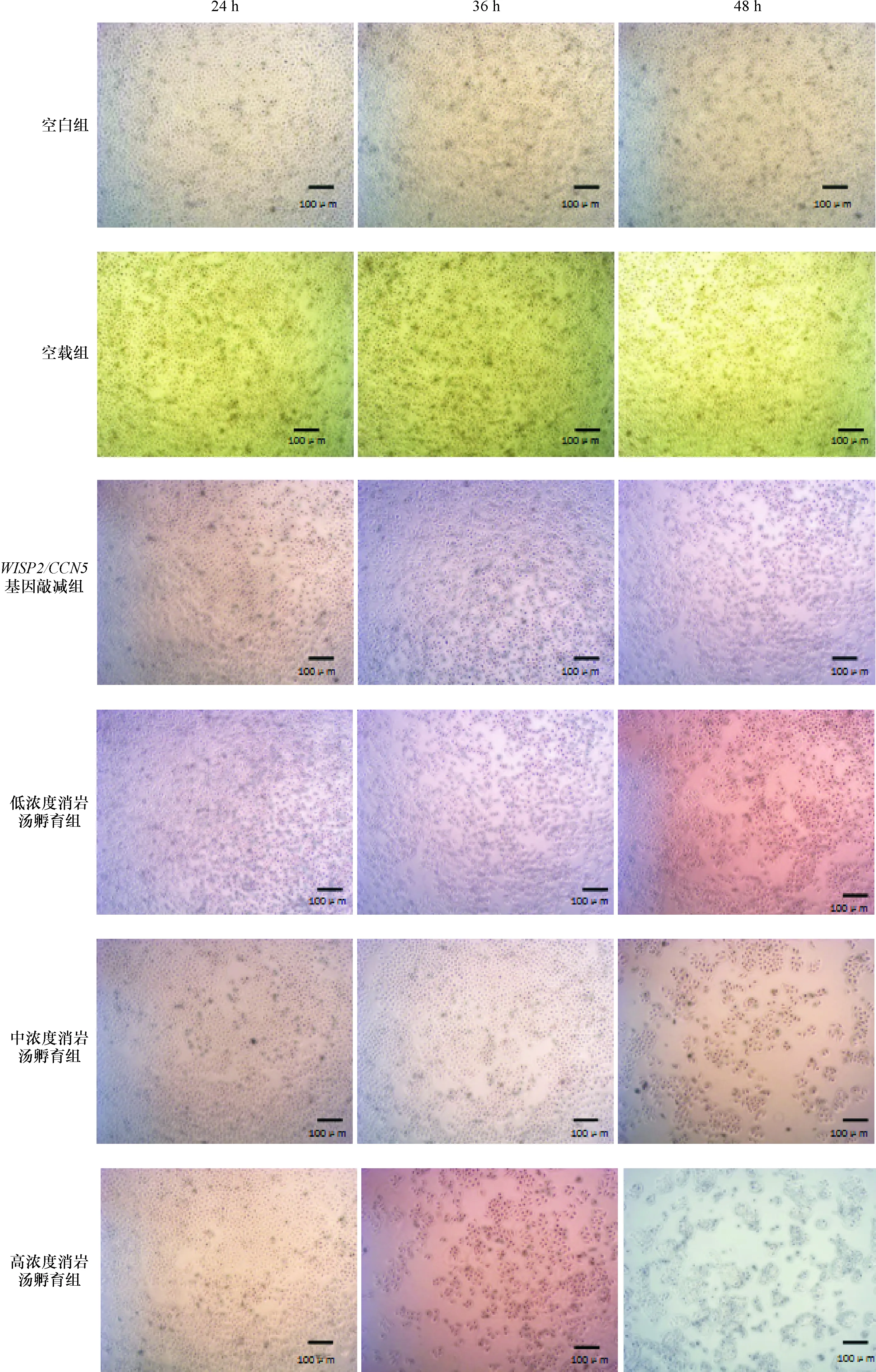
图1 不同浓度消岩汤孵育WISP2/CCN5基因敲减的MCF-7细胞不同时段细胞增殖图像(×40)

图2不同浓度消岩汤孵育WISP2/CCN5基因敲减的MCF-7细胞不同时间段对细胞增殖的影响泳条带灰度较浅。见图3。蛋白电泳图灰度分析结果
3 讨论
首先,我们采用慢病毒载体携带小片段RNA干扰WISP2/CCN5基因mRNA转录,建立WISP2/CCN5基因敲减的MCF-7细胞系,通过MTT法检测细胞增殖活性变化,比较WISP2/CCN5基因敲减的MCF-7细胞系与空白组的增殖活性,从而证实WISP2/CCN5基因敲减导致MCF-7细胞增殖活性提升,这提示:WISP2/CCN5基因稳定对MCF-7细胞增殖具有重要抑制作用。有研究证实:WISP2/CCN5基因具有抑制食管癌细胞增殖、侵袭作用,并强调WISP2/CCN5基因缺失与食管癌发生有密切关联[6]。近年来,WISP2/CCN5基因缺失与乳腺癌发生的相关性受到越来越多的关注,曾有研究探索了WISP2/CCN5基因异常与乳腺癌激素受体水平的相关性,推测该基因可能是早期乳腺癌的监测基因之一[7]。
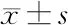

组别WISP2/CCN5Skp2P27Kip1CT值相对值CT值相对值CT值相对值消岩汤干预组1.26±0.0121.58±0.0180.33±0.0280.36±0.0321.45±0.0131.69±0.015WISP2/CCN5基因敲减组0.46±0.0110.54±0.0141.61±0.0251.75±0.0230.60±0.0230.73±0.020空载组1.04±0.0171.19±0.0130.67±0.0150.81±0.0121.08±0.0111.28±0.016空白组1.11±0.0141.24±0.0160.67±0.0150.77±0.0151.10±0.0211.33±0.024

图3Westernblot电泳图检测消岩汤干预WISP2/CCN5基因敲减的MCF-7细胞对WISP2/CCN5、Skp2和p27Kip1蛋白表达的影响
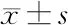

组别WISP2/CCN5Skp2P27Kip1CT值相对值CT值相对值CT值相对值消岩汤干预组1.26±0.0121.58±0.0180.33±0.0280.36±0.0321.45±0.0131.69±0.015WISP2/CCN5基因敲减组0.46±0.0110.54±0.0141.61±0.0251.75±0.0230.60±0.0230.73±0.020空载组1.04±0.0171.19±0.0130.67±0.0150.81±0.0121.08±0.0111.28±0.016空白组1.11±0.0141.24±0.0160.67±0.0150.77±0.0151.10±0.0211.33±0.024
其次,本研究证实:消岩汤在mRNA和蛋白水平促进WISP2/CCN5表达,进而下调Skp2和上调p27Kip1表达,提示:消岩汤可能通过调控Skp2和p27Kip1,抑制WISP2/CCN5基因敲减的乳腺癌细胞增殖,并且,对细胞增殖的抑制程度与消岩汤浓度和孵育时间呈正相关,即:消岩汤浓度相同时,对孵育时间较长的细胞增殖抑制作用更显著,例如,浓度为0.09 μg/μL的消岩汤,孵育48 h组的细胞增殖抑制率高于24 h组(P<0.05)。孵育时间相同时,高浓度消岩汤组的细胞增殖抑制作用比低浓度消岩汤组显著,例如,消岩汤孵育48 h,高浓度(0.09 μg/μL)消岩汤的细胞增殖抑制率高于低浓度组(0.022 5 μg/μL)(P<0.05)。
前期研究表明,消岩汤有效抑制肺癌细胞增殖,改善患者生存质量,延长生存期[8]。临床观察结果显示:消岩汤可降低乳腺癌患者化疗不良反应和肿瘤标志物CA153水平,增加患者体重、提升机体免疫力[9]。这些研究从临床角度证实了消岩汤对乳腺癌增殖具有抑制作用,但是,相关的分子调控机制并不清楚。
WISP2/CCN5基因,又称为Wnt-1诱导的分泌蛋白2(Wnt-1 induced secreted proteins-2,WISP2)。有研究证实:消岩汤通过介导Wnt 通路,抑制肺癌细胞增殖,促进肺癌细胞凋亡[3,10],此外,Wnt/CCN5通路调控对胃癌的发生和进展也具有重要抑制作用[11],这些研究结果提示:消岩汤调控Wnt通路相关的WISP2/CCN5是肿瘤发生相关的分子机制研究领域的热点。
研究发现,Skp2降解多种细胞周期蛋白,该分子机制与多种肿瘤的发生、发展关系密切,包括乳腺癌[4,12-14]。例如:p27kip1被Skp2泛素化、降解,这保证细胞有丝分裂顺利通过G1/S期,细胞增殖正常进行[15]。当Skp2 蛋白高表达时,p27kip1 被过度降解,对细胞增殖失去抑制作用,导致乳腺导管上皮非典型增生和乳腺癌[16-17]。
总之,本研究证实:消岩汤上调WISP2/CCN5基因敲减的MCF-7细胞的WISP2/CCN5 mRNA和蛋白水平,下调Skp2mRNA和蛋白水平,上调p27Kip1的mRNA和蛋白水平,从而抑制细胞增殖,抑制程度与消岩汤浓度和孵育时间存在相关性。
有研究发现:WISP2/CCN5 通过Skp2和p27Kip1对三阴性乳腺癌增殖具有抑制作用[5],所以,WISP2/CCN5与激素受体ER/PR之间的相关性是需要进一步探讨的问题。
