hADSC对免疫性血小板减少性紫癜小鼠淋巴细胞免疫调节的实验研究*
2020-10-15肖建红刘泽林李君君张阳春
肖建红, 刘泽林, 李君君, 张阳春
1华中科技大学协和深圳医院血液科(广东深圳 518052); 2南华大学附属第一医院血液科(湖南衡阳 421001); 3深圳市宝安区人民医院骨科中心(广东深圳 518101)
免疫性血小板减少性紫癜(ITP)是一种以皮肤及黏膜出血为临床表现同时合并机体血小板水平下降为主要特征的自身免疫性出血性血液病,其病理机制尚不清楚[1]。目前,多数研究者将ITP的发病机制与免疫失衡联系起来,原因是机体产生针对自身的抗血小板抗体,使得网状内皮系统,特别是脾脏中的巨核细胞增殖、分化,单核巨噬细胞比例上升,免疫能力加强,从而导致外周血血小板寿命缩短、数量减低,继而引起全身皮肤、黏膜组织,甚至内脏的出血[1-3]。虽然近年来ITP的发病机制相关研究取得了一定进展,而在ITP的临床诊疗上仍无明显提升,目前还是依靠传统的免疫抑制制剂、激素和(或)脾次或全切除等为主的治疗方法,如停止治疗,其复发率较高,且使用过多的激素或免疫抑制剂又引起多种不良反应等并发症,同时远期疗效亦不理想,以上均是血液科医师面临的棘手问题[4]。现阶段,对ITP的治疗探索大部分基于先前的传统药物,其可能因并发症而被迫终止[5-7]。随着细胞免疫领域临床应用研究的深入,目前认为,ITP与T细胞免疫功能失调、T细胞各亚群比例失衡关系密切,维持适当的比例是T淋巴细胞在ITP等自身免疫性疾病的病理改变中发挥正向积极作用的基石[8-9]。干细胞移植治疗自身免疫性疾病是当前生命科学研究中的热点,研究发现间充质干细胞(MSCs)可抑制T、B淋巴细胞的激活和增殖,发挥免疫调节作用[10]。且体内、外研究均已证实以骨髓间充质干细胞(BMSCs)为代表的MSCs可注入同种异体或异种的宿主机体,并发挥免疫调节功能[10-11]。作为具有广泛来源的脂肪间充质干细胞(ADSCs),其具有BMSCs相同的多向分化潜能、免疫调节能力等特征;但外源性的ADSCs是否可恢复ITP患者的免疫功能、调节T细胞免疫目前国内外尚未见相关报道。因此,我们于2018年9月至2019年3月期间探究通过尾静脉移植人来源脂肪间充质干细胞(hADSCs)治疗ITP小鼠,流式细胞术检测移植后ITP小鼠外周血血小板、T及B各亚群细胞比例,评价其治疗效果,探讨可能的作用机制。
1 材料与方法
1.1 材料 SPF级Balb/C小鼠24只,体重为(20.4±2.5)g,4~8周龄,均为雌性。
1.2 主要试剂和设备 FCA(弗氏完全佐剂)产于Sigma公司,FICA(弗氏不完全佐剂)购于Sigma公司,辣根过氧化物酶标记的重组蛋白A(Protein A/HRP)购于北京博奥森生物公司,EDTA-Na2购于广州鼎国生物公司,小牛血清白蛋白来源于美国Sigma公司;小鼠CD3、CD4、CD8、CD19、CD25流式抗体和同型对比制剂购于美国Beckman Coulter公司;红细胞裂解液购于美国Beckman Coulter公司;Trizol购于美国Invitrogen公司。
全自动血细胞分析仪(美国Beckman Coulter公司);流式细胞仪(美国BD公司);CO2培养箱(美国Thermo公司);实验超净工作台Purifier classⅡbiosafety为美国公司Terra Universal产品;低温离心机(美国Beckman Coulter公司);ELX 808IU酶标仪(美国Bio-TEK公司),细胞离心机(Shandon公司产品)。
1.3 方法
1.3.1 hADSCs体外分离纯化、培养及扩增 经患者及其家属知情同意,单位伦理委员会批准,在严格无菌条件下,从层流手术室整形外科术中获取不再临床应用的人体脂肪组织,通过密度梯度离心和贴壁筛选法,对脂肪中hADSCs进行分离、体外培养及扩增。选取第5代(P5)hADSCs,通过流式细胞仪(FCM)检测hADSCs表面抗原标记物。
1.3.2 ITP模型制备、动物分组与细胞移植 将24只小鼠随机分为3组,即正常对照组、模型对照组及治疗组,每组8只,除正常组外,其余两组均按免疫法建模,按照100 μL/20 g小鼠腹腔注入1/4稀释的抗血小板血清,依次在第1、3、5、7、9、11、13天注射小鼠腹腔内进行建模。建模第8天,将hADSCs常规消化离心后,用不完全L-DMEM培养液重悬hADSCs,配成浓度为5×106·mL-1。治疗组小鼠分别经尾静脉输注hADSCs,输注的hADSC为1×106个(200 μL)。模型对照组小鼠输注等量的(200 μL)PBS。正常对照组小鼠不予任何处理。ADSCs输注后第6天(即末次注射APS 24 h后),对动物进行处死,获取标本,进行一系列检测。
1.3.3 检测指标及方法
1.3.3.1 血小板水平的检测 hADSC输注第0~6天,每天由尾静脉采血100 μL加入盛有100 μL 1% EDTA-Na2液体抗凝剂的EP管内,使血液与抗凝剂完全混匀,然后应用全自动血细胞分析仪进行血常规检测。
1.3.3.2 外周血T、B各亚群细胞比例的检测 于hADSC移植后第6天,由小鼠眼球取血,EDTA-Na2抗凝,FCM检测外周血T、B各亚群细胞比例。
1.3.3.3 CD19+B细胞检测 (1)取2支流式试管,作上标记,各取100 μL EDTA-Na2抗凝全血注入每个试管下端,防止接触管壁。(2)缓慢混匀,再逐一注入同型对照小鼠含IgG1/IgG2a溶液20 μL及抗CD3、CD19荧光单克隆抗体每个10 μL,25℃下避光保存20 min。(3)移出避光保存的试管,每个试管加入稀释成10倍的1×红细胞裂解液2 mL,混匀,常温避光10 min。等试管液体清亮后,离心机300g离心5 min,上清液丢弃。(4)每个试管加入PBS液2 mL,混匀,300g离心5 min,其上清液丢弃。然后加入PBS液0.5 mL混匀。避光保存于4℃,尽量1 h内上机检测;如无法按时检测,存放于4℃冰箱,2 d内上机检测。(5) 在FCM分析之前,两管常规FCM进行双染色荧光补偿和光流路质量调控,将设备各项指标控制在许可范围。实验时参照侧向(SSC)和前向(FSC)散射光信号值对免疫细胞群进行设门,采用Cell quest软件分析检测结果。
1.3.3.4 CD3+、CD8+T细胞检测 (1)取两支流式管,作上标记,各吸取100 μL EDTA-Na2加入每支试管底端,防止接触管壁。(2)缓慢混匀,逐一加20 μL同型对照含小鼠IgG1/IgG2a溶液和10 μL抗CD3、CD8荧光单克隆抗体,25℃条件下避光保存20 min。(3)移出试管,各管加入10倍2 mL稀释成1×红细胞裂解液,混匀,25℃避光10 min。等候管内液体清亮,300g离心5 min,丢弃上清液。(4)每管加入PBS液2 mL,混合均匀,300g离心5 min,丢弃上清液。然后加入PBS液0.5 mL混匀。避光保存于4℃,尽量1 h内上机检测;如无法按时检测,存放于4℃冰箱,2 d内上机检测。(5) 在FCM分析之前,两管常规FCM进行双染色荧光补偿和光流路质量调控,将设备各项指标在许可范围。实验时参照侧向(SSC)和前向(FSC)散射光信号值对免疫细胞群进行设门,采用Cell quest软件分析检测结果。
1.3.3.5 CD4+、CD4+CD25+Treg细胞检测 (1)取2支流式试管,做好标记,分别取100 μL EDTA-Na2抗凝全血加入每支试管底部,避免碰到管壁。(2)轻轻摇匀,依次加20 μL同型对照(Mouse IgG1/IgG2a)及抗CD4、CD25荧光单克隆抗体各10 μL,25℃避光保存20 min。(3)取出试管,每管加入10倍稀释了的1×红细胞裂解液2 mL,混合均匀,25℃避光10 min。待管内液体透亮,300g离心5 min,丢弃上清液。(4)每管加入PBS液2 mL,混合均匀,300g离心5 min,丢弃上清液。然后加入PBS液0.5 mL混匀。避光保存于4℃,尽量1 h内上机检测;如无法按时检测,加入含1%多聚甲醛的PBS 0.5 mL,存放于4℃冰箱,2 d内上机检测。(5)在FCM分析之前,两管常规FCM进行双染色荧光补偿和光流路质量调控,将设备各项指标控制在许可范围。实验时参照侧向(SSC)和前向(FSC)散射光信号值对免疫细胞群进行设门,采用Cell quest软件分析检测结果。
1.4 统计学方法 用SPSS 13.0统计软件,进行One-way ANOVA单因素方差分析,组间比较采用t检验,等级资料采用秩和检验,以P<0.05为差异有统计学意义。
2 结果
2.1 小鼠的一般状况 与模型对照组比较,治疗组治疗后小鼠的一般状况较模型对照组改善明显,进食量和活动量均有所增加;治疗组小鼠皮肤黏膜紫癜范围都有显著减少。模型对照组(造模1周、造模2周)、治疗组的小鼠体重均较正常对照组轻(P<0.05);造模2周后,治疗组小鼠的体重虽未达到正常,但较模型对照组小鼠体重有明显增加(P<0.05)。见表1。

时间正常对照组(n=8)模型对照组(n=8)治疗组(n=8)造模前19.94±0.6719.72±0.8719.82±0.89造模1周20.75±1.1019.43±0.47* 19.28±0.90*造模2周21.76±0.9218.82±0.95**20.08±0.95*△
注:与正常对照组比较*P<0.01,**P<0.001;△与模型对照组比较P<0.05
2.2 小鼠外周血血小板水平 与正常对照组比,模型对照组血小板数量明显降低(P<0.001);治疗组血小板数较模型对照组有所升高,但仍未达到正常水平,与正常对照组比差异有统计学意义(P<0.01)。在输注ADSCs后第5天血小板水平达到最高值,见表2。
表2各组小鼠外周血血小板水平的比较

时间正常对照组(n=8)模型对照组(n=8)ADSC治疗组(n=8)0 d976±101311±166328±1881 d1 001±90330±122346±1042 d951±173330±181413±99*3 d1 081±131279±98497±124**4 d899±154358±81597±117**5 d1 009±86351±106660±99**6 d989±179401±116578±85**
注:与模型对照组比较*P<0.05,**P<0.01
2.3 小鼠外周血T、B细胞比例 与正常对照组比较,模型对照组小鼠外周血CD3+、CD4+、CD4+CD25+、CD4+/CD8+比值下降(P<0.01);而CD8+、CD19+比例上升(P<0.01)。与模型对照组相比较,治疗组CD3+、CD4+、CD4+CD25+、CD4+/CD8+比例均上升,而CD8+、CD19+比例下降(P<0.01),但未至正常值。见表3和图1~3。

项目正常对照组(n=8)模型对照组(n=8)治疗组(n=8)CD3+(%)68.78±4.6455.09±2.62*62.42±3.12*△CD4+(%)60.37±1.5444.18±4.86*52.48±3.82*△CD8+(%)7.85±0.5213.75±1.70*9.35±0.31*△CD4+CD25+(%)5.23±0.252.33±0.32*4.39±0.32*△CD19+(%)20.22±1.8840.06±1.46*24.74±2.67*△CD4+/CD8+7.57±0.333.05±0.46*5.63±0.50*△
注:*与正常对照组比较P<0.01;△与模型对照组比较P<0.01
3 讨论
ITP是一种血液科常见的自身免疫性出血性疾病,该病与T细胞免疫功能失调、T细胞各亚群比率失衡关系密切[9]。各个亚群维持适当的比例是T淋巴细胞发挥积极作用的基石,T 淋巴细胞亚群比例的紊乱在ITP等自身免疫性疾病的病理病机中起着关键作用[8-9]。基于细胞免疫领域临床应用研究的不断深入,目前ITP的相关研究取得了很大进步,然而临床治疗手段仍然依赖于传统的皮质类激素和免疫抑制药物、手术脾切除等治疗方法为主,其导致多种不良反应、疗效差等问题仍然无法解决[4,12]。干细胞移植治疗自身免疫性疾病是当前生命科学研究中的热点。MSCs起源中、外胚层的初期,是干细胞团队中的非常关键的一份子[13]。研究显示,MSCs在体内、外均能发挥免疫调节作用,其可以抑制T、B淋巴细胞的激活和增殖,还可能影响树突状细胞(DC)的成熟等[10]。体内、外研究均已证实BMSCs可以注入具备免疫功能的同种异体或异种的宿主机体,且在受体体内发挥免疫调节功能[10-11]。虽然其具体机制仍未明,但当前大多数学者提出,BMSCs或许通过接触受体免疫细胞、亦或非直接接触影响(由调节免疫细胞表达一系列炎性因子)发挥效应[11,14]。
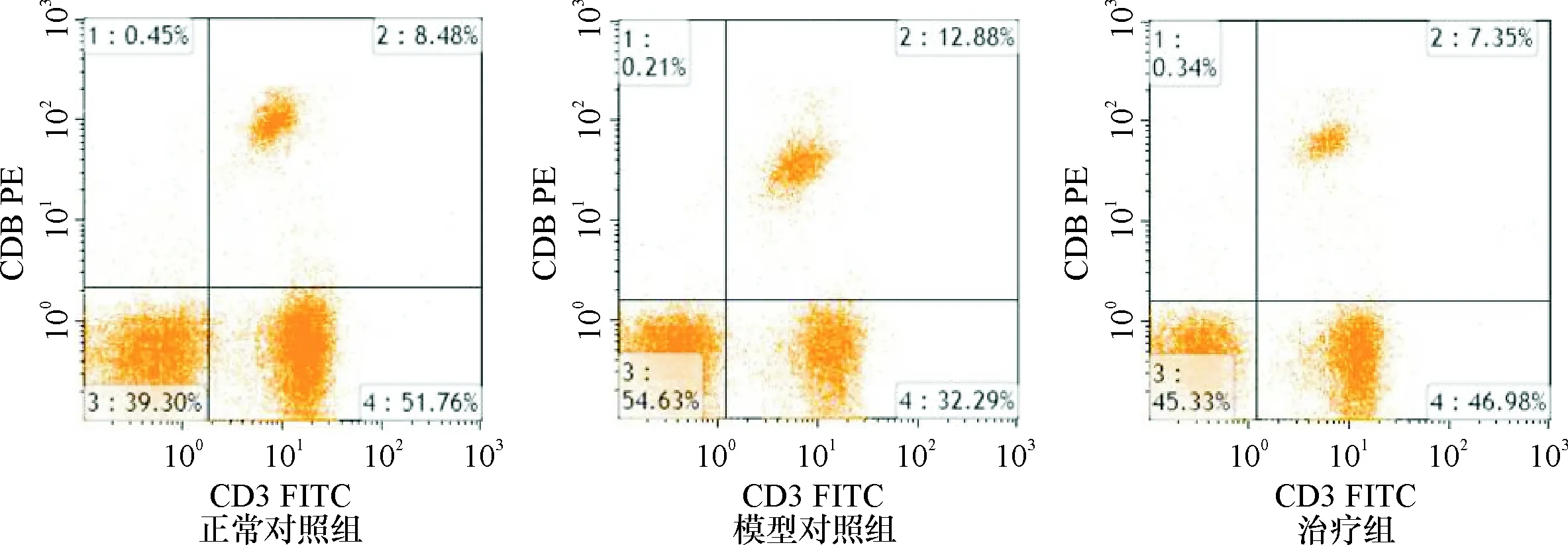
注:CD3+% (2+4象限)、CD8+%(2象限)
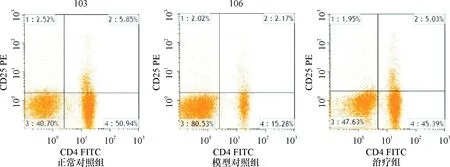
注:CD4+%(2+4象限)、CD4+CD25+%(2象限)
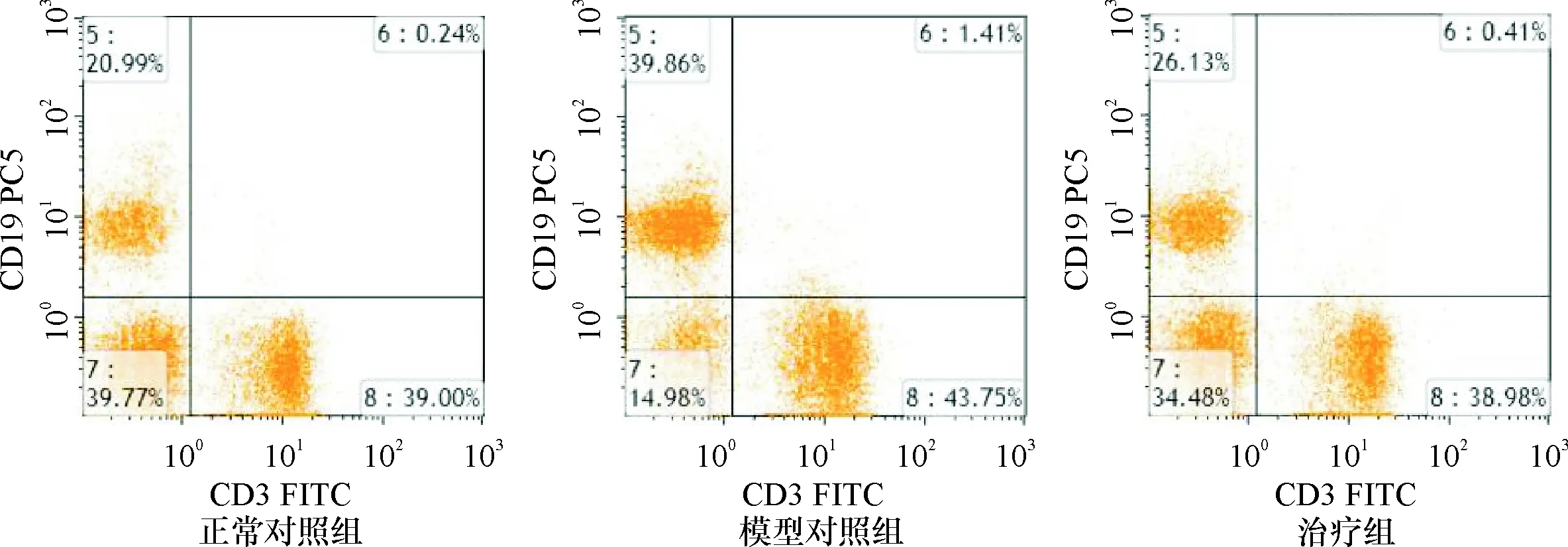
注:CD19+% (1象限)
鉴于骨髓获取非常棘手,同时骨髓中获取的BMSCs数量较少,使得BMSCs的进一步临床应用得不到推广[11]。ADSCs具有与BMSCs相同的分化能力、免疫调节作用,但其是从脂肪组织中筛选分离获取的,来源途径多[15-16]。Gonzalez-Rey等[17]研究发现在类风湿关节炎(RA)患者中,ADSCs可以通过多种信号途径抑制针对自身免疫性的T淋巴细胞。那么,外源性的ADSCs是否也能用于恢复ITP患者正常的免疫功能,调节T细胞免疫?目前国内外尚未见相关报道。我们应用流式细胞术对 ITP小鼠外周血T淋巴细胞各个亚群进行了检测,观察 ITP 模型组与ADSC治疗组小鼠外周血淋巴细胞亚群变化。在本研究中,我们发现ITP小鼠CD19+B淋巴细胞亚群比例与正常组比较显著提高,提示体液免疫在ITP的直接致病因素中起着关键作用,其可以通过产生异常增多的抗自身血小板抗体进而直接影响 ITP 的发生发展。在体液免疫反应过程中发现,仅仅对抗原有特异性应答的B淋巴细胞,其增殖才可以被激活[18]。而随后研究显示,自身抗体的产生明显受到T细胞的影响及APC的调控,CD4+T细胞介导抗血小板自身抗体产生的发病过程。B淋巴细胞表面受体(BCR)和抗原相结合即是该淋巴细胞激活的首要条件,B淋巴细胞把识别的抗原呈递于T细胞,使得T细胞活化,T细胞反过来又可以促进B淋巴细胞进一步增殖及分化[9,19]。所以,B淋巴细胞的活化是激活的Th淋巴细胞和B淋巴细胞相互影响的结果。因此,测定T淋巴细胞亚群比能够对ITP患者提供其疾病状况、治疗效果和预后评估的重要参数[20-21]。基于此,我们得知ITP的病理过程与T、B淋巴细胞的增殖分化与功能关系密切,适应性免疫应答的紊乱在ITP发生、发展中均起着至关重要的作用。本研究结果显示,模型对照组小鼠外周CD3+、CD4+、CD8+及CD4+/CD8+比值明显低于正常对照组,与正常对照组比较差异均有统计学意义,表示ITP小鼠外周血T淋巴细胞表达CD分子发生失常,揭示了ITP 发生时T细胞各亚群出现了比例失衡,即Th和抑制性Ts淋巴细胞比例失衡。
在免疫反应过程中,Th和Ts调节性细胞互相抑制、互相促进所产生的T细胞网络,是影响机体免疫反应平衡的非常关键的一环[22]。健康人的抑制性Ts细胞能够限制B淋巴细胞增殖分化,在ITP发病时淋巴细胞表面的CD4+及CD8+是降低的,同时Ts细胞水平低下,表明T细胞发生免疫功能失常,导致Ts淋巴细胞无法发挥其抑制效能,进而B淋巴细胞增殖分化过程中产生过量的自身抗血小板抗体,最终引起机体血小板被大量破坏[22]。上述表明,T淋巴细胞亚群介导了ITP发生的病理进程,T淋巴细胞免疫功能异常在ITP的发病机制中起着重要作用。另外,我们认为ITP小鼠外周血CD4+T淋巴细胞水平降低的原因或许是其接受了抗原呈递细胞(APC)呈递的自身抗原后激活,调控细胞凋亡的Fas基因过度表达,导致已经激活的细胞凋亡进而被吞噬。因为CD4+T淋巴细胞数量的降低,从而导致CD8+T淋巴细胞比例反馈性的增高。CD4+T的减少亦能够诱导针对自身免疫性B淋巴细胞的增多,产生大量破坏自身血小板的抗体。
ITP小鼠经ADSCs回输治疗后,治疗组CD3+T淋巴细胞、CD4+T比率以及CD4+/CD8+比例提高,CD8+T、CD19+B比率下降,考虑可能是ADSCs抑制了由APC诱导的T细胞的活化与增殖,抑制了血小板Fas及Fas-L途径,降低了清除的CD4+T淋巴细胞数量。由于抑制Bcl-2抗凋亡基因的表达,致使B淋巴细胞凋亡增多。研究发现,间充质干细胞具有抑制淋巴细胞增殖分化的作用,此能力却不单单依靠于其所产生的白细胞介素-10(IL-10)、转化生长因子-β(TGF-β)等因子,而是和间充质干细胞阻止APC与淋巴细胞之间的信号传递相关[23]。
CD4+CD25+Treg细胞是一种新的具有免疫调节作用的T淋巴细胞亚群,该细胞能抑制自身免疫性 T、B淋巴细胞的增殖活化,以及免疫球蛋白的产生[23]。在通过T细胞受体(TCR)参与的信号激活后,不仅能调控CD4+T、CD8+T细胞的增殖及活化,还能抑制其免疫效能[24]。研究发现,在不少的自身免疫性疾病均存在CD4+CD25+Treg细胞水平的失衡和功能上的紊乱[25-26]。最新研究证实,与ITP缓解期患者和健康者相比,ITP进展期患者Treg细胞数量、比例及TGF-β1等细胞因子水平明显降低,同时Treg细胞的抑制作用亦发生功能障碍,提示Treg细胞功能障碍和细胞水平降低或许是ITP患者免疫反应失衡的病理机制之一[24, 27-28]。本研究通过免疫法建立与人类发病机制类似ITP小鼠模型[29],并采用ADSC进行生物学干预治疗,以探索ADSC是否对ITP小鼠具有免疫治疗作用。研究结果发现,与正常对照组比较,模型对照组小鼠的外周血CD4+CD25+Treg细胞水平显著降低,差异有统计学意义(P<0.05)。经ADSC治疗后,Treg细胞明显高于模型组,研究结果表明,ITP小鼠Treg细胞水平降低,使得自身免疫性T淋巴细胞抑制效能变弱,从而致使细胞免疫调节作用异常,自身免疫性T淋巴细胞增殖及活化,导致血小板被破坏;并且,Treg数量低下,产生的炎性因子进一步降低,无法充分地参与免疫调节效应,使得激化的T细胞过多,B淋巴细胞分泌过量的自身抗血小板抗体,最终导致血小板破坏增加。由此提示,CD4+CD25+Treg细胞的表达失常可能介导了ITP患者的发病过程。
综上所述,ADSC增强了抑制性T细胞的功能,抑制了B细胞产生抗体的能力,以减少血小板相关抗体的产生,对ITP机体细胞免疫紊乱起着免疫调节作用。
