青藤碱对胃癌细胞SGC-7901生物学行为的影响及机制
2020-10-15青泓屹魏寿江周程继祝晓娟刘作良
青泓屹,魏寿江,李 勋,周程继,张 肖,祝晓娟,刘作良
我国胃癌发病率高居各类恶性肿瘤的首位,每年约有2万新增病例[1]。目前,临床治疗主要以手术切除和化疗为主,然而胃癌患者术后5年生存率仅10%~20%[2]。青藤碱(sinomenine,SIN)是防己科植物青风藤的有效活性成分,具有抗感染、镇痛等功效,临床上常用其盐酸盐治疗风湿等疾病[3]。近几年,体外细胞实验[4]发现SIN对多种肿瘤细胞有抑制作用,可抑制其增殖,并促进其凋亡。乳酸脱氢酶A(lactate dehydrogenase A,LDHA)是糖酵解中的重要酶类,多种癌症中LDHA水平异常升高,可能与肿瘤的增殖、生长、侵袭和转移有关[5]。但SIN基于LDHA对胃癌的影响鲜少报道,该研究旨在分析SIN是否可通过LDHA抑制胃癌细胞,为胃癌的临床用药提供新的研究方向。
1 材料与方法
1.1 细胞株人胃正常黏膜上皮细胞GES-1、人胃癌细胞SGC-7901购自中国科学院典型培养物保藏委员会细胞库,货号为SCSP-308、TCHu46。
1.2 试剂与仪器
1.2.1药物与试剂 SIN(分子量329.38,货号D0116)购自上海宝曼生物科技有限公司);塞来昔布胶囊(国药准字:J20140072,波多黎各Pfizer Pharmaceuticals LLC分包装)购自辉瑞制药有限公司;CCK-8试剂盒(货号GV357762)购自上海一基实业有限公司;转染试剂盒(货号SL100688)购自美国Signagen公司;Bax、cleaved caspase 3、Bcl-2、E-cadherin、N-cadherin、Vimentin及LDHA蛋白一抗购自美国Abcam公司;DMEM培养基、胎牛血清购自美国Invitrogen公司;双荧光素酶验证试验由上海美轩生物科技有限公司检测。
1.2.2主要仪器 ROL-INC-16恒温细胞培养箱(广州科适特科学仪器公司);SMR16.1酶标仪(美国USCNK公司);1026流式细胞仪(常州必达科生物科技有限公司)。
1.3 细胞培养将细胞GES-1、SGC-7901常规复苏,培养于含10%胎牛血清、10%青链霉素的DMEM培养基中,置于37 ℃、5% CO2恒温培养箱中孵育,每48 h换培养基;待细胞融合至80%~90%时,用0.25%胰蛋白酶消化传代,按适宜浓度接种于6孔板或96孔板用于后续试验。
1.4 细胞分组与药物干预正常培养细胞GES-1、人胃癌细胞SGC-7901作空白对照组(Control组),分别用0.5、1.0、2.5 mmol/L SIN处理细胞48 h作SIN组(0.5、1.0和2.5 mmol/L),并用50 μmol/L 塞来昔布处理细胞48 h作阳性对照组;将miR-33a-5p NC、miR-33a-5p mimics转染SGC-7901细胞分别为miR-33a-5p NC组和miR-33a-5p mimics组,构建重组质粒载体转染SGC-7901细胞过表达LDHA为pcDNA-LDHA组,并予以2.5 mmol/L SIN干预设为SIN+LDHA组。
1.5 检测方法
1.5.1CCK-8法检测细胞生长情况 将细胞按1×105个/ml的密度接种至96孔板,每孔100 μl细胞悬液,药物干预48 h后,每孔加入100 μl含10% CCK-8的DMEM培养基,继续培养1 h;应用酶标仪于450 nm处检测各孔吸光值,计算细胞细胞存活率(实验组各孔吸光值/ Control组吸光值×100%)。
1.5.2流式细胞仪检测细胞凋亡 将细胞按1×105个/ml的密度接种至6孔板,每孔1.5 ml细胞悬液,药物干预48 h后收集各组细胞,加入1 ml预冷PBS缓冲液,离心清洗2次;加入500 μl结合缓冲液混匀,悬浮细胞;加入5 μl Annexin V-FITC混匀,再加入5 μl PI染液混匀,室温下避光反应10 min;加入400 μl缓冲液混合,经流式细胞仪分析,参数设置为:激发波长488 nm,发射波长530 nm。
1.5.3Transwell小室检测细胞侵袭情况 将预冷Matrigel胶铺至Transwell小室上层,置于37 ℃凝固;药物干预后接种1×105个/ml的细胞于放有Transwell小室上层(Transwell小室放于6孔板),每孔200 μl,采用无血清培养基培养,下室加入500 μl含胎牛血清DMEM培养基,添加过程中避免出现气泡影响实验结果;常规培养24 h后,取出Transwell小室并轻轻拭去Matrigel胶和上室内细胞,进行结晶紫染色,显微镜下选取若干视野进行细胞计数。
1.5.4划痕实验检测细胞迁移情况 将细胞按1×105个/ml的密度接种至6孔板,每孔1.5 ml细胞悬液,待细胞贴壁后,用1 ml枪头于培养孔正中处垂直划线,加入PBS缓冲液清洗划下的细胞,显微镜下拍照记录0 h细胞迁移距离;加入药物干预,培养24 h后,显微镜下拍照记录24 h细胞迁移距离,细胞迁移率(%)=(0 h细胞迁移距离-24 h细胞迁移距离)/0 h细胞迁移距离×100%。
1.5.5Western blot检测细胞中蛋白表达 将细胞按1×105个/ml的密度接种至6孔板,每孔1.5 ml细胞悬液,药物干预48 h,提取各组细胞总蛋白,等量取50~100 μg蛋白进行SDS-PAGE凝胶电泳,再将分离后的蛋白电转至硝酸纤维素膜上,进行一系列免疫反应后显色,应用全自动凝胶成像仪进行分析;以β-actin为内参,校准各蛋白的表达量。
1.5.6双荧光素酶实验 应用在线预测软件TargetScan 3.1分析miR-33a-5p的靶基因为LDHA,根据软件提供的结合位点信息,合成含该位点的DNA片段(WT)以及含该位点突变体(MUT)的DNA片段,并将上述片段克隆至双荧光素酶启动子载体上。将该质粒和miR-33a-5p分别转染细胞,培养48 h后,采用试剂盒测定荧光素酶活性。
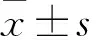
2 结果
2.1 SIN对胃细胞GES-1、SGC-7901增殖的影响CCK-8实验显示,SIN对人胃正常黏膜上皮细胞GES-1的存活率无影响(F=0.302,P>0.05);SIN干预后,胃癌细胞SGC-7901的存活率降低(F=75.315,P<0.05),表现出浓度依赖性,其高剂量抑制效果与阳性对照组相当(q=0.732,P>0.05)。见图1。
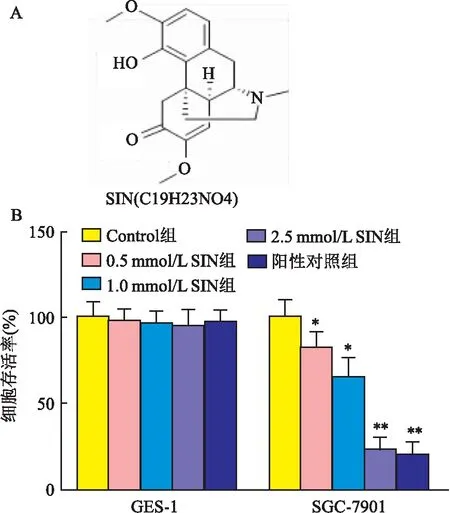
图1 SIN对胃细胞GES-1、SGC-7901增殖的影响A:SIN化学分子结构;B:SIN对胃细胞GES-1、SGC-7901细胞存活率的影响;与Control组比较:*P<0.05,**P<0.01
2.2 SIN对胃癌细胞SGC-7901凋亡的影响流式细胞实验(图2A、C)显示,SIN干预后,胃癌细胞SGC-7901的凋亡率增加(F=274.629,P<0.05),且具有浓度依赖性。Western blot实验(图2B)显示,SIN可剂量性上调Bax、cleaved caspase 3的表达,下调Bcl-2的表达(F=242.482、120.468、112.396,P<0.05),其高剂量作用效果与阳性对照组相当(q=2.201、0.883、1.021,P>0.05)。
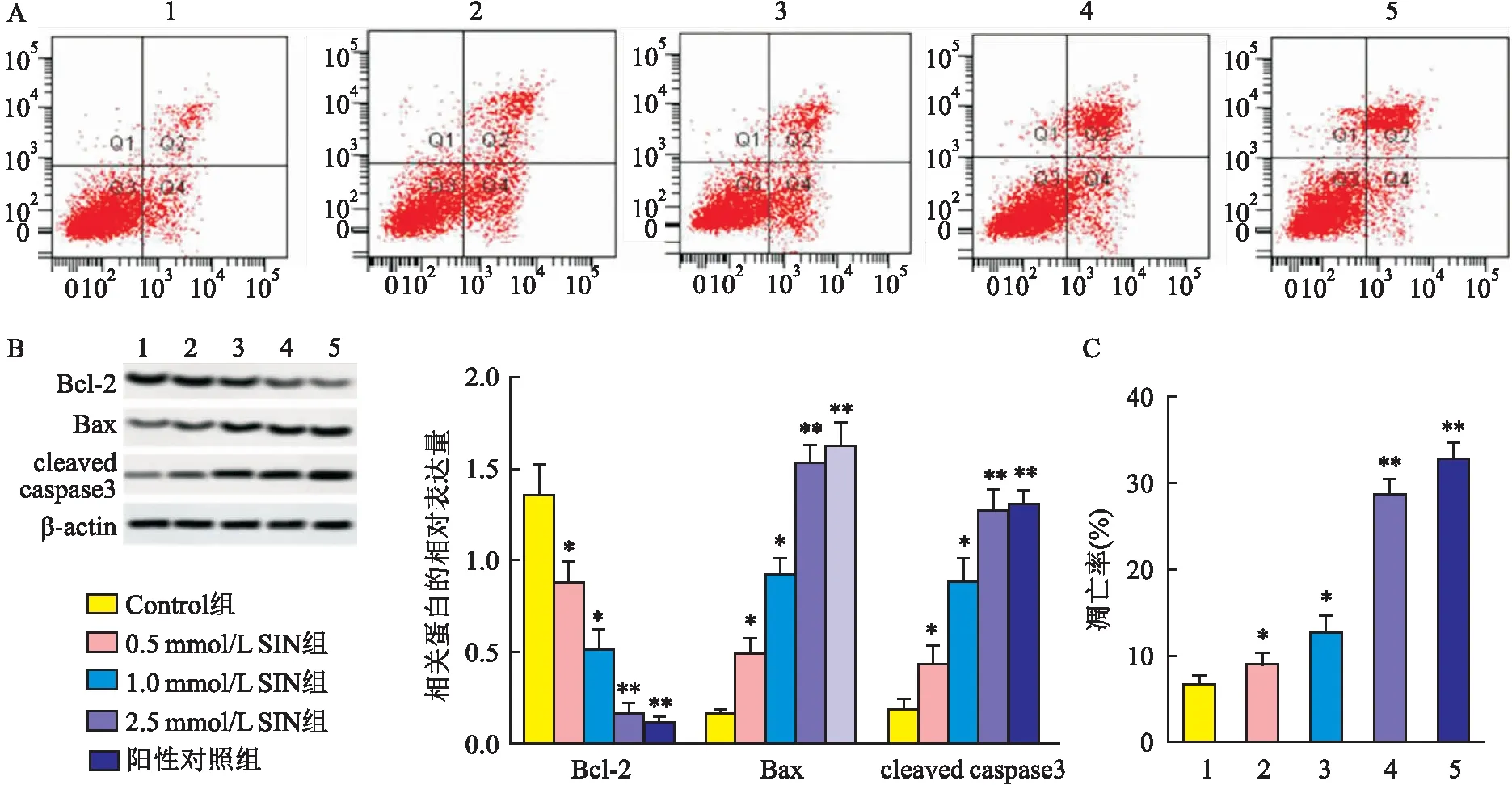
图2 SIN对胃癌细胞SGC-7901凋亡的影响A:流式细胞结果;B:SIN对凋亡相关基因的影响;C:SIN对细胞凋亡率的影响;1:Control组;2:0.5 mmol/L SIN组;3:1.0 mmol/L SIN组;4:2.5 mmol/L SIN组;5:阳性对照组;与Control组比较:*P<0.05,**P<0.01
2.3 SIN对胃癌细胞SGC-7901侵袭、迁移的影响Transwell小室实验(3A)显示,SIN干预后,胃癌细胞SGC-7901的侵袭数降低(F=619.131,P<0.05),呈浓度依赖趋势。划痕实验(图3B)显示,SIN干预后,胃癌细胞SGC-7901的迁移率降低(F=362.419,P<0.05),呈浓度依赖趋势,其高剂量抑制效果与阳性药塞来昔布相当(q=1.523,P>0.05)。Western blot实验(图3C)显示,SIN可剂量性上调E-cadherin的表达,下调N-cadherin、Vimentin的表达(F=53.168、77.691、34.905,P<0.05),其高剂量作用效果与阳性对照组相当(q=1.196、1.584、0.892,P>0.05)。
图3 SIN对胃癌细胞SGC-7901侵袭、迁移的影响A:SIN对胃癌细胞SGC-7901侵袭的影响 ×400;B:SIN对胃癌细胞SGC-7901迁移的影响 ×100;C:SIN对侵袭、迁移相关基因的影响;1:Control组;2:0.5 mmol/L SIN组;3:1.0 mmol/L SIN组;4:2.5 mmol/L SIN组;5:阳性对照组;与Control组比较:*P<0.05,**P<0.01
2.4 miR-33a-5p和LDHA的靶向关系经在线预测软件TargetScan3.1分析显示,miR-33a-5p与LDHA3′UTR 114-121碱基处存在结合位点(图4A);如图4B,过表达miR-33a-5p后,SGC-7901细胞中miR-33a-5p的表达上升,LDHA mRNA的表达下降(F=322.500、143.130,P<0.05);双荧光素酶实验(图4C)显示,共转染野生型荧光素酶质粒和miR-33a-5p组荧光素酶活性降低(F=23.615,P<0.05),表明LDHA是miR-33a-5p的预测靶位点。

图4 miR-33a-5p与LDHA的靶向关系A:TargetScan3.1软件预测可能结合位点;B:过表达miR-33a-5p后对SGC-7901细胞中miR-33a-5p、LDHA mRNA表达的影响;C:双荧光素酶实验结果;与Control组比较:*P<0.05,**P<0.01;与LDHA-WT组比较:#P<0.05
2.5 SIN通过miR-33a-5p靶向LDHA对细胞SGC-7901增殖、凋亡、侵袭和迁移的影响如图5A,SIN可上调miR-33a-5p的表达,并下调LDHA mRNA的表达(t=13.688、18.084,P<0.05)。如图5B~F,与Contorl组相比,过表达LDHA后,细胞SGC-7901的凋亡率下降(q=6.504,P<0.05),其LDHA蛋白表达、存活率、侵袭数和迁移率上升(q=18.049、8.383、4.399、6.836,P<0.05);SIN处理组细胞凋亡率上升(q=36.858,P<0.05),其LDHA蛋白表达、存活率、侵袭数和迁移率下降(q=14.928、13.121、18.067、14.461,P<0.05);与pcDNA-LDHA组相比,干预SIN后,细胞SGC-7901的凋亡率上升(q=9.340,P<0.05),其LDHA蛋白表达、存活率、侵袭数和迁移率下降(q=18.320、10.569、16.182、2.095,P<0.05)。
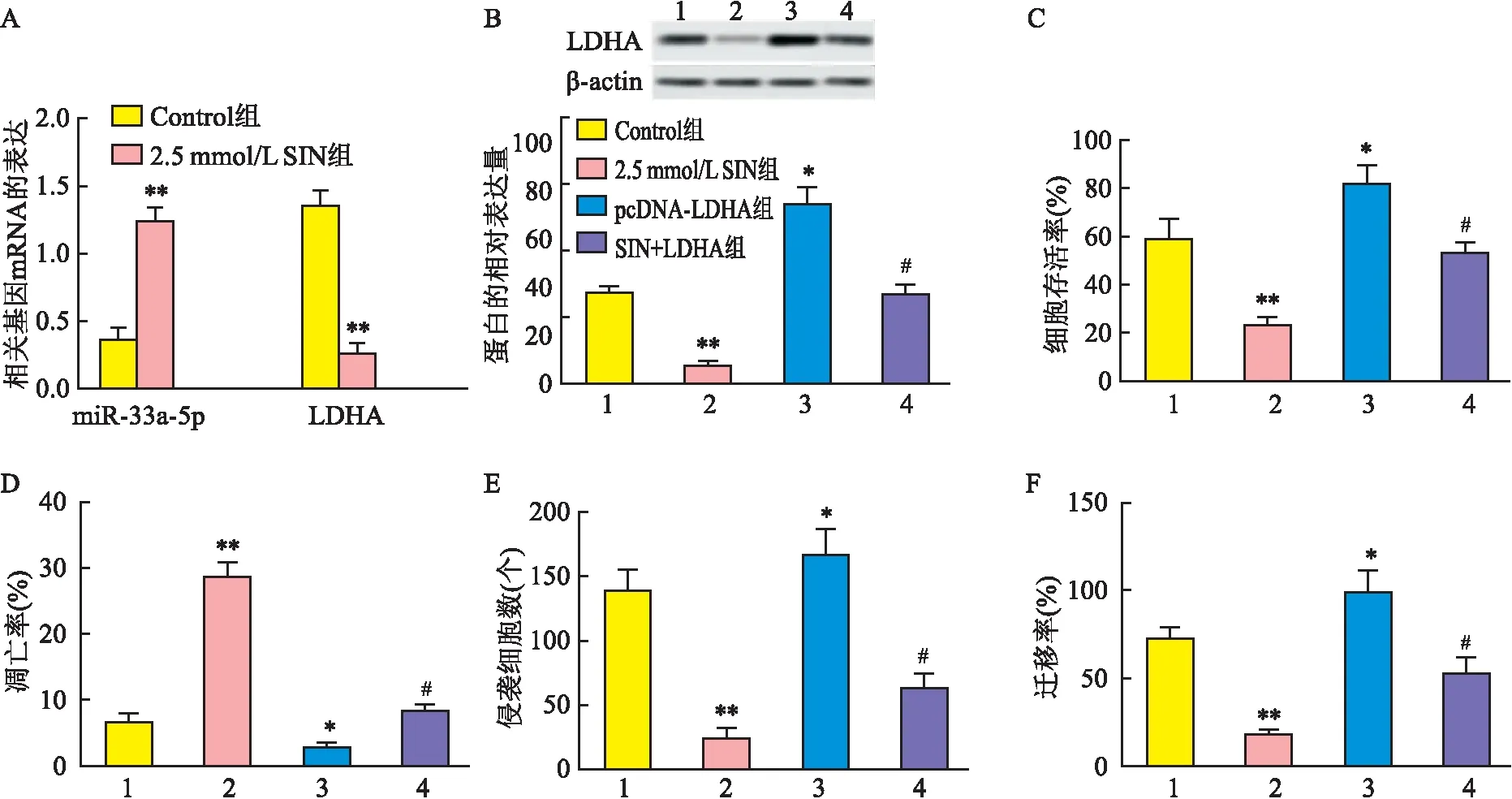
图5 SIN通过miR-33a-5p靶向LDHA对细胞SGC-7901增殖、凋亡、侵袭和迁移的影响A:SIN对细胞SGC-7901中miR-33a-5p、LDHA mRNA表达的影响;B:SIN对细胞SGC-7901中LDHA 蛋白的影响;C~F:SIN通过下调LDHA对细胞SGC-7901侵袭、迁移、增殖、凋亡的影响;1:Control组;2:2.5 mmol/L SIN组;3:pcDNA-LDHA组;4:SIN+LDHA组;与Control组比较:*P<0.05,**P<0.01;与pcDNA-LDHA组比较:#P<0.05
3 讨论
多项研究表明,SIN对恶性肿瘤细胞有抑制作用,Li et al[6]体外研究发现SIN可抑制卵巢癌细胞的生长和运动能力;Jiang et al[7]研究发现SIN可介导活性氧生成和自噬体途径抑制人胶质母细胞瘤细胞的生长。本研究显示,SIN可促进细胞SGC-7901的凋亡,并抑制其增殖、侵袭和迁移,与文献[8]报道一致。细胞凋亡涉及多种蛋白的参与,包含Bcl-2家族蛋白、Caspase蛋白、线粒体凋亡通路等,这些蛋白相互调节控制细胞凋亡。Bcl-2家族蛋白属于凋亡调控分子,其成员均含有一个凋亡相关(促凋亡/抗凋亡)穿膜结构域,其中Bcl-2具有抗凋亡作用,Bax具有促凋亡作用。Caspase蛋白主要包含凋亡信号的启动着和执行者,caspase 3经切割成熟后可直接降解细胞内结构蛋白和功能蛋白,从而导致细胞凋亡。本研究表明SIN可上调Bax、cleaved caspase 3的表达,下调Bcl-2的表达,从而促进SGC-7901细胞的凋亡,与陈淑瑜 等[9]报道SIN促进MCL Jeko-1细胞系凋亡机制一致。肿瘤转移主要通过细胞间的黏附作用实现的,包括钙黏附蛋白、选择素、免疫球蛋白等多种蛋白参与。E-cadherin是维持细胞间连接的重要蛋白,N-cadherin是介导细胞间动态粘附的分子,Vimentin是细胞骨架的主要成分之一,梁鑫 等[10]、Labernadie et al[11]研究发现,E-cadherin、N-cadherin和Vimentin在肿瘤侵袭、浸润和转移等过程中有重要作用。本研究显示SIN可上调E-cadherin的表达,下调N-cadherin、Vimentin的表达,从而抑制SGC-7901细胞的侵袭和迁移,与王新荣 等[12]报道SIN抑制人卵巢癌SKOV3细胞侵袭、迁移的机制一致。
随着分子肿瘤学的飞速发展,miRNAs在肿瘤发生发展中的重要作用得以报道。文献[13]调研发现miR-33a-5p在多种肿瘤细胞中低表达,可抑制肿瘤细胞的增殖、侵袭和迁徙,并促进其凋亡。通过TargetScan3.1软件在线预测miR-33a-5p可能是LDHA的靶基因,并经双荧光素酶实验确认靶向关系,且过表达miR-33a-5p后,SGC-7901细胞中miR-33a-5p的表达上升,LDHA mRNA的表达下降,进一步证实miR-33a-5p和LDHA之间的靶向关系。LDHA主要通过催化丙酮酸转化为乳酸,体内积累大量LDHA后,富余乳酸分泌至细胞外,会形成利于肿瘤细胞生长的“微环境”[14]。Sun et al[15]研究显示LDHA在胃癌组织中异常高表达,是胃癌发生的独立风险因素,可预测胃癌患者的不良预后。Zhu et al[16]研究发现敲除LDHA可抑制胃癌细胞的迁移和侵袭。本研究显示SIN可通过miR-33a-5p靶向下调LDHA水平,从而促进细胞SGC-7901的凋亡,并抑制其增殖、侵袭和迁移。
