人参皂苷Rb1抑制利多卡因诱导小鼠原代脊髓神经干细胞损伤研究
2020-10-15杨常青韩芳芳徐松涛陈旭东
杨常青,韩芳芳,袁 菲,徐松涛,陈旭东
神经干细胞(neural stem cells,NSCs)对于受损的脑组织及脊髓修复非常重要[1],但是局麻药可降低神经干细胞数量,从而影响神经系统功能[2]。人参皂苷Rb1是人参的主要药理活性成分,在神经纤维形成和神经干细胞的增殖过程中起关键作用[3],可下调炎症因子的表达来降低炎症损伤[4],也可促进小鼠局灶性脑梗死小鼠的后期运动恢复[5]。c-Jun氨基末端激酶(c-Jun-terminal kinases,JNK)属于丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)家族,对其通路进行抑制可缓解神经干细胞凋亡。人参皂苷 Rb1不仅抑制JNK 信号通路,还可通过此途径调控促炎症因子表达[6-7],但尚不清楚人参皂苷Rb1可否通过JNK通路影响神经干细胞。该文拟研究人参皂苷Rb1对于利多卡因诱导的小鼠原代脊髓神经干细胞凋亡的影响,并探讨JNK通路在这一过程中与Rb1之间的关系,以期为降低局麻药对神经组织损伤提供理论依据。
1 材料与方法
1.1 材料PE标记抗鼠源Nestin抗体购自美国R&D公司;APC标记抗鼠CD133抗体购自美国Biolegend公司;SOX2和MAP2抗体购自武汉三鹰生物技术有限公司;JNK和P-JNK抗体购自英国Abcam公司;Caspase3(P17)购自武汉博士德生物有限公司;人参皂苷Rb1购自美国MedChemExpress公司;利多卡因购自北京四环科宝制药有限公司。
1.2 流式细胞分选将分离的原代神经细胞用PBS清洗1遍,流式染色固定液清洗细胞1遍,将带荧光标记的Nestin抗体溶解在固定液中孵育原代细胞,30 min后流式分选出荧光强阳性的细胞,PBS清洗1遍后接至细胞培养皿中培养。待细胞贴壁并生长至状态良好,消化细胞成单细胞状态,PBS清洗1遍,将荧光标记的CD133表面抗体加入细胞,37 ℃孵育30 min后上流式再次分选,将获得的CD133阳性细胞转入细胞培养皿备用。
1.3 免疫染色普通培养基培养神经细胞,自由分化1周,弃去培养液后用PBS清洗1遍,然后用4%多聚甲醛固定细胞30 min,分别用0.2% Triton X-100溶液透膜15 min,1% BSA封闭30 min,加入相应的一抗(抗SOX2、抗MAP2)孵育过夜,合适的荧光标记二抗37 ℃孵育1 h,Hoechst33342染核5 min,各步之间用PBS清洗3遍,每遍5 min。
1.4 Western blot检测细胞凋亡将待检测的神经干细胞弃去培养液,用PBS清洗一遍;将培养皿置于冰上,加入含蛋白酶抑制剂PSMF的RIPA蛋白裂解液,裂解液浸润细胞即可;在冰上裂解存放15 min,期间晃动培养皿3次,使裂解液充分接触细胞;加入蛋白上样缓冲液,用移液器吹打掉细胞并将蛋白溶液转移至EP管中,煮沸5 min备用。利用10% SDS-PAGE胶对提取的蛋白进行分离,并将分离开的蛋白转移至PVDF膜上。将膜与对应的一抗,包括抗JNK(1 ∶1 000)、抗P-JNK(1 ∶1 000)、抗Caspase 3(1 ∶1 000),抗Cleaved-caspase3(1 ∶1 000)、抗β-acting(1 ∶2 000)进行孵育,孵育条件为4 ℃过夜。待使用1×TBST清洗膜3遍后,加入对应的二抗(1 ∶3 000)进行孵育,条件为室温1 h。再次使用1×TBST清洗膜3次后,使用增强化学发光法进行蛋白条带检测。
1.5 相对定量检测将细胞培养液弃去,用PBS清洗1遍,加入TRIzol,用异丙醇沉淀法提取RNA,用oligo(dT)作为下游引物反转录获得cDNA,用相应的引物做定量PCR,以β-actin为内参。引物由上海生工生物技术有限公司合成,序列如下表1所示。
1.6 统计学处理统计性数据均来自3次独立实验,灰度值用Image J软件统计,凋亡数据统计时采用等比例换算后用Graphpad Prism5统计软件进行统计学分析。采用两独立样本t检验以及单因素方差分析(One-way ANOVA)。以P<0.05为差异有统计学意义。
2 结果
2.1 小鼠原代脊髓神经干细胞分离使用荧光抗体anti-Nestin-PE标记消化分离得到的小鼠第一代神经细胞,经流式细胞仪第一次分选后得到强荧光的细胞群(Ⅱ)(图1A)。将这群细胞置于神经干细胞培养液中继续培养一代,用anti-CD133-APC荧光抗体标记,并进行第二次分选,最终得到CD133阳性的Ⅳ亚群细胞(图1B),即为初步分离的原代神经干细胞。将分离过程中的第Ⅱ、Ⅳ亚群细胞和原代总细胞进行鉴定。相对定量检测结果显示,神经干细胞标记基因Nestin在分选后的细胞中在第一次分选得到的Ⅱ亚群细胞中表达量高于对照组(t=16.56,P<0.001)。在用CD133再次分选后的第Ⅳ亚群细胞的Nestin表达量也高于对照组细胞(t=15.23,P<0.001),见图1C。另外一个神经干细胞标记基因CD133仅在用CD133进行第二次筛选后的第Ⅳ亚群细胞表达量增高(t=4.497,P<0.05),见图1D。图1E中,神经干细胞SOX2基因在用Nestin分选得到的第Ⅱ、Ⅳ亚群细胞中均表现出较高的表达(t=4.105,P<0.05;t=27.86,P<0.001)。如图1F~H所示,星形胶质细胞,少突胶质细胞和神经元标记基因GFAP(t=5.609,P<0.01;t=10.62,P<0.001)和NeuN(t=12.05,P<0.001;t=11.19,P<0.001)的表达在两次分选得到的细胞中均表现出减少的趋势,CD11c(t=1.927,P>0.05;t=3.011,P<0.05)在第二次分选后表达量降低。以上结果显示,这种两步法分离的原代神经干细胞能够表达神经干细胞的一般标记基因,且非干细胞标记基因的表达量较低。

图1 小鼠原代脊髓神经干细胞分离鉴定A:利用Nestin分子标记对神经干细胞进行流式分选;B:利用CD133分子标记对神经干细胞进行二次流式分选;C~H: 利用qRT-PCR对对照组细胞及分选后的第Ⅱ、Ⅳ亚群细胞中Nestin、 CD133、SOX2、GFAP、CD11c、NeuN分子mRNA水平进行检测;与对照组比较:*P<0.05,**P<0.01,***P<0.001
2.2 神经干细胞分化鉴定为了检验分离到的神经干细胞是否有分化为其它神经细胞的能力,将神经干细胞放在普通的培养基中培养约7 d,然后进102行免疫荧光染色鉴定。荧光染色结果显示,可清晰的检测到神经干细胞的标志蛋白SOX2;标记神经元的MAP2蛋白能够在少部分细胞中检测到,表明有少部分神经干细胞向神经元分化(图2A)。此时对这些分化的细胞进行相对定量检测神经干细胞标记基因Nestin、CD133和SOX2的表达量(t=5.674,P<0.01;t=3.537,P<0.05;t=3.644,P<0.05)。定量结果显示,在分化后这些基因的表达水平不同程度的降低(图2B、C、D)。如图2E~G所示,指示神经干细胞分化的基因GFAP、CD11c和NeuN(t=7.033,P<0.01;t=9.479,P<0.001;t=9.110,P<0.001)的mRNA丰度表现出不同水平的提高。以上结果提示,该神经干细胞能够向相关神经细胞分化。

图2 小鼠原代神经干细胞分化能力检测 ×400A:免疫荧光检测MAP2和SOX2的表达;B~G:利用qRT-PCR对神经干细胞及分化细胞的细胞内源性Nestin、CD133、SOX2、GFAP、CD11c、NeuN 分子mRNA表达量进行检测;与神经干细胞组比较:*P<0.05,**P<0.01,***P<0.001
2.3 利多卡因激活JNK信号通路诱导神经干细胞损伤用含500 μmol/L利多卡因的培养液培养神经干细胞24 h后,相对定量检测神经干细胞的凋亡相关标记基因的变化。结果显示JNK信号通路激活的c-Jun(t=13.74,P<0.01)和ATF2表达量相对提高(t=15.26,P<0.01),促进凋亡的FasL表达量较对照组提高(t=12.87,P<0.01),而抑制凋亡的Bcl2表达量相对降低(t=24.67,P<0.01),见图3A。此外,相对定量检测发现干细胞标记基因SOX2表达相对降低(t=7.566,P<0.01),而神经元标记基因NeuN的表达量没有变化(t=0.062,P>0.05),见图3B。Western blot检测用利多卡因处理24 h后的神经干细胞,结果显示,磷酸化的JNK蛋白含量相对增加(t=17.57,P<0.01),提示凋亡的Cleaved-caspase3含量相对增加(t=9.978,P<0.01),见图3C。

图3 利多卡因对神经干细胞的影响A:神经干细胞细胞凋亡相关基因mRNA水平检测;B:神经干细胞标志物SOX2和NeuN mRNA水平检测;C:JNK、 P-JNK、Caspase 3、Cleaved-caspase 3 蛋白表达水平检测;1:对照组;2:利多卡因处理组;与对照组比较:**P<0.01,***P<0.001
2.4 人参皂苷抑制神经干细胞JNK信号通路激活配制含100 μmol/L人参皂苷干细胞培养液,用该培养液培养神经干细胞48 h,相对定量检测凋亡相关基因的变化。图4A的结果显示JNK信号通路激活相关的基因c-Jun、ATF2以及促进凋亡相关的FasL的mRNA丰度降低,而抑制凋亡的基因Bcl2表达量提高。(t=3.371,P<0.05;t=14.22,P<0.001)。此外,相对定量结果显示人参皂苷能够提高神经干细胞标记基因SOX2的表达,并抑制神经元基因NeuN的表达(t=5.183,P<0.01;t=3.267,P<0.05),见图4B。图4C中,Western blot 结果显示,人参皂苷加入后能够减少P-JNK 蛋白含量(t=2.935,P<0.05),提示凋亡的Cleaved-caspase3表达量也减少(t=3.651,P<0.05)。
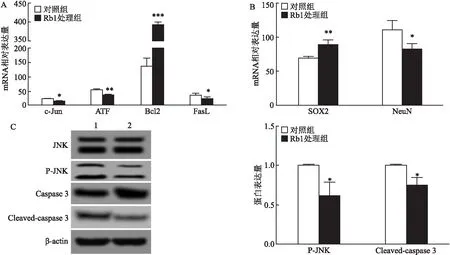
图4 人参皂苷Rb1对神经干细胞的影响A:神经干细胞细胞凋亡相关基因mRNA水平检测;B:神经干细胞标志物SOX2和NeuN mRNA水平检测;C:JNK、P-JNK、Caspase 3、Cleaved-caspase 3蛋白表达水平检测;1:对照组;2:Rb1处理组;与对照组比较:*P<0.05,**P<0.01,***P<0.001
2.5 人参皂苷抑制利多卡因诱导的神经干细胞损伤为了验证人参皂苷能否减轻利多卡因造成的损伤,在培养的神经干细胞中同时添加利多卡因和人参皂苷进行处理。相对定量结果显示,在500 μmol/L利多卡因 和50 μmol/L人参皂苷Rb1共处理的细胞中,仅FasL的表达量有所降低,c-Jun、ATF2和Bcl2的mRNA丰度无变化(t=4.977,P<0.01;t=0.1348,P>0.05;t=1.144,P>0.05;t=14.22,P>0.05),见图5A。图5B中,神经干细胞标记基因SOX2的表达量变化不大(t=0.467,P>0.05),而神经元标记基因NeuN的表达丰度则在处理后降低(t=6.964,P<0.01)。此外,在验证人参皂苷能否抵消利多卡因的损伤实验中,将人参皂苷分成3个浓度梯度(10、50、100 μmol/L),结果显示人参皂苷加入后能够抑制JNK磷酸化的变化(t=3.820,P<0.05;t=8.542,P<0.05;t=13.25,P<0.01),也能减少凋亡相关蛋白Cleaved-caspase3的表达量(t=2.286,P>0.05;t=4.202,P<0.05;t=17.407,P<0.01),图5C为三次结果的灰度值。

图5 人参皂苷Rb1对利多卡因诱导的神经干细胞损伤修复作用检测A:Rb1和利多卡因共处理后神经干细胞细胞凋亡相关基因mRNA水平检测;B:Rb1和利多卡因共处理后神经干细胞标志物SOX2和NeuN mRNA水平检测;C:Rb1和利多卡因共处理后JNK、P-JNK、Caspase3、Cleaved-caspase3蛋白表达检测;1:利多卡因单处理组;2:利多卡因+10 μmol/L Rb1处理组;3:利多卡因+50 μmol/L Rb1 处理组;4:利多卡因+100 μmol/L Rb1 处理组;与对照组比较:##P<0.01;与利多卡因单处理组比较:*P<0.05,**P<0.01
3 讨论
局部麻醉药品对神经系统及神经干细胞有一定损伤,但是目前仍不清楚其具体的机制。许多中药也被证明能够修复神经损伤,例如参附注射液能够部分保护布比卡因对神经组织的损伤[8]。白藜芦醇也能够修复局麻药罗哌卡因的部分神经毒性[9]。但是目前临床上仍然不能完全避免局麻药对神经组织的损伤作用,需要探索新的方案及药物去减轻局麻药的相关副作用。人参是我国的传统药用植物,其主要药理活性成分为人参皂苷。人参皂苷化合物有40种,具有抗氧化、缓解心血管病变、减缓肿瘤发展、改善脑部缺血、调节炎症反应等功能[10]。原人参二醇代表成分人参皂苷Rb1已被证明在神经系统中发挥重要作用,例如促进神经干细胞增殖[4]。但是,目前尚不清楚人参皂苷Rb1是否可抑制局部麻醉药物造成的神经干细胞损伤。
为了探究这一问题,本研究首先需要分离脊髓神经干细胞。本文在分离脊髓源神经干细胞的过程中使用了Nestin和CD133流式抗体。Nestin是神经干细胞的标记[11],其抗体特异性识别神经组织中的某些细胞[12]。本实验中分离原代神经干细胞时采用Nestin作为分选标记,在第一步分离后所得到的分离细胞在细胞亚群上区分不明显,这可能是原代细胞比较杂乱造成的。而在用经典的神经干细胞标记CD133做第二次分选时,得到了将近7%的阳性细胞,且这些二次分选的细胞高度表达神经干细胞标志基因SOX2[13-14],神经细胞分化的相关标记基因则呈现低表达状态,说明细胞保持了很好的干细胞状态。文中采用MAP2作为阳性细胞标志进行检测,并辅助以GFAP、CD11c和NeuN的mRNA表达量作为分化的标志来判断分选出的脊髓神经干细胞的分化能力。通过对比分化前后的标志物表达量趋势变化以及免疫荧光检测的结果来综合判断细胞的分化能力。文中的结果提示用Nestin和CD133两个标记分两步分选脊髓来源神经干细胞,以及通过上述标志物分子鉴定细胞分化能力是可行的,该方法能够较为有效地分离到较高纯度的脊髓神经干细胞,对以后的分离和鉴定手段提供了一定的参考价值。
利多卡因是一种较常用的局麻药,本实验中通过利多卡因刺激神经干细胞,结果表明利多卡因能够激活神经干细胞的JNK信号通路。JNK信号参与调控细胞凋亡,其通路下游被激活的c-Jun等分子可进一步激活凋亡相关基因。JNK还可以通过经典的线粒体凋亡途径促进Bcl家族成员参与凋亡调控。文中,利多卡因不仅激活了JNK通路,还促进了神经干细胞的凋亡,因此结合JNK通路的特性,推测利多卡因可通过JNK通路影响神经干细胞的生长。而对JNK通路信号进行阻断或抑制则有可能回复利多卡因对神经干细胞的影响。
之前的研究显示人参皂苷Rb1可降低JNK通路中JNK1和c-Jun的表达,提示人参皂苷Rb1可作为JNK通路潜在的抑制剂[7-8]。本实验结果也显示Rb1处理可降低JNK信号通路激活相关的基因c-Jun、ATF2的表达量。而mRNA及蛋白水平的凋亡分子检测表明加入Rb1可抑制所分离的神经干细胞的凋亡。该结果证明人参皂苷Rb1在神经干细胞中可以抑制JNK通路的激活,从而抑制神经干细胞的凋亡。而SOX2的表达量则说明Rb1并不会影响神经干细胞状态的维持,表明了Rb1作用的特异性。文中进一步探讨人参皂苷Rb1能否通过抑制JNK通路修复利多卡因对神经干细胞的损伤作用。本文研究显示人参皂苷不仅降低了利多卡因诱导的JNK信号通路激活,还抑制了凋亡相关基因Caspase3的活化,即抑制了神经干细胞的凋亡。
