长链非编码RNA FAM83H-AS1对胃癌细胞周期、增殖和转移的影响及作用机制
2020-10-15马牧原叶晓锋
王 涛,马牧原,叶晓锋
胃癌是全球第五大最常见的肿瘤,也是第三大最致命的肿瘤,在中国,每年报告超过40万例新病例,占全球总数的42%[1]。在过去的几十年中,尽管胃癌的诊断和治疗得到了显著改善,但患者的5年生存率仍然很低[2],因此有必要探索胃癌新型治疗靶标的分子机制和鉴定。研究[3]报道表观遗传学在胃癌的进展中发挥重要调控作用,长链非编码RNA(long non-coding RNA, lncRNA)属于表观遗传学的一种,在人类恶性肿瘤的发病机制中具有重要作用。lncRNA序列相似性家族83成员H反义RNA 1(lncRNA family with sequence similarity 83 member H antisense RNA 1, lncRNA FAM83H-AS1)是新近发现的lncRNA之一,在肝细胞肝癌、结直肠癌和卵巢癌等恶性肿瘤中高表达,发挥促癌基因作用[4-6]。Da et al[7]报道FAM83H-AS1在胃癌组织中表达上调,并与胃癌患者的淋巴结转移和预后相关。该文探讨了FAM83H-AS1在胃癌中发挥的具体作用。
1 材料与方法
1.1 主要实验试剂与材料人胃癌细胞系MKN-45、SGC-7901、MGC-803和人永生化正常胃上皮细胞GES-1(美国ATCC细胞库),DMEM-F12培养基、RPMI1640培养基和胎牛血清(美国gibco公司),PrimeScriptTMRT reagent Kit反转录、SYBR Premix Ex TaqTMqRT-PCR试剂盒(日本TaKaRa公司),siRNA(广州锐博生物),细胞周期检测试剂盒和BCA蛋白浓度检测试剂盒(上海碧云天生物),MTS试剂(美国Biovision公司),Transwell小室(美国BD公司);蛋白裂解液(北京索莱宝生物),cyclinD1、CDK4、E钙黏蛋白、N钙黏蛋白和波形蛋白抗体(美国proteintech公司)。
1.2 细胞培养与转染MKN-45和SGC-7901细胞培养基为RPMI1640培养基,MGC-803和GES-1细胞培养基为DMEM-F12,胎牛血清浓度均为10 %,培养于37 ℃、5% CO2培养箱中。将呈对数生长期的MKN-45细胞以1.0×105个/孔铺至6孔板中,分为对照组(si-NC)和实验组(si-FAM83H-AS1),将NC siRNA和FAM83H-AS1 siRNA与lip2000混匀后加入各组细胞中,放至培养箱中培养。
1.3 qRT-PCR检测FAM83H-AS1的表达胰酶消化离心收集细胞,加入TRIzol试剂裂解细胞,提取细胞中总RNA。按照PrimeScriptTMRT reagent Kit试剂盒将RNA反转录cDNA,并以cDNA为模板,按照SYBR Premix Ex TaqTM qRT-PCR试剂盒配制反应体系进行qRT-PCR,按2步反应进行,即95 ℃预变性5 s,以 95 ℃变性5 s、60 ℃退火30 s进行40个循环。每个反应样品设置3个复孔,获得各样品的循环阈值(threshold cvcle,Ct),以2-ΔΔCt公式计算FAM83H-AS1相对表达量。FAM83H-AS1引物F: 5′-TAGGAAACGAGCGAGCCC-3′, R: 5′- GCTTTGGGTCTCCCCTTCTT-3′。内参GAPDH引物F:5′-GGGAGCCAAAAGGGTCAT-3′,R: 5′-GAGTCCTTCCACGATACCAA-3′。
1.4MTS收集生长状态良好的MKN-45细胞以2 000个/孔铺至96孔板中,分为对照组(si-NC)和实验组(si-FAM83H-AS1),每组设置5个复孔,按上述siRNA转染方法进行转染,分别在转染0、24、48、72 h时,每孔加入20 μl MTS试剂在培养箱中孵育2 h,全波长扫描仪检测490 nm的吸光度(optical density,OD)值。
1.5 平板克隆形成实验收集生长状态良好的MKN-45细胞以300个/孔铺至6孔板中,分为si-NC和si-FAM83H-AS1,每组设置3个复孔,按上述siRNA转染方法进行转染,细胞形成肉眼可见的细胞克隆团时终止培养,PBS洗3次,甲醇固定10 min,结晶紫染色,计数克隆团个数。
1.6 Transwell实验收集6孔板中转染48 h的各组细胞,基础培养基洗3次后细胞计数,1×105个细胞重悬于100 μl基础血清培养基中加至Transwell小室膜上,膜下加入含10%胎牛血清的500 μl培养基,每组设置3个复孔,放置细胞培养箱中培养。12 h后终止培养,将未转移的细胞洗去,甲醇固定10 min,结晶紫染色,显微镜下计数。
1.7 Western blot检测蛋白表达收集6孔板中转染48 h的各组细胞,加入蛋白裂解液,超声裂解10 min,4 ℃高速离心20 min,去除细胞碎片。检测蛋白浓度,加入上样缓冲液煮沸变性,进行电泳分离蛋白(80 V, 2 h),蛋白湿转至PVDF膜上(350 mA, 2 h),5% 脱脂牛奶封闭1 h,4 ℃一抗孵育过夜,室温二抗孵育2 h,ECL超敏化学发光曝光,Image J软件进行蛋白灰度值分析。
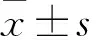
2 结果
2.1 FAM83H-AS1在胃癌细胞系中的表达水平采用qRT-PCR检测FAM83H-AS1在人胃癌细胞系MKN-45、SGC-7901、MGC-803和人永生化正常胃上皮细胞GES-1中的表达情况,FAM83H-AS1在胃癌细胞中的表达高于在人永生化正常胃上皮细胞GES-1中的表达,在MKN-45细胞中的表达最高(P<0.05),见图1。
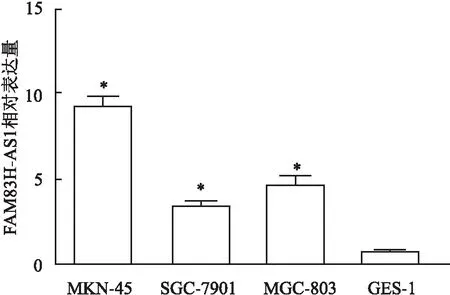
图1 qRT-PCR检测FAM83H-AS1在胃癌细胞系中的表达情况与GES-1比较:*P<0.05
2.2 FAM83H-AS1 siRNA转染效果验证FAM83H-AS1 siRNA干扰MKN-45细胞中FAM83H-AS1的表达效果。与si-NC相比,si-FAM83H-AS1组中FAM83H-AS1相对表达量降低(P<0.05)。FAM83H-AS1 siRNA可以干扰MKN-45细胞中FAM83H-AS1的表达,见图2。
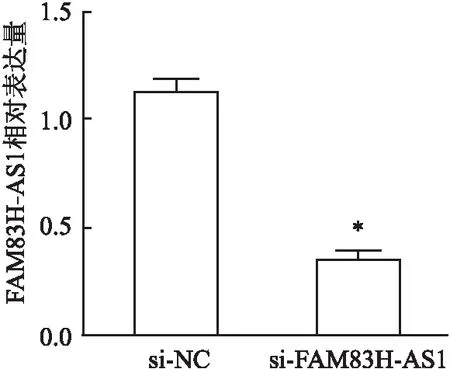
图2 qRT-PCR 验证FAM83H-AS1干扰慢病毒感染效果与si-NC比较:*P<0.05
2.3 流式细胞仪检测细胞周期FAM83H-AS1 siRNA转染胃癌细胞MKN-45 48 h后,与si-NC组相比,si-FAM83H-AS1组细胞阻滞在G0/G1期(P<0.05),见图3。
图3 MTS检测干扰FAM83H-AS1的表达对MKN-45细胞周期的影响与si-NC比较:*P<0.05
2.4 MTS检测细胞增殖能力FAM83H-AS1 siRNA转染胃癌细胞MKN-45 48 h后,MTS实验检测结果显示与si-NC组相比,si-FAM83H-AS1组细胞增殖能力降低(P<0.05),见图4。

图4 MTS检测干扰FAM83H-AS1的表达对MKN-45细胞增殖的影响与si-NC比较:*P<0.05
2.5 平板克隆检测细胞克隆形成平板克隆形成实验检测显示与si-NC组比较,si-FAM83H-AS1组细胞克隆形成能力降低(P<0.05),见图5。
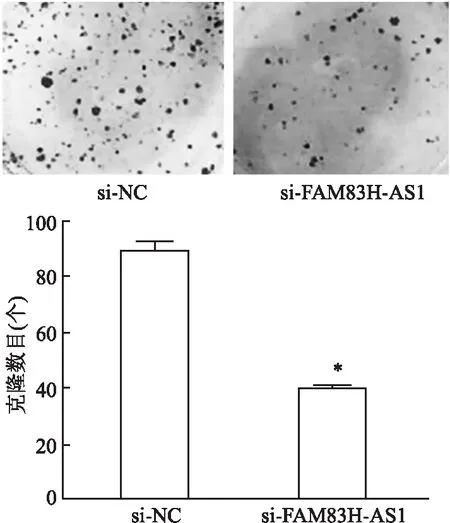
图5 平板克隆实验检测干扰FAM83H-AS1的表达对MKN-45细胞克隆形成能力的影响与si-NC比较:*P<0.05
2.6 Transwell实验检测细胞转移能力FAM83H-AS1 siRNA转染胃癌细胞MKN-45 48 h后Transwell实验检测显示与si-NC组相比,si-FAM83H-AS1组转移能力降低(P<0.05),见图6。

图6 Transwell实验检测干扰FAM83H-AS1的表达对MKN-45细胞转移能力的影响 ×200与si-NC比较:*P<0.05
2.7 FAM83H-AS1对细胞周期蛋白的影响收集转染48 h的各组蛋白,Western blot实验显示与si-NC组相比,si-FAM83H-AS1组细胞中cyclinD1和细胞周期蛋白依赖激酶4(cyclin dependent kinase 4, CDK4)蛋白的表达降低(P<0.05),见图7、表1。
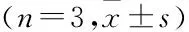
表1 各组细胞中细胞周期蛋白的相对表达量
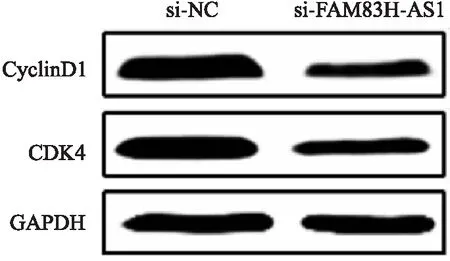
图7 Western blot实验检测干扰FAM83H-AS1的表达对MKN-45细胞中周期蛋白的影响
2.8 FAM83H-AS1对上皮间质转化过程 (epithelial-mesenchymal transition, EMT)的影响收集转染48 h的各组蛋白,Western blot实验显示与si-NC组相比,si-FAM83H-AS1组细胞中EMT标志蛋白E钙黏蛋白蛋白表达增加,N钙黏蛋白和波形蛋白蛋白表达降低(P<0.05),见图8、表2。

图8 western blot实验检测干扰FAM83H-AS1的表达对MKN-45细胞EMT的影响
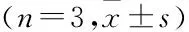
表2 各组细胞中EMT标志蛋白的相对表达量
3 讨论
个体化精准治疗-分子靶向治疗已经应用于其它晚期恶性肿瘤治疗[8],但由于胃癌强大的异质性,胃癌的分子靶向药物目前仍处于临床研究阶段[9],因此在分子水平探索胃癌的进展机制,有助于胃癌治疗靶点的研究。
lncRNA的发现为研究胃癌恶性表型的潜在生物学机制提供了见解,lncRNA是长度>200个核苷酸的RNA,其可通过与蛋白质、RNA和DNA或其他细胞大分子相互作用介导各种细胞生物学过程[3]。胃癌中越来越多表达失调的lncRNA逐渐被发现,其中胃癌组织中FAM83H-AS1表达增加,并且是胃癌总生存率和无进展生存期的危险因素[7]。而研究[5-6]报道FAM83H-AS1在肝细胞肝癌组织、结直肠癌组织、卵巢癌等多种恶性肿瘤中高表达,与肿瘤患者不良病理参数和患者预后不良相关,并且FAM83H-AS1与这些肿瘤的恶性生物学行为密切相关。敲低FAM83H-AS1可以显著抑制肝癌细胞的增殖、迁移和侵袭能力[4]。siRNA抑制细胞中FAM83H-AS1的表达后降低结直肠癌细胞的增殖、迁移并增加凋亡[5]。FAM83H-AS1是否与胃癌增殖转移有关引起了关注,本文在细胞水平检测了FAM83H-AS1在胃癌中的表达情况,结果显示FAM83H-AS1在胃癌细胞中表达上调,并选择其表达最高的MKN-45胃癌细胞系抑制FAM83H-AS1的表达,生物学功能实验显示干扰FAM83H-AS1的表达诱导胃癌细胞阻滞在G0/G1期,并抑制胃癌细胞的增殖活性和转移能力。与Shan et al[10]报道的沉默FAM83H-AS1表达可抑制膀胱癌细胞增殖和迁移,并诱导G0 / G1期细胞周期停滞的研究一致。
FAM83H-AS1在胃癌中为促癌因子,其发挥作用的具体机制仍需进一步研究。细胞周期调控失控导致肿瘤细胞的恶性增殖是肿瘤的重要特征,在生理状态下细胞具有严密的周期调控机制,其中细胞周期蛋白和细胞周期蛋白依赖性激酶发挥关键作用。细胞周期蛋白CyclinD1是原癌基因,由于基因扩增、转录增强和染色体易位等导致其蛋白过度表达,过度表达的CyclinD1与CDK4结合,两者均是周期正性调控因子,促使细胞从G0/G1期进入S期,促进细胞分裂增殖[11]。本文采用Western blot实验检测表明抑制FAM83H-AS1的表达后,胃癌细胞中cyclinD1和CDK4蛋白的表达降低。表明FAM83H-AS1可能通过减少细胞周期cyclinD1和CDK4蛋白的表达抑制细胞的增殖。EMT是上皮细胞转化为具有间质表型的细胞的生物学过程,其在胚胎发育生理过程和肿瘤转移病理过程中均发挥重要作用[12]。研究[13]报道抑制肿瘤细胞的EMT,肿瘤细胞的侵袭转移能力减弱,EMT是肿瘤转移的重要机制之一,Western blot实验结果显示干扰FAM83H-AS1的表达后,胃癌细胞中上皮细胞标志分子E-cadherin蛋白表达增加,而间质细胞标志物分子N-cadherin和Vinmentin蛋白表达降低。表明FAM83H-AS1在胃癌中通过调控EMT促进细胞转移。
