右美托咪定对小鼠成肌细胞C2C12增殖、分化的影响
2020-10-15陈燕燕李兴元唐俊明
陈燕燕,徐 魏,向 力,岳 静,李兴元,王 露,郑 飞 ,唐俊明,4,郑 敏
心力衰竭是一种预后不良的临床综合征,其特征是运动不耐受、早期疲劳和与萎缩相关的骨骼肌病[1],骨骼肌病是心力衰竭患者运动能力受限的主要决定因素[2]。长期以来交感神经系统的激活和副交感神经系统的抑制被认为是心力衰竭临床综合征的表现[3]。有研究[1]表明交感神经长期过度激活会导致心力衰竭患者诱发骨骼肌病,但相关机制知之甚少。课题组之前已证实异丙肾上腺素的持续刺激通过激活β1受体并失活β2受体抑制小鼠成肌细胞C2C12的分化、融合和肌管形成[4],但是否α受体也参与了交感神经长期过度激活诱发骨骼肌病的病理过程,未有研究涉及。该研究应用选择性α2受体激动剂—右美托咪定刺激C2C12细胞,来揭示交感神经长期过度激活与C2C12细胞增殖、分化和肌管形成的关系。
1 材料与方法
1.1 材料C2C12成肌细胞系(简称C2C12细胞)购自中国科学院上海细胞库;胎牛血清购自杭州四季青生物工程材料有限公司;马血清购自美国Gibco公司;0.25%胰蛋白酶购自武汉安特捷生物技术有限公司;荧光倒置显微镜购自日本尼康公司;高糖DMEM购自美国Gibco公司。
1.2 方法
1.2.1CCK-8法检测右美托咪定对C2C12细胞增殖的影响 取1 ml待传代的C2C12细胞悬液接种于75 cm2的培养皿中,加入含10%胎牛血清的高糖培养基(增殖培养基),调整细胞密度为 1×105/ml,将C2C12细胞接种于4个96孔板中,每个96孔板接种30个孔,每孔接种100 μl细胞悬液,将全部96孔板置于37 ℃、5% CO2、饱和湿度细胞培养箱中培养。待C2C12细胞增殖培养24 h后,将增殖培养基换成无血清高糖培养基,继续培养24 h。每个96孔板的30个孔分为6个实验分组,每组5个复孔,6个实验分组分别为对照组(右美托咪定0 mmol/L)和右美托咪定5个浓度梯度组(5、10、20、40、80 mmol/L)。将无血清高糖培养基换成增殖培养基,并按分组分别加入不同浓度的右美托咪定,4个96孔板分别培养12、24、48、72 h后,向每孔加入10 μl CCK-8溶液,置于培养箱中培养0.5 h,然后用酶标仪测定每孔细胞在450 nm处的吸光度值。
1.2.2C2C12细胞分化体系的建立 C2C12细胞常规复苏并接种于75 cm2的培养皿中, 培养条件为含10%胎牛血清的高糖DMEM培养基(增殖培养基),置于37 ℃、5% CO2、饱和湿度细胞培养箱中培养。细胞增殖融合达80%~90%时,按1 ∶3传代,传代的C2C12细胞按上述条件继续培养, 以备后续实验用。C2C12细胞在增殖培养基中培养, 待细胞增殖融合至70%时, 换用含2%马血清的高糖DMEM培养基(分化培养基)诱导C2C12细胞分化。每隔1 d换1次分化培养基, 同时每天在显微镜下观察细胞的分化情况。
1.2.3实验分组及给药方式
1.2.3.1实验分组 右美托咪定按浓度梯度分成6组:对照组(0 mmol/L),实验组(5、10、20、40、80 mmol/L)。单次给药和连续单次给药均按这6组浓度梯度给药。
1.2.3.2右美托咪定的给药方式 单次给药:在增殖培养基中C2C12细胞增殖融合至70%时, 换成分化培养基诱导C2C12细胞分化, 此时加入右美托咪定, 随后不再加入右美托咪定,并每隔1 d换分化培养基; 连续培养6 d。连续单次给药: 在增殖培养基中C2C12细胞增殖融合至70%时, 换成分化培养基诱导C2C12细胞分化, 此时加入右美托咪定, 随后每天加入右美托咪定,并每隔1 d换分化培养基,连续培养6 d。
1.2.4细胞免疫荧光化学检测 C2C12细胞按每孔1.25×104/ml密度接种于24孔板中, 待细胞贴壁并增殖融合至70%时,换成分化培养基诱导C2C12细胞分化, 按上述实验分组分别单次给药和连续单次给药,连续培养6 d,然后弃分化培养基,1×PBS连续清洗3次,4%的多聚甲醛固定15 min, 再用1×PBS振荡清洗3次, 每次5 min, 然后用5%的山羊血清和0.3%Triton X-100室温封闭1 h。封闭后的细胞每孔分别加入抗体稀释液稀释的肌球蛋白重链(myosin heavy chain,MYH)(货号:sc-376157, 抗体稀释:1 ∶100,美国Santa Cruze公司),肌细胞增强因子2C(myocyte enhancer factor 2C,MEF2C)(货号:#5030,抗体稀释:1 ∶400,美国Cell Signaling Technology公司),肌细胞生成蛋白(myogenin,MyoG)(货号:sc-12732,抗体稀释:1 ∶50,美国Santa Cruze公司),其中MYH和MEF2C加入同一孔中,进行荧光双染,MyoG加入不同孔中,进行荧光单染,将24孔板放入4 ℃冰箱孵育过夜。然后用1×PBS振荡清洗3次, 每次5 min,在加了MYH和MEF2C荧光一抗的孔中加入抗兔的荧光二抗(1 ∶300), 在加了MyoG的荧光一抗的孔中加入抗鼠的荧光二抗(1 ∶300),室温孵育1 h, 再用1×PBS振荡清洗3次, 每次5 min,后加入DAPI 200 μl, 避光室温15 min,再用1×PBS振荡清洗3遍, 每次5 min,然后在倒置荧光显微镜下观察并摄片。
2 结果
2.1 α2肾上腺素能受体在C2C12细胞的表达特征免疫荧光结果显示, 在C2C12细胞的增殖、分化阶段呈现出α2肾上腺素能受体阳性的特征(图1)。
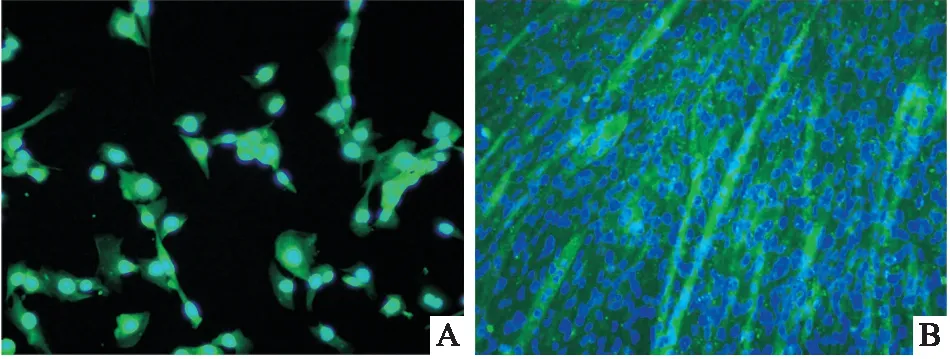
图1 α2肾上腺素能受体在增殖和分化C2C12细胞的表达特征 ×200A: 增殖阶段;B:分化阶段
2.2 右美托咪定对C2C12细胞增殖的影响CCK-8结果显示,第12、24、48、72 h分组中,与对照组相比,除第12 h分组中,只右美托咪定(40、80 mmol/L)两个高浓度组呈抑制C2C12细胞增殖外,其他3个分组中,不同浓度的右美托咪定均抑制C2C12细胞的增殖,且随着浓度的增加,抑制作用越明显(图2)。

图2 CCK-8法检测不同浓度右美托咪定对C2C12细胞增殖的影响与对照组比较:*P<0.05
2.3 C2C12细胞分化体系的建立C2C12细胞经常规传代后接种在75 cm2的培养皿中, 在倒置显微镜下观察, 细胞贴壁铺开后多呈梭形或有突起,核为椭圆形, 单核, 核仁明显。待细胞增殖至70%时, 更换为分化培养基诱导C2C12细胞分化。分化的细胞呈现多核、串珠样排列, 并形成肌管。第0、2、4、6天相比,随着时间的推移肌管细胞核融合数目逐渐增多,且在分化第6天达到高峰(图3)。
2.4 不同给药方式下,右美托咪定对C2C12细胞分化的影响免疫荧光结果显示,不论单次给药还是连续单次给药,与对照组相比,右美托咪定均呈现抑制肌管形成(MYH)和MEF2C、MyoG表达的现象,但连续单次给药组抑制肌管形成(MYH)和MEF2C、MyoG表达的作用比单次给药组显著(图4、5、6)。 将肌管分成细胞核融合数目为3~5、5~10、>10的3个不同分组,显示在较高浓度组(20、40、80 mmol/L组),连续单次给药抑制肌管形成的作用强于单次给药,3个肌管细胞核融合数目分组均抑制,而单次给药只在细胞核融合数目>10组抑制作用差异有统计学意义。其中,肌管细胞核融合的3个分组中,右美托咪定(80 mmol/L)组与对照组相比,单次给药组:F=1.30,P<0.05;F=2.26,P<0.5;F=8.55,P<0.05;连续单次给药组:F=25.83,P<0.05;F=9.00,P<0.05;F=1.45,P<0.05(图4、5)。

图4 单次给予不同浓度右美托咪定对C2C12细胞分化、融合为多细胞核的肌管数和MEF2C表达的影响 ×200A: 单次给不同浓度右美托咪定逐渐抑制C2C12细胞分化的肌管形成(MYH)和MEF2C表达的免疫荧光细胞化学染色; B~D:单次给不同浓度右美托咪定对C2C12细胞分化为含有不同数目细胞核的肌管数的影响;绿色:MYH阳性;红色:MEF2C阳性;蓝色:DAPI染的细胞核;与对照组比较:*P<0.05
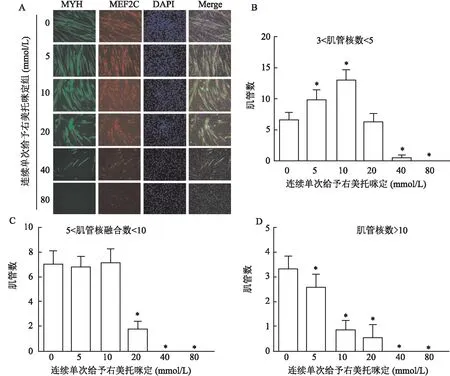
图5 连续单次给予不同浓度右美托咪定对C2C12细胞分化、融合为多细胞核的肌管数和MEF2C表达的影响 ×200A:连续单次给不同浓度右美托咪定逐渐抑制C2C12细胞分化的肌管形成(MYH)和MEF2C表达的免疫荧光细胞化学染色;B~D:连续单次给不同浓度右美托咪定对C2C12细胞分化为含有不同数目细胞核的肌管数的影响;绿色:MYH阳性;红色:MEF2C阳性;蓝色:DAPI染的细胞核;与对照组比较:*P<0.05

图6 单次和连续单次给予不同浓度右美托咪定对C2C12细胞分化的MyoG表达的影响 ×200A: 单次给不同浓度右美托咪定逐渐抑制C2C12细胞分化的MyoG表达的免疫荧光细胞化学染色; B:连续单次给不同浓度右美托咪定逐渐抑制C2C12细胞分化的MyoG表达的免疫荧光细胞化学染色;绿色:MyoG阳性;蓝色:DAPI染的细胞核
2.5 不同分化时间,右美托咪定对C2C12细胞分化的影响免疫荧光结果显示,右美托咪定(20 mmol/L)组与对照组相比,在C2C12细胞分化的第2、4、6天均呈现右美托咪定抑制肌管形成(MYH)和MEF2C、MyoG表达的现象,且随时间的延长,抑制作用越明显(图7)。
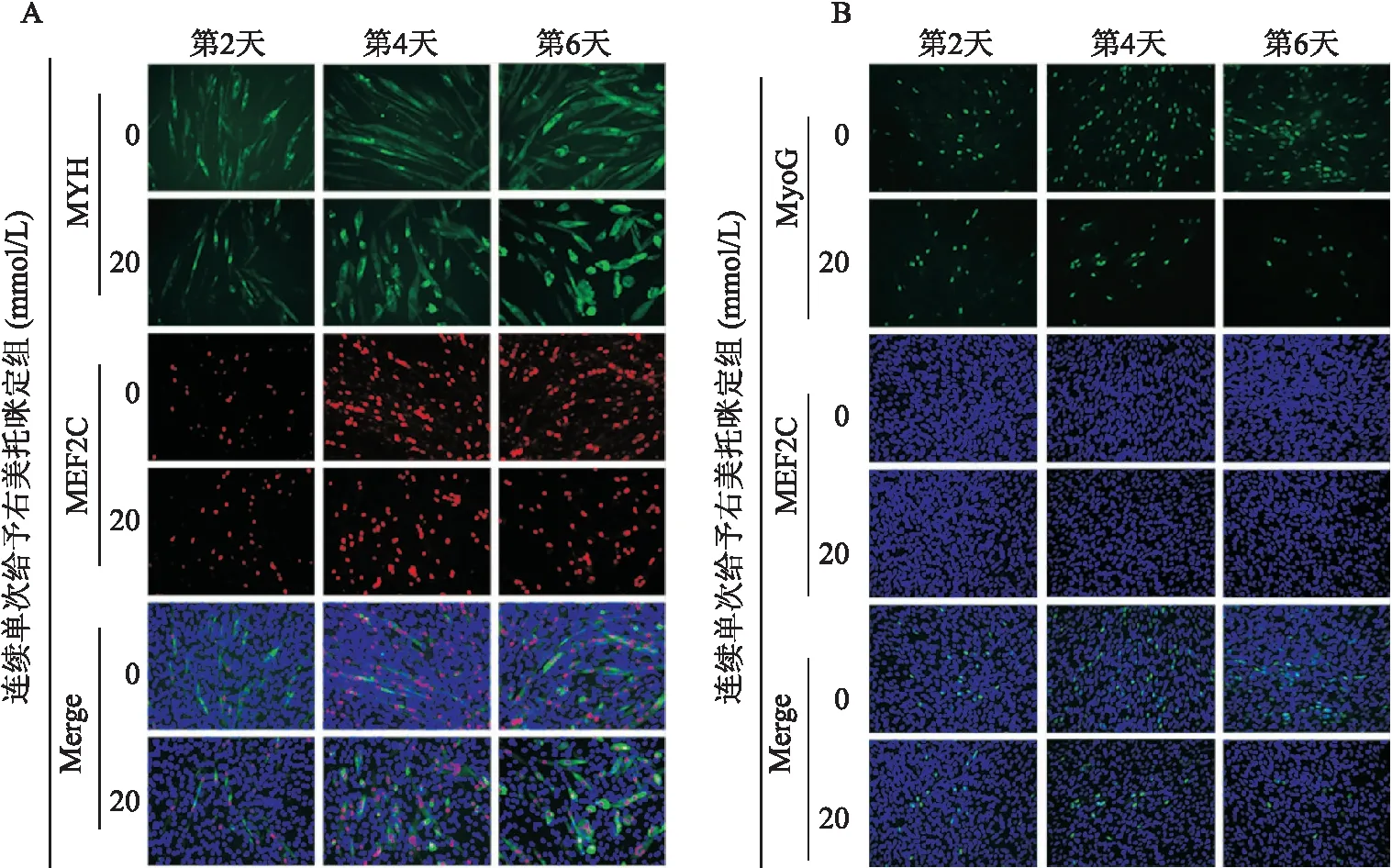
图7 连续单次给予右美托咪定(20 mmol/L)时间依赖性抑制C2C12细胞分化、融合、肌管形成和MEF2C、MyoG的表达 ×200A:用免疫荧光染色法检测不给予或连续单次给予右美托咪定(20 mmol/L)后C2C12细胞分化第2、4、6天的肌管形成(MYH)和MEF2C表达;绿色:MYH阳性;红色:MEF2C阳性;蓝色:DAPI染的细胞核;B:用免疫荧光染色法检测不给予或连续单次给予右美托咪定(20 mmol/L)后C2C12细胞分化第2、4、6天的MyoG表达;绿色:MyoG阳性;蓝色:DAPI染的细胞核
3 讨论
本研究利用国内外通用的C2C12细胞作为研究对象,用免疫荧光的方法首次证实了C2C12细胞在增殖、分化阶段均有α2受体的表达,提示交感神经过度激活分泌的儿茶酚胺可能通过与骨骼肌上的α2受体结合而发挥作用。在增殖阶段,用CCK-8法证实了右美托咪定在C2C12细胞增殖的第12、24、48、72 h均能抑制其增殖,且有浓度依赖性,说明交感神经过度激活可能通过抑制成肌细胞的增殖而导致骨骼肌萎缩。在分化阶段,利用C2C12细胞建立了骨骼肌细胞的分化体系, 免疫荧光结果证实连续单次给药,与对照组相比,不同浓度右美托咪定均抑制C2C12的分化和肌管的形成,且随着浓度的增加,抑制作用越明显;而单次给药,只有在高浓度组,才有明显的抑制作用。而且在连续单次给药组,C2C12细胞分化进而导致多细胞融合形成肌管的能力随着浓度的增加而逐渐降低, 这与临床交感神经长期过度激活造成骨骼肌萎缩的临床表现一致。所以连续单次给予右美托咪定建立模拟机体交感神经长期过度激活造成骨骼肌萎缩的模型更接近临床,且更有临床意义。
骨骼肌再生是一个高度复杂的过程,是由肌肉特异性调节转录因子(myogenic regulatory factors,Mrfs)家族和MEF2家族共同参与的[5]。Mrfs家族包括肌原性分化抗原(MyoD)、MyoG、肌源性因子5(Myf5)和肌源性调节因子4(Mrf4);MEF2家族包括MEF2A、-B、-C and -D,这两类转录因子直接相互作用,为骨骼肌基因的激活建立了独特的转录密码[6]。其中MyoG的表达发生在肌管形成开始时,是导致C2C12细胞融合的关键因素[7];而激活的MEF2C诱导并加强C2C12细胞的分化[6,8]。
本研究同时分析了右美托咪定对C2C12细胞分化过程中MyoG和MEF2C表达的影响。结果发现右美托咪定抑制MEF2C和MyoG表达的作用与抑制C2C12细胞分化、融合及肌管形成(MYH)和的作用相一致,同样具有浓度依赖性,同样是连续单次给药比单次给药抑制作用明显,提示右美托咪定抑制肌管形成(MYH)与抑制MEF2C、MyoG的表达有关。
由于连续单次给药组的右美托咪定(20 mmol/L)抑制C2C12细胞的肌管形成,但不影响C2C12细胞的数量,故利用免疫荧光分别测定对照组和连续单次给药的右美托咪定(20 mmol/L)组中C2C12细胞分化第2、4、6天的肌管形成情况和MEF2C、MyoG的表达水平,结果显示,与对照组相比,右美托咪定(20 mmol/L)组抑制C2C12细胞分化第2、4、6天的肌管形成(MYH)和MEF2C、MyoG的表达,且随着时间的延长,抑制作用越明显,从而进一步验证了右美托咪定对C2C12细胞从分化到肌管形成的整个过程均有抑制作用。
综上,本研究首次证实了C2C12细胞在增殖、分化阶段均有α2受体的表达,且右美托咪定可能通过与C2C12细胞上的α2受体结合而抑制C2C12细胞的增殖、分化和肌管形成,而MEF2C和MyoG表达的变化特征说明右美托咪定通过抑制MEF2C和MyoG的表达而抑制C2C12细胞的分化和肌管形成,但右美托咪定对C2C12细胞抑制作用的具体分子机制在本研究中并未涉及,需进一步探究。本研究首次证实了心力衰竭患者交感神经长期过度激活导致的骨骼肌病可能涉及的新机制,为临床骨骼肌病的发病机制提供了实验依据。
