胰腺导管腺癌中KIAA1199基因的表达及临床意义
2020-10-14杜少帅林先盛
杜少帅,林先盛,黄 强
胰腺导管腺癌(pancreatic ductal adenocarcinoma,PDAC)是一种预后极差,且恶性程度极高的恶性肿瘤,5年生存率不足5%[1],是最具侵略性的肿瘤之一,在西方国家的癌症相关死亡中排名第四[2-4]。导致预后不佳的主要原因之一与它对胰腺周围结构的快速侵袭以及发生淋巴结和(或)远处器官转移有关。多数患者确诊时已经出现远处器官的转移,因此也就丧失了外科治疗的最佳时机。因此,早发现、早诊断、早治疗对诊治PDAC极为重要。目前已有多项研究[5]表明KIAA1199基因与多种恶性肿瘤的发展、转移密切相关,属于一种重要的促癌基因,包括胃癌、乳腺癌、口腔鳞癌、前列腺癌和大肠肿瘤等。然而,到目前为止,关于KIAA1199在PDAC中的表达情况及其临床意义的研究甚少。该研究主要通过免疫组织化学染色方法检测KIAA1199基因在人类PDAC组织及相应癌旁组织中的表达情况,并分析其与肿瘤进展及患者术后生存时间的关系,同时通过Western blot和qRT-PCR实验进一步检测KIAA1199及其mRNA的表达情况。
1 材料与方法
1.1 病例资料本研究所需临床病例资料均取自安徽医科大学附属省立医院病案室,所需预后生存期等资料通过随访获得。其中,临床病例资料包含了60例PDAC患者的性别、年龄、肿瘤位置、组织学分级、TNM分期、神经周围浸润和淋巴结转移。最终统计结果为:男性45例,女性15例;年龄≤60岁有24例,>60岁的有36例;肿瘤位于胰头处38例,位于胰体尾的22例;组织高分化8例,中低分化52例;TNM分期中Ⅰ+Ⅱ期者47例,Ⅲ+Ⅳ期者13例;发生神经浸润的24例,无神经浸润36例;淋巴结转移者23例,未发生淋巴结转移者37例。本研究中预后等资料则通过患者入院所留联系电话进行随访或者门诊随访的方式获得,随访时间截止2019年12月,收集患者的总生存期(overall survival,OS)和无病生存期(disease-free survival, DFS)等资料。自手术当日至患者因该病死亡之间的时间称为OS;自患者行根治术当日至患者复发PDAC之间的时间称为DFS;若患者截止2019年12月仍然存活或者无复发,则称为数据删失。随访内容包含:患者术后病史及相关体格检查,血清肿瘤标志物(CA19-9、CA50、CEA)检查,腹部增强CT检查及核磁共振检查等。同时,本研究从安徽省肝胆胰重点实验室标本库中选取符合纳入标准的新鲜冰冻PDAC组织及相应的癌旁组织各10例,用于Western blot及qRT-PCR实验。
1.2 试剂与方法
1.2.1主要试剂 KIAA1199兔抗人多克隆抗体购自武汉Proteintech生物公司;通用山羊抗兔/鼠二抗PV 6000购自北京中杉金桥生物技术有限公司;SP试剂盒、DAB显色试剂盒及抗体稀释液购自北京中杉金桥生物技术有限公司;RIPA蛋白裂解液、BCA试剂盒及β-actin抗体购自碧云天生物技术有限公司;TRIzol和逆转录试剂盒购自美国Thermo Fisher公司;qRT-PCR引物购自上海生工生物公司。
1.2.2免疫组织化学染色法 打开电烤箱,设定温度60 ℃,待烤箱达到设定温度后,将整齐摆放在染色架上的切片放入烤箱中,烘烤30 min左右。从烤箱中取出切片,对石蜡切片进行脱蜡,用二甲苯脱水,再依次放入浓度为100%、95%、75%的乙醇溶液中进行水合,各浸泡5 min后取出。在高压蒸汽锅中放置柠檬酸盐缓冲液,使之浸没切片,进行高压抗原修复。自然冷却后,使用PBS浸洗切片,然后使用3% H2O2溶液孵育切片10 min,阻断内源性过氧化物酶活性后,PBS浸洗切片。将KIAA1199和抗体稀释液按照1 ∶100的比例进行稀释,得到稀释的兔抗人KIAA1199多克隆抗体,把稀释后的一抗均匀地滴加在切片组织表面,后置入4 ℃冰箱中过夜孵育,注意不要倾斜导致抗体流失。次日,PBS浸洗切片,滴加二抗,室温下孵育30~40 min后使用PBS浸洗。配制DAB显色液,放置载玻片于显微镜下,观察染色并及时终止。最后,使用苏木精复染,乙醇脱水,树胶封片,显微镜检查并拍照记录。
1.2.3免疫印迹法 RIPA试剂盒从PDAC组织和癌旁组织中提取总蛋白,并使用BCA试剂盒确定总蛋白浓度。10% SDS-PAGE凝胶电泳,半干转移法将蛋白质转移到PVDF膜上,使用5%脱脂奶粉封闭1 h,一抗(1 ∶1 000)在4 ℃下孵育过夜。每次用TBST洗涤3次,每次5 min,添加二抗(1 ∶5 000),在摇床上于室温下孵育1 h,然后用TBST洗涤膜3次,每次5 min,使用Image-J软件分析目标蛋白和内部参考蛋白的灰度值,根据目标蛋白和内部参考的灰度值之比计算相对表达量。
1.2.4实时荧光定量PCR 使用TRIzol试剂盒从PDAC组织和癌旁组织中分离总RNA。使用反转录试剂盒将总RNA样品反转录为cDNA。使用实时PCR系统进行PCR反应。目标基因KIAA1199的引物序列为:(F)5′-AGGCGTGACACTGTCTCGGCTACAG-3′,(R)5′-CCACTCCACGTCTTGAACCCAC-3′;内参蛋白β-actin的序列为:(F)5′-AGCGAGCATCCCCCAAAGTT-3′,(R)5′-GGGCACGAAGGCTCATCATT-3′。设置反应条件为95 ℃预变性60 s,95 ℃变性5 s,60 ℃退火30 s,设置40个循环。通过2-ΔΔCt法分析表达水平。
1.3 免疫组织化学结果分析染色结果判定[6]依据显微镜下可以观察到黄色或者棕黄色颗粒主要位于PDAC细胞的细胞质中。最后的评分通常按染色强弱等级和染色细胞阳性百分比两种方式进行。未染色的记为0分,染色淡黄或者阳性细胞百分比小于10%的记为1分,染色为黄色或者阳性百分比大于10%小于50%的记为2分,染色棕黄或阳性细胞百分比大于50%的统一记为3分,两项结果之和即为总分。最终总分大于3分记为阳性表达或高表达。所有切片均由两位高年资病理科医师独立阅片进行打分,如产生异议,由两名医师讨论分析最后打分。
1.4 随访本研究随访方式主要为电话随访和(或)门诊随访,随访终止时间为患者因疾病死亡或本研究截止日,随访发现其中失访患者有2例(1例患者KIAA1199高表达,另1例患者KIAA1199低表达),随访率为97%。为了研究分析PDAC患者中KIAA1199基因的表达与患者预后生存时间是否有关系,通过Kaplan-Meier法来绘制患者的生存曲线图。
1.5 统计学处理采用SPSS 21.0软件和Graph Prism软件进行统计分析。通过Kaplan-Meier方法绘制患者的生存曲线,通过Log-Rank检验对组间差异进行分析。分类变量使用χ2检验;定量资料使用t检验进行统计,P<0.05为差异有统计学意义。
2 结果
2.1 KIAA1199基因在PDAC组织及癌旁组织中的表达通过免疫组织化学染色方法检测PDAC组织和癌旁组织中的KIAA1199基因的表达,结果显示:与癌组织(42/60,70%)相比,癌旁组织中KIAA1199基因的表达较低(5/20,25%),差异有统计学意义(P<0.05),见表1、图1。
2.2 KIAA1199基因的表达与患者临床病理特征的关系进一步评估PDAC患者的临床特征与组织中KIAA1199表达之间的相关性。如表2所示,KIAA1199基因的表达与PDAC的病理分化程度(P=0.010)、TNM分期(P=0.047)、神经浸润(P=0.016)、淋巴结转移(P<0.05)有关,差异有统计学意义(P<0.05)。而与患者的性别(P=0.515)、年龄(P=0.206)、肿瘤位置(P=0.726)并无显著相关性(P>0.05)。

表1 KIAA1199在PDAC组织和癌旁组织中的表达(n)
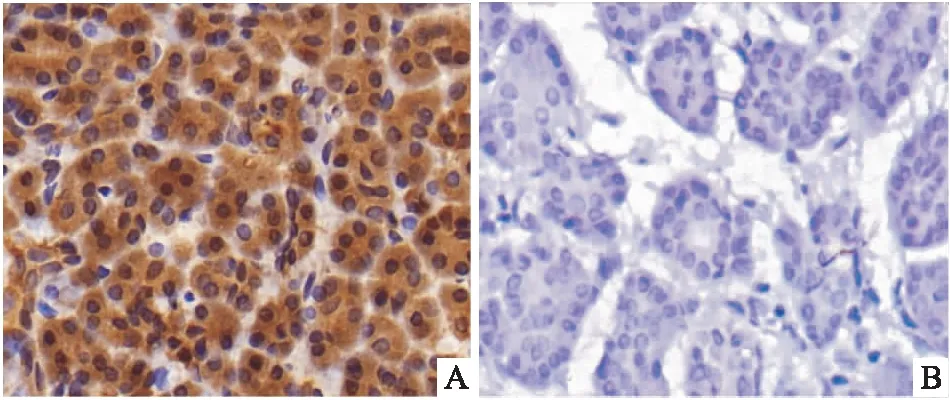
图1 KIAA1199在PDAC和癌旁组织中的表达 ×400
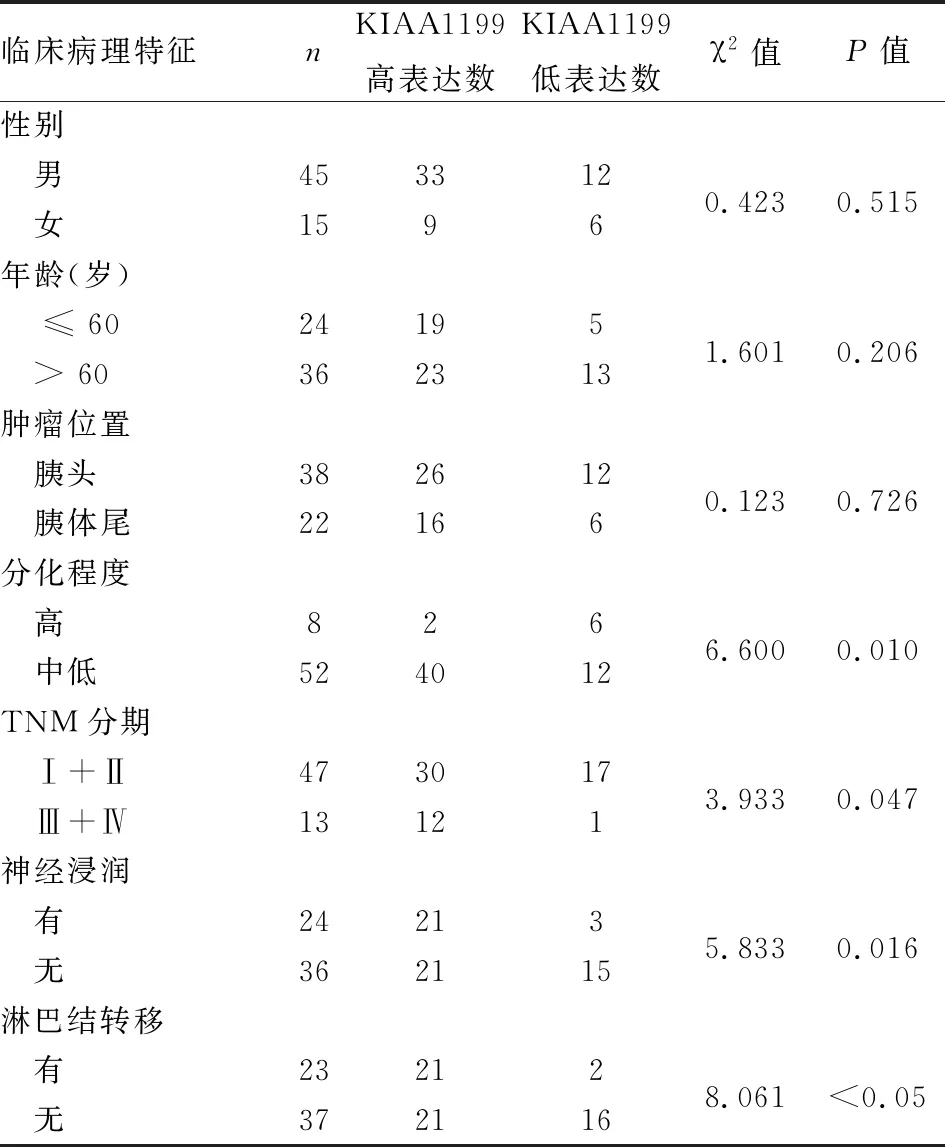
表2 KIAA1199的表达与PDAC临床病理特征的关系
2.3 KIAA1199的表达与PDAC患者生存期的关系Kaplan-Meier生存分析显示KIAA1199阳性患者的OS中位生存时间为13.5个月,阴性表达的OS中位生存时间为17个月;KIAA1199阳性患者DFS中位生存时间为10个月,而阴性表达患者的DFS的中位生存时间为13.5个月,差异有统计学意义(P<0.05)。见图2。
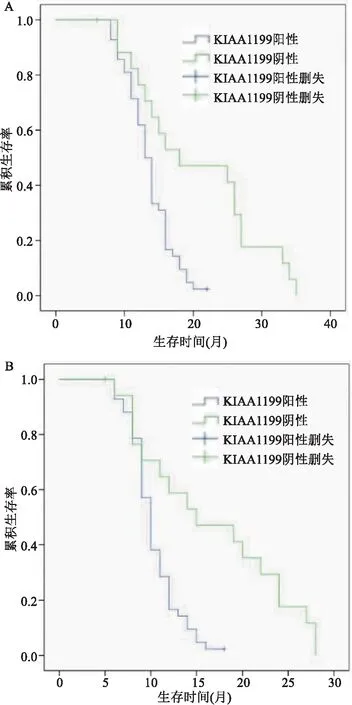
图2 Kaplan-Meier分析KIAA1199的表达与OS、DFS的关系
2.4 Western blot检测KIAA1199的表达通过Western blot实验检测10对PDAC组织和癌旁组织中KIAA1199蛋白的相对表达量。结果显示,KIAA1199蛋白在PDAC患者组织中较癌旁组织明显高表达。其中,KIAA1199在癌组织中的表达量为(1.130±0.079),在癌旁组织中的相对表达量为(0.501±0.033),差异有统计学意义(t=6.376,P=0.000 1),如图3。
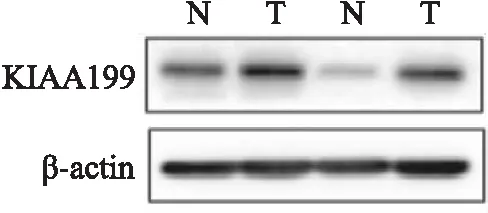
图3 Western blot 检测KIAA1199在PDAC和癌旁组织中的表达
2.5 qRT-PCR检测KIAA1199的表达qRT-PCR实验检测KIAA1199在10对PDAC患者组织和癌旁组织中的mRNA表达量,结果显示,PDAC组(9.10±0.55)中KIAA1199 mRNA的表达水平明显高于癌旁组(1.87±0.13),差异有统计学意义(t=11.99,P<0.000 1)。
3 讨论
PDAC是一种恶性程度高,预后不良的消化系统肿瘤。目前,尽管PDAC的检测和治疗取得了一些进展,但大部分患者确诊时已为晚期,无法进行手术切除。更不幸的是,PDAC对大多数化疗药物的反应很差。因此,对胰腺肿瘤发生发展的生物学机制的研究非常重要。KIAA1199是一种分子量为150 ku的蛋白质[7],位于染色体上KIAA基因群上游15q 25.1的染色体条带上[8],编码包含G8结构域的蛋白质的1 361个氨基酸,该结构域由8个甘氨酸残基和5个β链对组成,G8域的功能未知[9-10]。KIAA1199具有N端信号肽和信号肽切割位点,这表明KIAA1199可能具有细胞外分泌或膜靶向特性。KIAA1199与肿瘤的发展、转移密切相关,属于一种促癌基因。Suh et al[11]研究发现KIAA1199在PDAC细胞和胰腺癌早期病变(胰腺上皮内瘤变)中特异表达,因此联合检测KIAA1199和CA 19-9可能有助于早期PDAC的筛查。Kohi et al[2]通过敲低siRNA的表达,证实KIAA1199高表达提升了胰腺癌细胞增殖、迁移和侵袭的能力。Matsuzaki et al[5]采用qRT-PCR实验检测KIAA1199 mRNA的表达,并从临床和病理因素的角度分析KIAA1199 mRNA的表达状况,进行单因素和多因素分析,发现KIAA1199在胃癌中高表达,与其预后和淋巴结转移有关。也有研究[12]证实KIAA1199在肝细胞癌中过表达,不仅促进了肝组织上皮间充质转化(EMT)这一发生于肿瘤细胞远处转移过程中的早期事件,更进一步导致严重的临床病理症状,是肝细胞癌预后不良的标志。另有研究[13]发现KIAA1199可通过PP2A/stathmin通路调节破坏大肠癌细胞微管稳定,促进大肠癌细胞的转移,证实了KIAA1199的过表达会加速大肠癌细胞的EMT进程。
本研究探讨了KIAA1199在PDAC组织中的表达及其与PDAC患者的临床病理特征的关系。结果表明,与癌旁组织相比,PDAC组织中KIAA1199表达上调。并且KIAA1199的表达与PDAC患者的TNM分期、组织学分级、神经浸润和淋巴结转移等因素紧密相关。此外,生存分析也显示KIAA1199在PDAC组织中的高表达与不良预后相关,表明它可能是PDAC患者不良预后的独立预测因子。
综上,该研究认为KIAA1199基因在PDAC组织存在高表达情况,并与PDAC的病理分化程度、TNM分期、神经是否浸润、淋巴结有无转移及预后生存时间密切相关。作为单一的较小样本的回顾性研究,该研究尚存一些不可避免的局限性,还需更完善的实验设计方法和进一步的前瞻性研究来对目前的研究成果进行补充。总之,该研究证实KIAA1199基因在PDAC组织存在高表达情况,并与PDAC患者的临床病理因素和预后息息相关,有望作为预测PDAC患者肿瘤进展及预后的有效因子。
