miR-214-3p对人卵巢癌细胞顺铂耐药及EGR1表达的影响
2020-10-14石小燕
李 艳, 黄 萱, 肖 兰, 张 英, 陈 颍, 石小燕
卵巢癌是妇科三大恶性肿瘤之一,死亡率居妇科恶性肿瘤之首[1]。miRNA是一类长约20~25个核苷酸的内源性非编码单链RNA。miRNA通过和靶基因mRNA碱基配对,促使靶mRNA降解或阻遏靶mRNA翻译,已有研究[2]表明miRNA在增殖、凋亡、侵袭转移和耐药中发挥重要作用。miR-214位于人1号染色体,由Dicer酶将其环状前体剪切形成miR-214-3p以及miR-214-5p,在多种癌症中表达异常,可与多种癌基因及抑癌基因相互作用[3]。早期生长反应因子1(early growth response protein 1,EGR1)属于早期生长反应基因家族[4],可对生长因子的刺激做出快速反应,该基因在中枢神经系统、内分泌系统及肿瘤等疾病中均起着重要作用。该研究用脂质体瞬时转染上调/下调miR-214-3p在人卵巢癌细胞中表达,通过细胞增殖、药物敏感性及凋亡实验等探讨miR-214-3p对人卵巢癌细胞顺铂敏感性影响,并分析EGR1作为其潜在靶点的可能。
1 材料与方法
1.1 细胞株与试剂细胞株:人卵巢癌顺铂耐药细胞株C13K及顺铂敏感株OV2008为本室保存。顺铂购自山东齐鲁制药有限公司;Lipofectamine 2000购自美国Invitrogen公司;Annexin V-FITC试剂盒购自南京凯基生物技术有限公司;SYBR Green Master Mix及反转录试剂盒购自日本TaKaRa公司;EGR1鼠抗购自英国Abcam公司;着色性干皮病基因 (xeroderma pigmentosum,XPD)多克隆兔抗购自美国CST公司;CCK-8检测试剂盒购自上海碧云天公司;miR-214-3p mimics(模拟物)、miR-214-3p inhibitor(抑制剂)、negative control (NC),U6及miR-214-3p茎环引物均购自上海吉玛公司,相关序列见表1;流式细胞仪购自美国Becton- Dickinson公司。

表1 miR-214-3p mimics、inhibitor、NC、EGR1及U6序列
1.2 方法
1.2.1细胞培养 C13K和OV2008细胞于含15%小牛血清1640培养液,5% CO2浓度、饱和湿度及37 ℃培养条件下孵育培养。
1.2.2细胞转染及分组 取对数生长期细胞,弃上层培养液,C13K和OV2008细胞分别转染miR-214-3p mimics(mimics组)、miR-214-3p inhibitor(inhibitor组)以及miR-214-3p negative control(NC组)试剂,未转染OV2008及C13K细胞为空白对照组。细胞分组:OV2008空白对照组、OV2008 NC组、OV2008 inhibitor组、C13K空白对照组、C13K NC组及C13K mimics组;按说明书将miR-214-3p mimics、inhibitor、mimics及inhibitor各自NC稀释至20 μmol/L,4 ℃保存备用。具体操作按Lipofectamine 2000说明书进行。6 h后PBS冲洗2遍,更换培养基,每孔加入含15%小牛血清1640培养液2 ml继续培养48 h。
1.2.3CCK-8检测细胞存活率及顺铂IC50以1×104/ml细胞浓度铺96孔板,每孔100 μl,继续培养24 h。IC50检测:弃旧培养基,DDP(0~200 μmol/L)培养24 h,更换新鲜培养基,加入10 μl的CCK-8,继续培养4 h,检测450 nm波长各孔细胞吸光度值(optical density, OD),计算细胞生长抑制率,抑制率 (%)= (1-实验组OD值/对照组OD值)×100%,根据细胞生长抑制率计算顺铂对细胞IC50。细胞增殖:DDP(60 μmol/L)培养24 h,加入10 μl的CCK-8,再培养4 h,450 nm波长处检测各孔OD值。实验均重复3次,取平均值。
1.2.4流式细胞术检测细胞凋亡 顺铂10 μmol/L及顺铂50 μmol/L分别作用于各组OV2008和C13K细胞,24 h后0.25%胰酶消化细胞,0.01 mol/L冰PBS 0.5 ml重悬细胞,1 000 r/min离心5 min去培养基,PBS洗涤1次,去上清液,收集细胞。200 μl Binding Buffer重悬细胞,加入10 μl Annexin V-FITC和5 μl PI,室温中避光孵育30 min,加入300 μl Binding Buffer,1 h内上机检测细胞凋亡,Cell Quest软件分析,实验重复3次。
1.2.5实时荧光定量PCR检测 RNA试剂盒提取细胞RNA,反转录合成cDNA。以U6为内参照,每组设3个复孔。PCR反应在ABI7300反应平台上进行,以2-△△Ct法计算各组细胞中miR-214-3p及EGR1 mRNA相对量,实验重复3次。
1.2.6免疫印迹 以GAPDH水平作为等量蛋白质上样对照,取50 μg蛋白质样品进行SDS-PAGE电泳,转至硝酸纤维膜上;室温封闭2 h,含0.05% Tween-20的TBS缓冲液(TBST)漂洗3次,每次10 min;加入相应EGR1一抗(1 ∶1 000)及XPD一抗(1 ∶1 000),4 ℃孵育过夜,TBST漂洗3次后加入相应辣根过氧化物酶标记二抗(1 ∶5 000),37 ℃摇床温育2 h,增强化学发光显色系统显色,凝胶分析系统分析蛋白表达。
2 结果
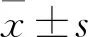
2.1 两株卵巢癌细胞miR-214-3p相对表达实时定量PCR(图1)显示miR-214-3p在OV2008中表达显著高于其顺铂耐药细胞株C13K(F=267.915,P<0.001);miR-214-3p相对量在OV2008 NC组和OV2008 inhibitor组表达分别为(10.6±1.87)和(0.33±0.16),OV2008 inhibitor组与其空白对照组比较miR-214-3p相对量减少(F=79.517,P<0.001);C13K NC组及C13K mimics组miR-214-3p相对量分别为(0.11±0.09)及(22.42±4.27),C13K mimics组与其空白对照组比较miR-214-3p相对量增加(F=378.625,P<0.001);两株细胞NC组及空白对照组miR-214-3p差异均无统计学意义(F=3.173,F=2.925,P>0.05)。
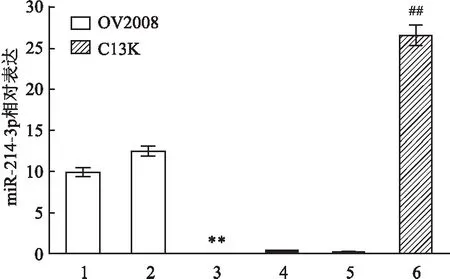
图1 各组细胞miR-214-3p相对表达量
2.2 转染对细胞增殖率影响miR-214-3p inhibitor转染后OV2008细胞增殖能力增加,与其空白对照组相比,差异有统计学意义(F=22.722,P<0.01);miR-214-3p mimics转染使C13K细胞增殖能力减弱,与其空白对照组相比,差异有统计学意义(F=19.825,P<0.01),两株细胞NC组及空白对照组增殖率变化均无统计学意义(F=1.575,F=1.728,P>0.05),见图2。
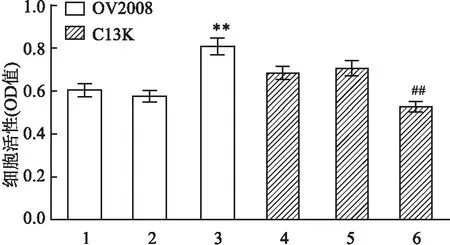
图2 各组细胞增殖活性
2.3 转染对细胞顺铂IC50影响顺铂IC50显示,转染miR-214-3p inhibitor抑制了OV2008中内源性miR-214-3p表达,使顺铂对OV2008细胞杀伤减弱,与其空白对照组相比,差异有统计学意义(F=35.56,P<0.01);转染miR-214-3p mimics致C13K过表达miR-214-3p,使顺铂对C13K细胞杀伤增加,与其空白对照组比较,差异有统计学意义(F=41.751,P<0.01),两株细胞NC组及空白对照组IC50变化均无统计学意义(F=1.876,F=1.993,P>0.05),见图3。
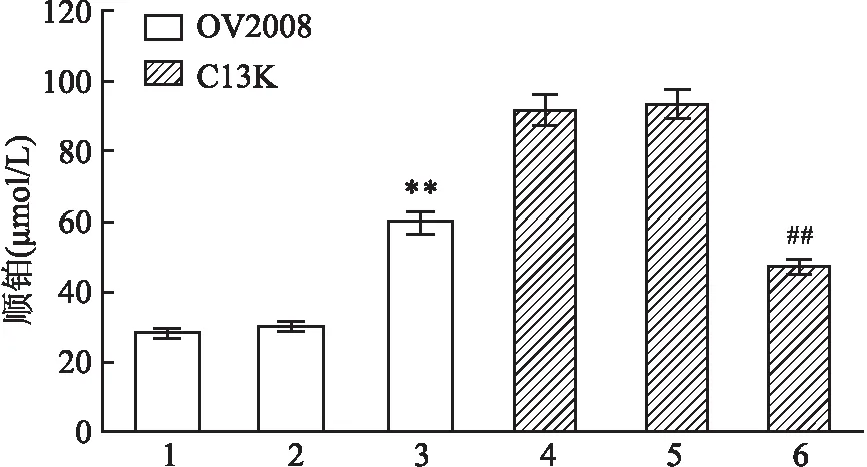
图3 CCK-8法检测各组细胞顺铂IC50
2.4 转染后细胞凋亡情况顺铂作用24 h,OV2008 inhibitor组细胞凋亡率为(5.6±1.5)%,C13K mimics组细胞凋亡率为(11.9±2.2)%,与两株细胞各自空白对照组比较,凋亡率发生明显改变(F=45.722,F=50.475,P<0.01),见图4。
2.5 转染后EGR1基因表达改变OV2008空白对照组、OV2008 NC组、 OV2008 inhibitor组、C13K空白对照组、C13K NC组及C13K mimics组EGR1相对量分别为(0.84±0.16)、(1.06±0.12)、(0.21±0.10)、(0.15±0.09)、(0.22±0.17)和(3.12±0.87);C13K mimics组与其空白对照组相比EGR1相对量增加(F=66.321,P<0.01)。OV2008 inhibitor组与其空白对照组相比EGR1相对量减少(F=112.429,P<0.01)。两株细胞NC组及空白对照组EGR1水平差异均无统计学意义(F=1.396,F=1.567,P>0.05),见图5。
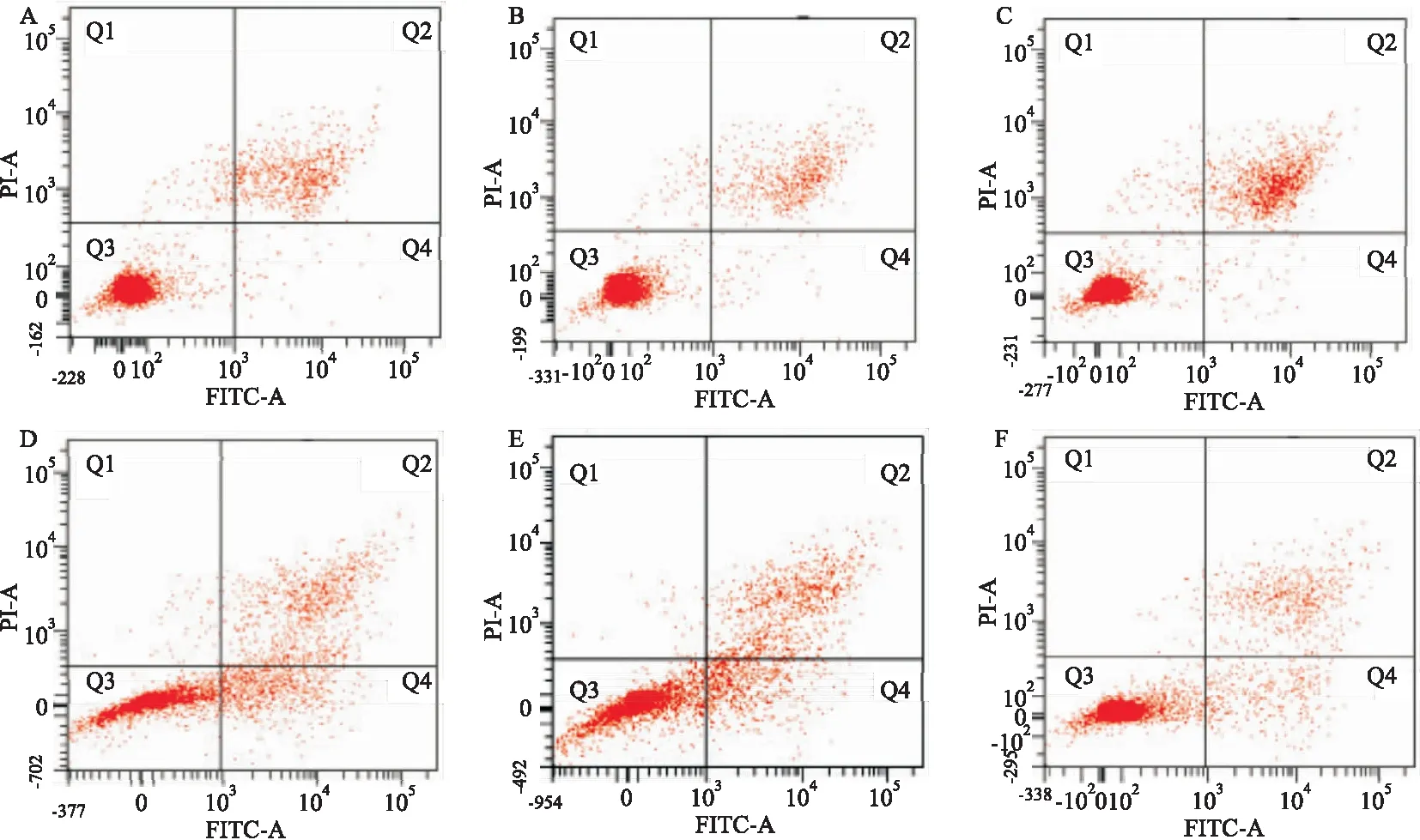
图4 各组细胞凋亡情况

图5 各组细胞EGR1相对表达量
2.6 转染后EGR1及XPD蛋白表达改变C13K NC组及空白对照组则为EGR1表达水平较低,XPD表达水平较高;OV2008 NC组及空白对照组EGR1表达水平较高,XPD表达水平较低。miR-214-3p mimics转染使C13K中EGR1水平增加,XPD蛋白水平下降;miR-214-3p inhibitor转染使OV2008中EGR1水平下降,XPD水平上升,见图6。
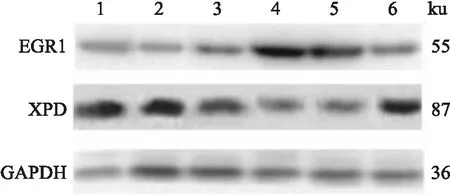
图6 各组细胞EGR1及XPD蛋白表达
3 讨论
铂类药物是目前治疗卵巢癌一线化疗药物之一,但许多患者对铂类药物发生耐药常导致治疗失败,因此研究其耐药相关因素及机制,寻找能够有效逆转耐药的治疗靶点意义重大。miRNAs是人体内一类非编码双链RNA,在转录后水平调控靶基因的表达,并且近年越来越多研究[5]表明miRNA的异常表达与肿瘤细胞的化疗药物耐药有关。miR-214-3p是细胞内重要的miRNA之一,在多种恶性肿瘤中发挥重要作用[6-7],目前卵巢癌相关研究主要集中于miR-214[8-9],而有关miR-214-3p与卵巢癌顺铂耐药的研究国内外均尚未见报道。
本研究拟通过抑制及过表达miR-214-3p,了解miR-214-3p与卵巢癌细胞顺铂耐药关系及其可能作用机制,从而为卵巢癌诊断和治疗提供新的分子靶标。研究显示miR-214-3p在卵巢癌顺铂耐药细胞系C13K表达明显低于其顺铂敏感细胞系OV2008,推测miR-214-3p可能参与卵巢癌细胞的顺铂耐药。进一步瞬时转染证实过表达miR-214-3p可抑制卵巢癌细胞增殖,增加顺铂诱导的细胞凋亡并部分恢复细胞对顺铂敏感性;miR-214-3p拮抗剂则促进卵巢癌细胞增殖,抵抗顺铂诱导的细胞凋亡,导致细胞对顺铂敏感性降低。
EGR1是一种锌指结构转录因子,其在不同的组织中发挥不同的作用,即其既有促瘤作用又有抑瘤作用。许多研究[10]表明EGR-1在多种恶性肿瘤中表达缺失,而在卵巢癌组织中EGR1可促进卵巢癌的进展[11]。EGR1通过促进乏氧诱导的自噬导致肝癌细胞的化疗耐受[12];在肺癌耐药细胞中PTEN和EGR1基因的表达均减少[13]。另有学者发现卵巢癌中miR-152及EGR1低表达与卵巢癌顺铂耐药有关[14]。miR-214-3p在卵巢癌中顺铂耐药是否与EGR1有关尚不明确。着色性干皮病基因可编码解螺旋,为核苷酸切除修复途径的必需成分,是预测细胞顺铂敏感性重要指标之一。本研究结果显示上调miR-214-3p后,细胞中EGR1升高,XPD表达降低;反之,随着miR-214-3表达下调EGR1表达下降,XPD表达升高。说明miR-214-3p对卵巢癌细胞顺铂敏感性的影响机制与miR-214-3p调控EGR1表达有关。
综上,miR-214-3p在卵巢癌顺铂耐药细胞株C13K中低表达,上调(下调)miR-214-3p表达能够提高(降低)人卵巢癌细胞对顺铂药物敏感性。miR-214-3p可能通过作用于EGR1参与卵巢癌顺铂耐药,本研究为卵巢癌顺铂耐药的研究提供一条新的线索,其具体调控作用机制尚需进一步研究。
