胞内氯离子通道蛋白在单增李斯特菌感染的炎性小体活化中的作用
2020-10-14张连军黄俊松耿慧武李新颖刘晓颖
张连军,陈 晨,黄俊松,姬 强,耿慧武,李新颖,刘晓颖
胞内氯离子通道蛋白(the chloride intracellular channels, CLICs)家族包括CLIC1-6等[1]。CLICs在调节胞内酸碱度、细胞体积、肿瘤发生发展中有重要作用[2]。炎性小体的活化通过激活天冬氨酸特异性半胱氨酸蛋白酶-1(caspase-1)促进细胞因子前体白细胞介素1β(pro-interleukin-1 beta, pro-IL-1β)和前体白细胞介素18(pro-interleukin-18, pro-IL-18)的切割并分泌白细胞介素1β(interleukin-1 beta, IL-1β)、白细胞介素18(interleukin-18, IL-18)[3]。其中NOD样受体蛋白3(Nod-like receptor family,pyrin domain containing 3,NLRP3)炎性小体被多种类型的病原体及其他信号所激活,在机体免疫反应和疾病发生过程中扮演重要角色。
单增李斯特菌(L.monocytogenes)能够激活巨噬细胞内的NLRP3、黑素瘤缺乏因子2炎性小体等[4-5]。该研究通过L.monocytogenes为胞内菌感染模型,观察CLICs在L.monocytogenes感染活化的炎性小体中的作用,进而为自身性免疫疾病的防治提供新的作用靶点和治疗措施。
1 材料与方法
1.1 细胞与菌株从安徽医科大学实验动物中心订购C57BL/6J小鼠,取其骨髓巨噬细胞进行原代培养。菌株来自安徽省疾病预防控制中心,菌株编号CMCC54004。
1.2 主要试剂与仪器茚基氧乙酸抑制剂(indanyloxyacetic acid inhibitor, IAA94)(上海MedChemExpress公司);PageRulerTM Prestained Protein Ladder、Gibco培养液(美国Thermo Fisher Scientific公司);胎牛血清(加拿大Wisent 公司);RIPA细胞裂解液(上海碧云天生物技术有限公司);小鼠IL-1β多抗(美国R&D systems公司);小鼠caspase-1单抗、小鼠NLRP3(Cryo-2)单抗(美国Adipogen公司)、生物素标记的小鼠IL-1β多克隆抗体(美国eBioscience公司);IL-1β蛋白标准品(上海Novoprotein公司);辣根过氧化物酶标记的Streptavidin 二抗(美国Proteintech公司);辣根过氧化物酶标记的二抗(北京中杉金桥生物技术有限公司);TMB显色液、一抗稀释液(北京碧云天生物技术公司);庆大霉素、改良型BCA蛋白浓度测定试剂盒(上海生工生物工程公司); CO2恒温培养箱(美国nuiversallmaging公司);酶标仪(美国Molecular Devices公司);化学发光凝胶成像系统FluorChem FC3(美国ProteinSimple公司);光吸收酶标仪(美国Molecular Devices公司)。
1.3 方法
1.3.1小鼠骨髓来源巨噬细胞培养 取C57BL/6J小鼠来源的骨髓巨噬细胞(bone marrow derived macrophages, BMDMs)接种于含巨噬细胞完全培养液的培养皿中,37 ℃、5% CO2恒温培养7~9 d。在炎性小体实验中,收集培养成熟的BMDMs,接种到12孔板中,在37 ℃、5% CO2培养箱中继续培养24 h,加入终浓度为100 ng/ml的LPS,在12孔板中活化3 h;接着用PBS洗涤2次,更换新鲜培养液,然后加入终浓度为100 μmol/L的IAA94继续在37 ℃、5% CO2培养箱中培养0.5 h;PBS洗涤2次,更换新鲜培养液,使用L.monocytogenes感染复数(multiplicity of infection,MOI)5感染BMDMs并在37 ℃、5% CO2培养箱中共培养30 min;用PBS洗涤2次,加入终浓度为10 μg/ml庆大霉素孵育BMDMs,杀灭细胞外细菌,继续在37 ℃、5% CO2培养箱中培养6 h后收集细胞培养上清液,ELISA、Western blot检测IL-1、乳酸脱氢酶(lactic dehydrogenase,LDH)的浓度。
1.3.2L.monocytogenes培养 将挑取的L.monocytogenes单克隆菌落于脑心浸出液肉汤(brain heart infusion broth, BHI)培养液中,并且在37 ℃摇床中振荡,过夜培养;接着将细菌混悬液进行1 ∶50 稀释并在37 ℃中继续培养2.5~3 h直至OD600达到0.10,此时细菌数达到约2×108/ml。将菌液从摇床中取出,室温4 000 r/min离心5 min,并利用PBS清洗2次,混悬后用于感染细胞。
1.3.3ELISA检测IL-1的表达 接种1×106BMDMs 于12孔细胞培养板,在37 ℃、5% CO2培养箱中培养24 h后加入终浓度为100 ng/ml LPS刺激3 h;并且加入IAA94在37 ℃、5% CO2培养箱中培养30 min,抑制CLICs;然后利用L.monocytogenesMOI 5感染30 min;最后加入终浓度为10 μg/ml庆大霉素杀死细胞外L.monocytogenes,收集细胞培养上清液,置于-80 ℃保存。96孔ELISA板用小鼠IL-1β单克隆抗体(1 ∶500)4 ℃过夜孵育。含0.05% Tween-20的PBS即PBST洗涤3次,每次2 min。用含1% BSA的PBS室温封闭2 h,PBST洗涤3次,每次2 min。加入待检测样品和制作标准曲线的IL-1β蛋白标准品(倍数稀释),然后4 ℃过夜孵育,PBST洗涤3次,每次2 min。加入生物素标记的小鼠IL-1β多克隆抗体(1 ∶500)室温孵育2 h,PBST洗涤3次,每次2 min。并加入辣根过氧化物酶标记的Streptavidin 二抗(1 ∶5 000)室温避光孵育30 min,PBST洗涤3次,每次2 min。加入TMB底物显色,然后加入H2SO4终止反应,酶标仪450 nm处测量各孔的吸光度值。
1.3.4LDH的测定 接种1×106BMDMs于12孔细胞培养板,在37 ℃、5% CO2培养箱中培养24 h后加入终浓度为100 ng/ml LPS刺激3 h;并且加入IAA94在37 ℃、5% CO2培养箱中培养30 min,抑制CLICs;然后利用L.monocytogenesMOI=5感染30 min;最后加入终浓度为10 μg/ml庆大霉素杀死细胞外L.monocytogenes,收集细胞培养液上清液。将收集的细胞培养液上清液加入96孔板,接着加入LDH检测工作液,混匀,室温避光孵育30 min,酶标仪490 nm处测量各孔吸光度值。
1.3.5Western blot 待细胞培养6 h之后,取出12孔板置于冰上;预冷的PBS洗2次;弃尽PBS,加入RIPA细胞裂解液,冰上孵育20 min;4 ℃、14 000 r/min离心20 min;应用BCA法测定蛋白浓度;取部分样品,加5×SDS上样缓冲液,100 ℃煮沸5 min,取等量(20 μg)的蛋白质样品进行SDS-PAGE电泳。252 mA恒流转膜90 min,含5%脱脂奶粉的TBST封闭90 min;分别一抗4 ℃孵育过夜;TBST洗3次;辣根过氧化物酶标记的二抗(1:5 000)室温孵育90 min;TBST洗3次;ECL发光液显影。
2 结果
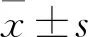
2.1 IAA94 对L.monocytogenes感染巨噬细胞炎性小体活化引起的IL-1β分泌的影响为探究CLICs 在L.monocytogenes感染引起的炎性小体的活化的作用,在感染前使用IAA94抑制CLICs活性,检测L.monocytogenes感染后IL-1β的释放情况。如图1所示,在没有L.monocytogenes感染的情况下,仅有少量IL-1β分泌至培养液上清液中;在LPS预处理条件下,巨噬细胞在L.monocytogenes感染后分泌大量IL-1β,与此相比,经过 IAA94处理后,巨噬细胞在L.monocytogenes感染后IL-1β的分泌量呈下降趋势(P=0.028,n=5),说明IAA94对L.monocytogenes感染巨噬细胞活化炎性小体引起的IL-1β分泌有抑制作用。
2.2 IAA94对L.monocytogenes感染巨噬细胞引起的细胞毒性的影响炎性小体的活化伴随着细胞焦亡(pyroptosis),为了进一步确认CLICs调节的L.monocytogenes感染引起的炎性小体活化伴随的细胞焦亡,通过检测细胞培养上清液中的LDH水平分析细胞毒性。如图2所示,在无L.monocytogenes感染处理组,细胞培养上清液中的LDH水平低;当LPS预处理时,IAA94的加入使L.monocytogenes感染引起的细胞毒性降低,提示IAA94能够降低L.monocytogenes感染引起的细胞毒性(P=0.008)。
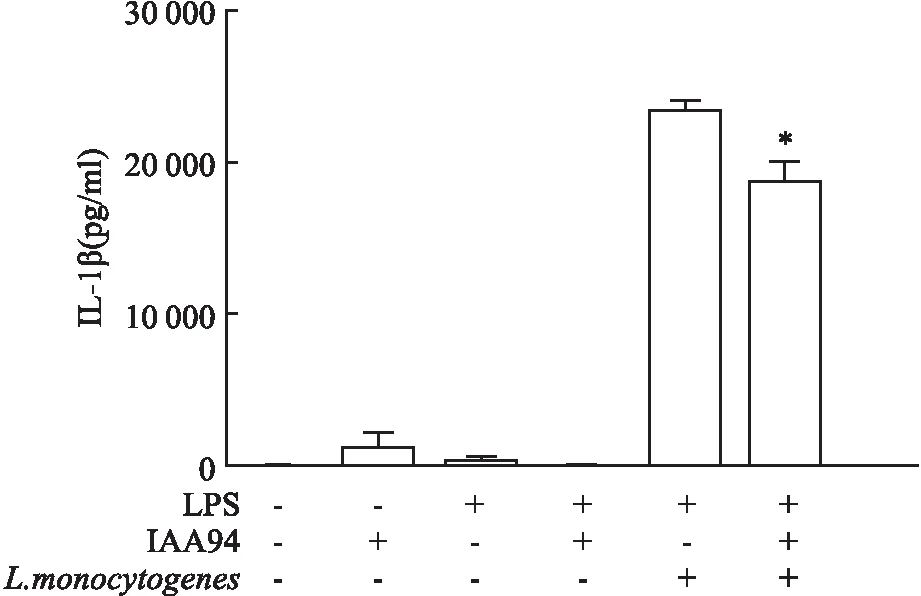
图1 IAA94处理后对L.monocytogenes感染巨噬细胞引起炎症小体活化导致IL-1β分泌的变化
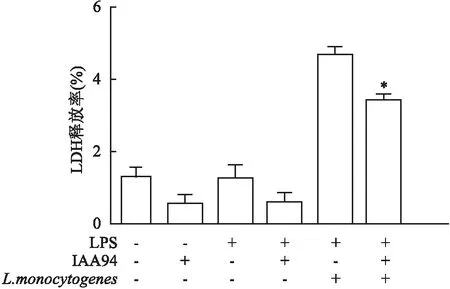
图2 IAA94处理导致L.monocytogenes 感染巨噬细胞引起的细胞毒性的改变
2.3 IAA94在L.monocytogenes感染的炎性小体的活化中对NLRP3炎性小体组分蛋白表达的影响为了确定CLICs参与L.monocytogenes感染活化的炎性小体的分子机制,将细胞培养上清液、细胞裂解液进行Western blot实验,检测上清液中caspase-1、IL-1β以及细胞中NLRP3、caspase-1、pro-IL-1β的表达情况。图3显示,细胞培养上清液中,IAA94处理后L.monocytogenes感染引起的IL-1β释放量较对照组减少,caspase-1的表达量也减少(n=3)。细胞裂解液中NLRP3的表达量在IAA94处理组与对照组相比没有变化,提示CLICs参与的L.monocytogenes感染的炎性小体的活化可能不通过NLRP3炎性小体。
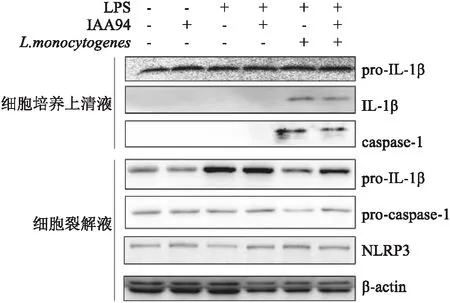
图3 炎性小体相关蛋白在细胞培养上清液、细胞裂解液中的表达
3 讨论
本研究探讨了CLICs促进L.monocytogenes感染引起的非NLRP3依赖的炎性小体的活化。L.monocytogenes是一种革兰阳性食源性致病菌[6],其被巨噬细胞吞噬形成吞噬小泡,其与溶酶体融合形成吞噬溶酶体,通过产生溶菌素O(listeriolysin O)、磷脂酶PlcA、PlcB裂解吞噬溶酶体,从其中逃逸到细胞质中并迅速繁殖,感染相邻细胞[7-8]。L.monocytogenes感染巨噬细胞后,通过炎性小体的活化分泌IL-1,激活一系列固有免疫反应进而清除感染。CLICs在L.monocytogenes感染引起的炎性小体活化中的作用,提示其在抗胞内寄生菌感染中扮演重要角色。
CLICs在细胞内分布广泛,家族成员的蛋白质序列有高度的同源性,C-端含有约220个氨基酸残基的同源结构域。CLICs有可溶型和膜结合型两种类型,在静息细胞内主要以可溶型的形式存在[1]。CLICs主要作为质子-氯离子交换通道调节细胞内pH水平,在肿瘤发生发展中有重要作用[9]。L.monocytogenes通过吞噬作用感染细胞,在细胞中形成吞噬小体,L.monocytogenes表面的溶胞素(listeriolysin)裂解吞噬小体并使细菌逃离酸性环境避免被杀死,逃离到细胞质中的细菌导致炎性小体的活化,包括NLRP3、AIM2、NLRC4等,促进IL-1的释放进而调节促感染免疫反应[10]。在L.monocytogenes感染下,该菌从吞噬小体逃逸到细胞质中,NLRP3炎性小体首先被活化,而AIM2、NLRC4炎性小体则在感染后期由L.monocytogenes释放的DNA、鞭毛蛋白所激活[10]。NLPR3炎性小体的活化进一步使caspase-1活化并切割pro-IL-1进而释放IL-1。研究[11]表明CLICs在NLRP3炎性小体激活中有重要作用,可能是通过感应细胞内钾离子流的升高或线粒体ROS的升高调控细胞内氯离子流,进而调节NLRP3炎性小体的组装,从而促进IL-1的释放。本研究结果显示CLICs在L.monocytogenes感染引起的IL-1的释放中是必需的,提示CLICs在抗感染免疫中扮演重要角色。在利用LPS诱导细胞产生pro-IL-1的过程中,CLICs抑制剂IAA94并未对pro-IL-1的表达产生影响,表明CLICs对NF-κB通路相关的pro-IL-1的表达无影响。在L.monocytogenes感染过程中,CLICs是否通过促进L.monocytogenes逃离吞噬小体,促进IL-1的释放值得进一步研究。关于L.monocytogenes感染中CLICs是否通过NLRP3以外的其他通路活化炎性小体,需要进一步验证。
小鼠基因组中表达CLIC1、CLIC3、CLIC4、CLIC5、CLIC6等CLICs家族成员,其中CLIC1、CLIC4、CLIC5 通过促进细胞内氯离子流动促进NLRP3炎性小体的活化,但在AIM2、NLRC4炎性小体的活化中无作用。本研究使用IAA94抑制CLICs的活性,而CLICs各个家族成员在L.monocytogenes感染的炎性小体活化的作用,以及各个成员之间的冗余效应需要进一步探究。
