芍药苷-6′-O-苯磺酸酯对胰岛素抵抗HASMC作用及机制
2020-10-13苏扬妮黄琼芳赵天娇
苏扬妮,黄琼芳,赵天娇,黄 琼,魏 伟
2型糖尿病(type 2 diabetes,T2D)是一种代谢性疾病,其主要标志是胰岛素抵抗(insulin resistance,IR)[1]。糖尿病易引起心血管系统并发症。研究[2]表明血管平滑肌细胞(vascular smooth muscle cell,VSMC)从中膜向内膜迁移对糖尿病血管动脉粥样硬化的发展至关重要。G蛋白偶联受体激酶2(G-protein-coupled receptor kinase 2,GRK2)是调控G蛋白偶联受体快速失敏相关的激酶。GRK2水平上调会改变胰岛素信号转导,IR时GRK2表达增高[3]。前期研究[4]表明芍药苷-6′-O-苯磺酸酯(paeoniflorin-6′-O-benzenesulfonate, CP-25)可以抑制GRK2的活性和表达。CP-25能否通过调节GRK2 影响平滑肌细胞中胰岛素受体(insulin receptor,INSR)信号和功能目前尚不清楚。该文通过培养人主动脉平滑肌细胞(human aortic smooth muscle cell,HASMC),观察CP-25能否通过调控GRK2及下游胰岛素信号通路影响IR-HASMC的功能,及对INSR与GRK2相互作用的影响,为糖尿病临床治疗药物的拓展提供新的方向。
1 材料与方法
1.1 材料
1.1.1细胞 HASMC在倒置显微镜下可见细胞呈长梭形,有多个突起,呈“峰谷状”生长。免疫荧光染色可见大量VSMC特异性的α-平滑肌肌动蛋白(α-SM-actin)表达,经鉴定证明细胞为HASMC。来源于上海细胞库,由湘雅医学院馈赠。
1.1.2主要试剂及仪器 人胰岛素(美国Sigma公司);盐酸二甲双胍(上海MACKLIN公司);CP-25纯度≥98%(安徽医科大学临床药理研究所化学室);无酚红DMEM培养基(上海Gibco公司);葡萄糖测定试剂盒(南京建成生物工程研究所);细胞凋亡荧光Hoechst 33342/PI双染试剂盒(北京Solarbio公司);BCA蛋白浓度测定试剂盒(中国贝博公司);ECL发光显色试剂盒(上海Thermo Scientific公司);GRK2抗体(美国CST公司);INSR抗体(武汉Proteintech公司);GLUT4 抗体(美国Affinity公司);DYY-7C型电泳系统(北京六一生物科技有限公司);Image Quant LAS 4000荧光及化学发光成像系统(美国GE公司);Bio Tek Elx×808酶标仪(美国Bio Tek公司);BX-50型正置显微镜(日本OLYMPUS公司);DMI1型倒置式显微镜(德国徕卡公司);FC500 流式细胞仪(美国Beckman Coulter公司)。
1.2 方法
1.2.1IR模型的建立 取对数生长期细胞接种到6孔板,培养12 h贴壁后,更换终浓度为1 μmol/L的胰岛素培养液,培养24 h建立IR-HASMC模型。
1.2.2葡萄糖消耗量的检测 按6×103/孔接种到96孔板,12 h后,设置空白对照组、胰岛素组(1 μmol/L)、胰岛素(1 μmol/L)+不同浓度的CP-25(1 nmol/L、10 nmol/L、100 nmol/L、1 μmol/L、10 μmol/L)组、胰岛素(1 μmol/L)+二甲双胍(3 mmol/L)组,按照上述分组每孔加200 μl培养基培养24 h后全部更换为无酚红DMEM培养基继续培养24 h,取上清液用葡萄糖试剂盒测各孔葡萄糖浓度,以空白对照组葡萄糖含量均值减去各孔测得葡萄糖含量计算各孔的葡萄糖消耗量[5]。
1.2.3增殖检测 按6×103/孔接种到96孔板,12 h 后,更换为含1%胎牛血清培养基处理24 h,同1.2.2项分组继续培养24 h,于终止培养前2 h每孔加10 μl CCK-8试剂,避光继续孵育1~2 h后于酶标仪读取A450值。
1.2.4迁移检测 按6×103/室接种到transwell小室内,同1.2.2项分组加入培养基,每孔终体积600 μl。24 h后取出小室,结晶紫染色15 min,洗涤后棉签擦拭,于显微镜下观察拍照,4倍镜统计迁移细胞数。
1.2.5凋亡检测 按1×105/孔接种到6孔板内,12 h后,同1.2.2项分组,继续培养24 h,每孔加200 μl无EDTA消化液,收集细胞,按凋亡试剂盒说明书操作。
1.2.6蛋白表达检测 Western blot法检测GRK2和葡萄糖转运体4(glucose transporter 4,GLUT4)的胞膜表达和INSR、磷脂酰肌醇-3-激酶(phosphoinosmde-3-kinase,PI3K)、胰岛素受体底物(insulin receptor substrate,IRS)和磷酸化胰岛素受体底物(phosphorylated insulin receptor substrate,p-IRS)的细胞表达。按1×105/孔接种到6孔板,12 h后,设置空白对照组、胰岛素组(1 μmol/L)、胰岛素(1 μmol/L)+不同浓度的CP-25(100 nmol/L、1 μmol/L、10 μmol/L)组和胰岛素(1 μmol/L)+二甲双胍(3 mmol/L)组,其中检测GRK2蛋白的胞膜表达时不设二甲双胍组,培养24 h后,弃培养基PBS洗涤,加裂解液(RIPA ∶PMSF=99 ∶1),冰孵30 min后移至EP管中,-20 ℃冻存后置于4 ℃融化,重复3次后以4 ℃、10 400 r/min离心15 min,上清液为总蛋白。转移至离心管,4 ℃ 、100 000 r/min 超速离心60 min,沉淀物为胞膜蛋白。加裂解液溶解胞膜,移入EP管中进行BCA定量,加蛋白上样缓冲液(蛋白样品 ∶蛋白上样缓冲液=4 ∶1),100 ℃加热8 min,SDS-PAGE电泳分离蛋白后转移到PVDF膜上,5%脱脂奶粉封闭2 h,加入适当比例的一抗,4 ℃孵育过夜,TBST洗膜后加入HRP标记的二抗,37 ℃孵育2 h后ECL发光,暗室中显影和定影,总蛋白和胞膜蛋白分别以β-actin 和ATP1A1作为内参对照。
1.2.7免疫共沉淀(CO-immunoprecipitation, CO-IP)检测蛋白相互作用 按1×105/孔接种到6孔板,12 h后,设置空白对照组、胰岛素组(1 μmol/L)和胰岛素(1 μmol/L)+CP-25(10 μmol/L)组,24 h后收集总蛋白,离心收集上清液,留取1/10体积做input;耦联抗体后,按Western blot 法检测GRK2 与INSR、GRK2与p-IRS的共表达情况。
2 结果
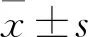
2.1 CP-25对IR-HASMC葡萄糖消耗的影响为观察不同浓度CP-25处理细胞对其葡萄糖消耗量的影响,采用葡萄糖氧化酶测定法检测细胞的葡萄糖消耗情况。与空白对照组比较,1 μmol/L胰岛素处理组可降低细胞的葡萄糖消耗量,与胰岛素组比较,胰岛素+CP-25(10 nmol/L、100 nmol/L、1 μmol/L、10 μmol/L)组均可提高细胞的葡萄糖消耗量,差异有统计学意义(F=7.71,P<0.01)。见图1。
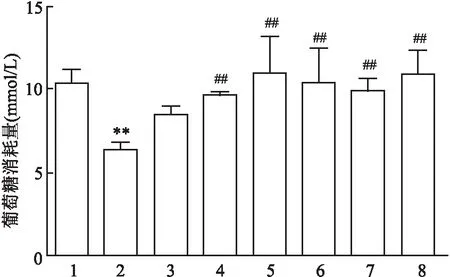
图1 不同浓度CP-25处理对IR-HASMC葡萄糖消耗的影响
2.2 CP-25对IR-HASMC增殖、迁移及凋亡的影响为观察不同浓度CP-25处理对细胞基本功能的影响,依次采用CCK-8法、Transwell和流式细胞术检测细胞的增殖、迁移和凋亡情况。CCK-8结果表明:与空白对照组比较,1 μmol/L胰岛素组可以促进细胞的增殖;与胰岛素处理组比较,胰岛素+CP-25(1 nmol/L、10 nmol/L、100 nmol/L、1 μmol/L、10 μmol/L)处理组均能抑制细胞的异常增殖,差异有统计学意义(F=90.975,P<0.01)。见图2。采用Transwell法检测CP-25对细胞迁移功能的影响,结果表明:与空白对照组比较,1 μmol/L胰岛素组促进细胞的迁移;与胰岛素组比较,胰岛素+CP-25(1 nmol/L、10 nmol/L、100 nmol/L、1 μmol/L、10 μmol/L)处理组均可以抑制细胞的异常迁移,差异有统计学意义(F=114.265,P<0.01)。见图3。运用流式细胞术检测不同浓度CP-25对细胞凋亡的影响情况。结果表明:与空白对照组比较,1 μmol/L胰岛素处理组可以降低细胞的凋亡率;与胰岛素处理组比较,胰岛素+CP-25(1 nmol/L、10 nmol/L、100 nmol/L、1 μmol/L、10 μmol/L)处理组均可提高细胞的凋亡率,差异有统计学意义(F=932.772,P<0.01)。见图4。
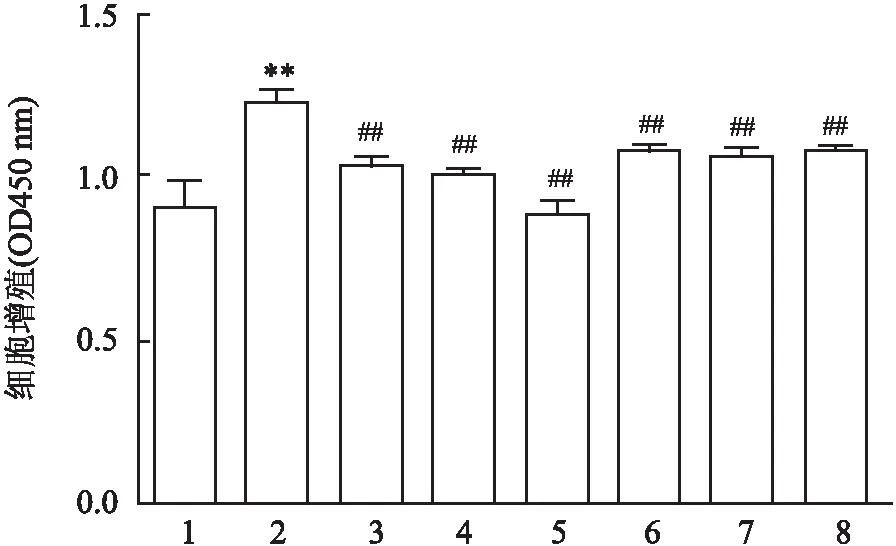
图2 不同浓度CP-25处理对IR-HASMC增殖的影响
2.3 CP-25对IR-HASMC GRK2胞膜表达的影响为探讨CP-25影响细胞功能的分子机制,首先采用Western blot法检测细胞中GRK2蛋白的胞膜表达,结果表明:与空白对照组比较,1 μmol/L胰岛素作用细胞后,GRK2的胞膜表达水平增高;与胰岛素组比较,胰岛素+CP-25(100 nmol/L、1 μmol/L、10μmol/L)处理组均可下调GRK2的胞膜表达,差异有统计学意义(F=848.188,P<0.01)。见图5。
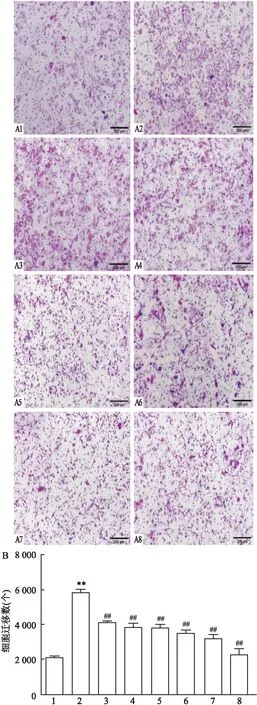
图3 不同浓度CP-25处理对IR-HASMC迁移的影响
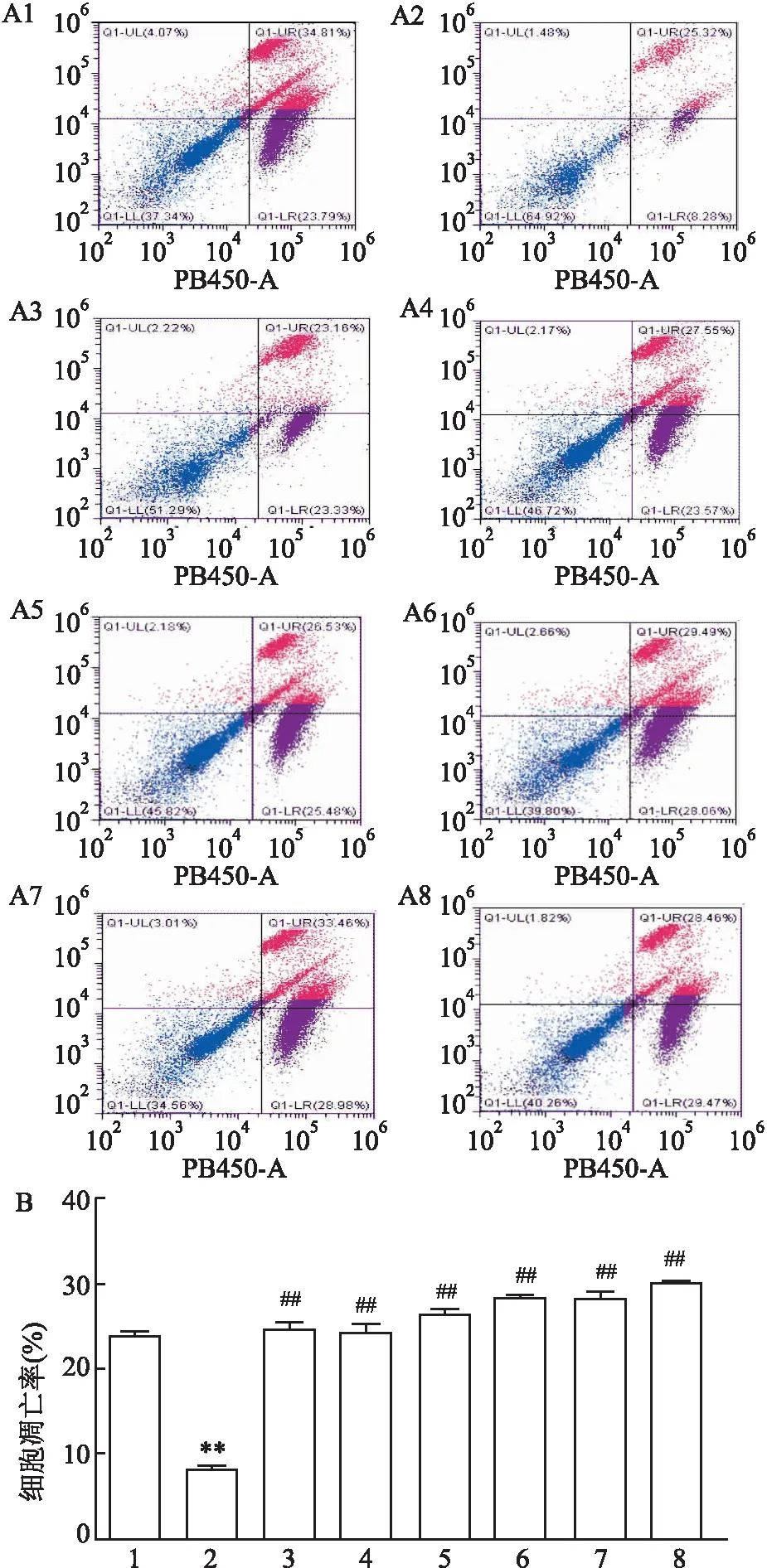
图4 不同浓度CP-25处理对IR-HASMC凋亡的影响
2.4 CP-25对IR-HASMC GLUT4胞膜表达水平、INSR、PI3K、IRS和p-IRS表达水平的影响Western blot进一步检测CP-25对细胞中关键蛋白GLUT4膜表达的影响,结果表明:与空白对照组比较,1 μmol/L胰岛素处理细胞后,GLUT4蛋白的胞膜表达减少,与胰岛素组比较,胰岛素+CP-25(1 μmol/L、10 μmol/L)处理组可上调 GLUT4 的胞膜表达水平,差异有统计学意义(F=220.252,P<0.01)。见图6A。为进一步探讨CP-25对胰岛素信号通路相关蛋白的影响,Western blot检测相关蛋白的表达水平。结果表明:与空白对照组比较,1 μmol/L胰岛素处理细胞后,INSR的表达下降;与胰岛素组比较,胰岛素+CP-25(100 nmol/L、1 μmol/L、10 μmol/L)处理组均可上调INSR的表达,差异有统计学意义(F=602.297,P<0.01)。见图6B。与空白对照组比较,1 μmol/L胰岛素组PI3K的蛋白表达水平下降,与胰岛素处理组比较,胰岛素+CP-25(100 nmol/L、1 μmol/L、10 μmol/L)组均上调PI3K的表达,差异有统计学意义(F=2.079E3,P<0.01)。见图6C。与空白对照组比较,胰岛素处理组IRS的蛋白水平未发生变化。见图6D。与空白对照组比较,1 μmol/L胰岛素作用组p-IRS的蛋白表达下降,差异有统计学意义。与胰岛素组比较,胰岛素+CP-25(100 nmol/L、1 μmol/L、10 μmol/L)处理细胞后均上调p-IRS的蛋白表达,差异有统计学意义(F=828.603,P<0.01)。见图6E。
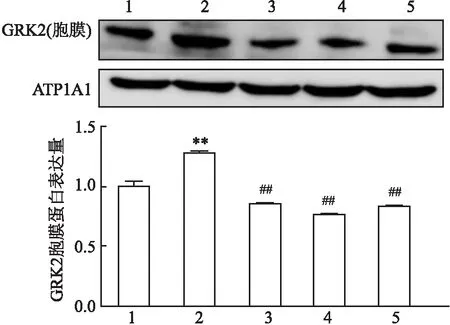
图5 不同浓度CP-25处理对IR-HASMC中GRK2胞膜表达的影响
2.5 CP-25 对IR-HASMC GRK2 与INSR和GRK2与p-IRS相互作用的影响为进一步探讨CP-25对IR-HASMC中INSR与GRK2相互作用的影响,采用CO-IP法检测两种蛋白的相互作用,结果表明:与空白对照组比较,1 μmol/L胰岛素(1.254±0.008)作用细胞后上调GRK2 与INSR的共表达,差异有统计学意义。与胰岛素组比较,胰岛素+CP-25(10 μmol/L)组(0.944±0.013)下调两者的共表达,差异有统计学意义(F=1.069E3,P<0.01)。见图7A。CO-IP法检测GRK2与p-IRS的相互作用。结果表明:与空白对照组比 较,1 μmol/L胰岛素(1.068±0.006)作用细胞后上调GRK2与p-IRS的共表达,差异有统计学意义。与胰岛素处理组比较,胰岛素+CP-25(10 μmol/L)组(0.919±0.021)可下调两者的共表达,差异有统计学意义(F=106.239,P<0.01)。见图7B。
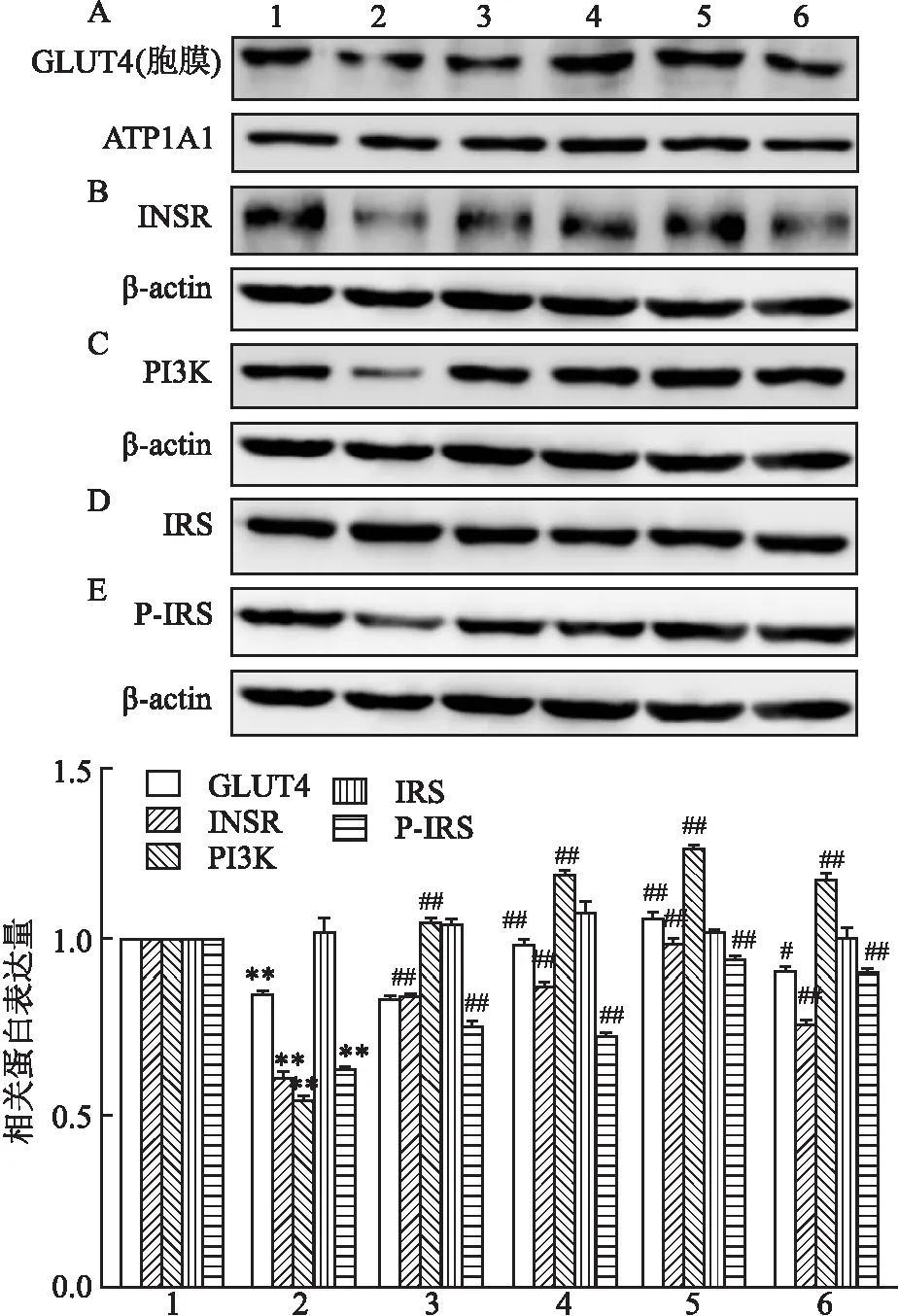
图6 不同浓度CP-25处理对IR-HASMC中GLUT4、INSR、PI3K、IRS和p-IRS表达的影响
3 讨论
IR是T2D的主要特征,随着病程的进展,IR逐渐在多种器官如肝脏、骨骼肌等中出现,引发多种糖尿病并发症[6]。芍药苷(paeoniflorin,Pae)是白芍总苷(total glucosides of paeony,TGP)中的主要生物活性成分。研究[7]表明TGP和Pae均有抗炎免疫调节作用,Pae具有抗氧化和抗高血糖等多种药理作用,被广泛应用于糖尿病及其并发症如糖尿病肾病的治疗[8]。为了提高Pae的生物利用度,课题组对Pae进行结构修饰,合成Pae的新型酯衍生物CP-25[9]。文献[10]报道,GRK2的表达受胰岛素的调节,这提示GRK2水平或活性增加参与IR的发生发展。此外,GRK2水平增加抑制葡萄糖的摄取和胰岛素的信号转导,提示改变GRK2的水平和活性可影响胰岛素信号的传递[11]。因此,GRK2可作为抗糖尿病药物的新靶点。
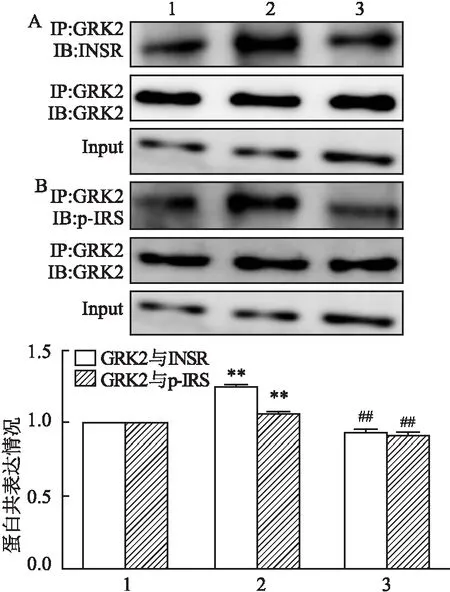
图7 CP-25处理对IR-HASMC中GRK2与INSR、GRK2与p-IRS共表达的影响
本研究采用1 μmol/L胰岛素成功建立IR-HASMC模型,并给予不同浓度的CP-25干预,结果显示CP-25可以有效地增加IR细胞的葡萄糖消耗量。在高浓度胰岛素作用细胞时,细胞出现异常增殖和迁移、凋亡率下降,而CP-25作用细胞后,细胞的增殖和迁移受到抑制,凋亡率增加。为了探讨CP-25改善IR-HASMC功能的分子机制,首先采用Western blot法检测GRK2的蛋白表达。结果显示,在1 μmol/L胰岛素作用下,GRK2的胞膜表达水平较空白对照组升高,不同浓度的CP-25均可以降低GRK2的胞膜表达。运用Western blot进一步检测胰岛素信号中相关蛋白的表达水平,结果显示CP-25可增加GLUT4的膜表达水平,上调INSR、p-IRS和PI3K的蛋白表达,推测CP-25可能通过下调GRK2的膜表达水平和上调INSR/p-IRS/PI3K/GLUT4蛋白的表达,促进胰岛素信号通路的活化,改善IR-HASMC的功能。采用CO-IP法进一步观察GRK2与INSR、GRK2与p-IRS的共表达情况。结果显示HASMC发生IR时,GRK2与INSR共表达增强,可能与INSR脱敏和GRK2过度转膜有关;同样地,胰岛素作用细胞后增强GRK2与p-IRS的共表达,表明GRK2表达增加可以抑制p-IRS的水平,进而使胰岛素信号通路的转导受到抑制,HASMC的增殖和迁移增加。而CP-25作用细胞后可下调GRK2与INSR、GRK2与p-IRS的共表达,表明CP-25通过抑制GRK2的膜转位和GRK2的胞膜表达水平,促进胰岛素信号通路的活化,可能是其抑制IR-HASMC异常增殖和迁移的机制之一。
