高世代回交玉米矮秆种质的转录组分析
2021-06-30王亚丽陈煜东王益军
王亚丽 陈煜东 王益军

摘要: 株高影响株型建成,与抗倒性、收获指数以及最终产量相关。对矮秆材料的研究有助于丰富对株高调控机理的认识。在前期研究中,对玉米矮秆材料D11的农艺与生理特征进行了分析。本研究基于高世代回交群体,通过转录组测序,对矮秆材料D11的基因表达调控进行解析。与株高正常植株相比,矮秆材料中共检测到2 537个差异表达的基因,其中1 120个基因表达上调、1 417个基因表达下调。功能注释、GO富集、通路富集的结果表明,差异表达基因参与细胞延伸、细胞骨架功能、微管组织、叶绿体功能、植物激素合成代谢等。差异表达基因最显著富集的通路与糖酵解相关。共表达分析结果表明,编码果糖-1,6-双磷酸酶的基因与多个差异表达基因存在功能关联。该研究结果揭示了玉米矮秆材料中的基因表达调控,为后续玉米株高调控节点的发掘提供了参考。
关键词: 矮秆;高世代回交群体;转录组测序;共表达;玉米
中图分类号: S513.035.3 文献标识码: A 文章编号: 1000-4440(2021)02-0280-09
Abstract: Plant height affects plant type and is related to lodging resistance, harvest index and final yield. The research on dwarf plants helps to improve the understanding of plant height regulation mechanism. In previous studies, the agronomic and physiological characteristics of maize dwarf material D11 were analyzed. In this study, based on the advanced backcross population, the gene expression regulation of D11 was analyzed by transcriptome sequencing. A total of 2 537 differentially expressed genes (DEGs) were identified,including 1 120 up-regulated and 1 417 down-regulated DEGs. Functional annotation, GO enrichment and pathway enrichment analysis results indicated that DEGs were involved in cell expansion, cytoskeletal function, microtubule organization, chloroplast function, phytohormone homeostasis. The pathway most significantly enriched by DEGs was related to glycolysis. The gene encoding fructose-1,6-bisphosphatase was functionally related to several DEGs. The results of this study reveal the gene expression regulation in maize dwarf materials, and provide a reference for the subsequent exploration of maize plant height regulatory modes.
Key words: dwarf plant;advanced backcross population;transcriptome sequencing;co-expression;maize
株高是重要的農艺性状,影响抗倒性、光合效率、收获指数和最终产量。“绿色革命”期间,产量的提高主要得益于株型与农艺措施的改良。改良的高产品种具有半矮秆性状、较高的氮肥同化效率、优良的抗倒性[1]。控制高产品种半矮秆性状的基因已被克隆。水稻的半矮秆基因semidwarf1 (sd1)编码负责赤霉素合成的酶GA 20-oxidase2 (GA20ox2)[2-3]。小麦株高降低是由于Reduced height (Rht)基因的变异所导致,Rht编码DELLA蛋白,参与赤霉素信号转导[4]。“绿色革命”期间,半矮秆性状主要是由于赤霉素合成、信号转导通路的改变所导致。除了赤霉素,其他植物激素,例如生长素、油菜素内酯、独脚金内酯等植物激素也与株高调控相关。生长素转运异常导致玉米和高粱植株矮化[5]。玉米严重矮化表型是由于编码油菜素内酯合成酶brassinosteroid C-6 oxidase基因的突变所导致[6]。油菜素内酯信号通路的改变同样能导致玉米植株矮化[7]。植物激素独脚金内酯诱导豌豆幼茎伸长[8]。除了植物激素,表观调控因子也影响株高。通过全基因组关联分析,调控玉米株高的表观因子被发掘[9]。
玉米株高是由微效多基因控制的性状[10]。通过连锁分析、全基因组关联分析,已有大量调控玉米株高的QTL/靶点被发掘[10-11]。其中,一些玉米株高QTL已被图位克隆,例如qPH3.1、qph1[12-13]。QTL克隆是发掘玉米株高调控靶点的重要方法。通过玉米矮秆突变体研究,亦能为株高调控机制的解析提供重要参考。在前期研究中,实验室鉴定到1份玉米矮秆材料Dwarf11 (D11),矮秆材料D11的农艺性状、生理特征已被初步分析[14]。基于高通量测序的转录组技术,被用来研究植物调控网络。转录组技术可用于SNP发掘、可变剪辑预测、融合转录本鉴定、基因表达分析等[15]。本研究采用转录组测序技术,结合荧光定量PCR验证、基因功能注释、通路富集分析、共表达网络构建等,对高世代回交D11矮秆群体的基因表达调控进行了分析,所得结果有助于解析矮秆基因D11介导的调控网络,也为后续玉米株高调控靶点的解析提供参考。
1 材料与方法
1.1 试验材料
矮秆材料D11与玉米自交系Mo17杂交,获得F1代。通过连续5个世代的回交,获得高世代回交群体BC5。在高世代回交群体BC5中,与株高正常植株相比,矮秆材料株高显著降低。本研究采用高世代回交群体BC5中的株高正常植株与矮秆植株作为试验材料。
1.2 RNA提取、文库构建与高通量测序
在高世代回交群体BC5中,取三叶期幼茎,采用RNeasy Plant Mini Kit (QIAGEN)试剂盒进行RNA提取。提取RNA的质量与浓度用NanoDrop 2000 spectrophotometer、Agilent 2100 Bioanalyzer进行测定。mRNA通过带有oligo(dT)的磁珠进行吸附。吸附的mRNA片段,反转录成cDNA。cDNA末端修复,加腺嘌呤,连接接头。连接产物进一步纯化,用于PCR扩增。回收400~500 bp大小的产物,采用RNA Seq Library Preparation Kit进行文库构建。测序前,文库质量采用ABI StepOnePlus Real-Time PCR System进行qPCR检测。合格的文库基于125 bp成对模式,在Illumina Hiseq2500 platform进行高通量测序。
1.3 差异表达基因发掘
对转录组测序获得的原始序列,首先进行质量控制。接头序列、低质量reads(含有超过50%低质量碱基的reads、未知碱基数超过5%的reads、测序质量低于10的低质量碱基)被剔除。采用SOAPaligner/soap2,过滤后的reads比对到玉米参考基因组[16]。比对结果质量控制后,采用Cufflinks进行转录本组装[17]。通过计算每1×106 reads中来自于某基因每1 000碱基长度的reads数 (RPKM),对基因表达量进行度量。本研究中,表达变化≥2、发现错误率(FDR)≤0.05的基因为差异表达基因。
1.4 差异表达基因生物信息学分析
差异表达基因功能注释通过BLAST 进行。玉米基因功能注释使用maizeGDB数据库 (https://www.maizegdb.org/)。水稻、拟南芥中差异表达基因的同源基因通过BLASTP获得,所用数据库分别为RGAP (http://rice.plantbiology.msu.edu/index.shtml)与Araport (https://www.araport.org/)。Gene ontology (GO)富集分析:首先基于Gene Ontology Consortium (http://www.geneontology.org/) 数据库,将差异表达基因比对到GO term[18]。确定每个GO term的差异表达基因数,超几何分布检验用来发掘显著富集的GO term。通过Bonferroni校正,获得校正P值。校正P值小于0.05为差异表达基因显著富集的GO term。通路富集分析采用KEGG 数据库(http://www.genome.jp/kegg/)进行[19]。校正P值小于0.05为差异表达基因显著富集的通路。
1.5 荧光定量PCR分析
RNA样品用RNase-free DNase I (QIAGEN) 处理,采用M-MLV reverse transcriptase (Promega)反转录,获得cDNA。采用SYBR qPCR master mix (TaKaRa),在7500 Real-Time PCR System (ABI)上进行荧光定量PCR。每个样品重复3次。18S rRNA基因作为内参基因。用2-△△Ct方法分析基因的相对表达量[20]。
2 结果与分析
2.1 高世代群体矮秆材料表型及基因表达分析
玉米矮秆材料D11与自交系Mo17杂交。通过连续5个世代的回交,获得高世代回交群体BC5。在高世代回交群体BC5中,与株高正常植株相比,矮秆材料株高极显著降低(图1)。
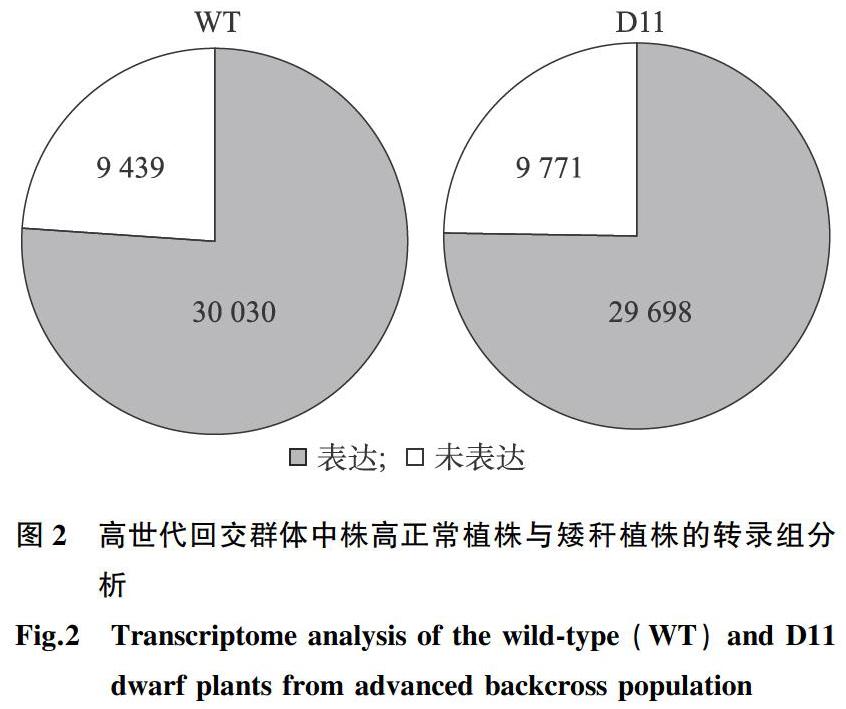
为了发掘矮秆材料中差异表达基因,取高世代回交群体中株高正常植株与矮秆植株,进行转录组测序。通过对原始测序数据质量控制、过滤,Clean reads比对到玉米参考基因组,对株高正常植株与矮秆植株中的基因表达进行分析。结果表明,在株高正常植株中检测到超过30 000个基因的表达。在矮秆植株中检测到近30 000个基因的表达(图2)。
2.2 转录组测序发掘差异表达基因
为了发掘矮秆材料中差异表达基因,比对的reads通过计算RPKM值对基因的表达量进行度量。通过比较株高正常植株和矮秆植株的基因表達量,进行差异表达基因发掘。本研究中,基因表达变化≥2、发现错误率≤0.05的基因被认为是差异表达基因。根据上述设定的阈值,共发掘到2 537个差异表达基因。与株高正常植株相比,其中1 120个基因在矮秆材料中表达量上升、1 417个基因在矮秆材料中表达量下降。
2.3 转录组测序揭示的差异表达基因的验证
基于转录组测序揭示的差异表达基因,设计引物(表1),进行荧光定量PCR分析,对差异表达基因进行验证。
采用2-△△Ct方法,对基因的表达量进行相对定量。差异表达基因荧光定量PCR与转录组测序表达量的决定系数(R2)为0.72(图3)。结果表明,转录组测序获得的差异表达基因可靠,由转录组测序获得的差异表达基因可用于后续分析。
2.4 差异表达基因功能
对转录组测序揭示的差异表达基因,首先在maizeGDB数据库中进行功能注释。此外,发掘水稻、拟南芥中差异表达基因的同源基因。玉米数据库中没有功能注释的差异表达基因,通过其水稻、拟南芥中的同源基因进行功能注释。功能注释的结果表明,差异表达基因参与多个生物学过程。基于矮秆材料表型,本研究集中分析可能与矮秆表型相关的差异表达基因。与株高正常植株相比,矮秆材料中与细胞伸长相关的ARF GTPase家族成员基因差异表达,与微管组织、细胞骨架、木质素合成、维管束组织发育相关的基因差异表达。矮秆材料叶片变宽、微卷,通过转录组测序,检测到与叶片发育相关的差异表达基因。例如,生长调节因子、MYB转录因子等。此外,矮秆材料叶缘白化。在矮秆材料中,与叶绿素合成、叶绿体功能相关的基因差异表达,例如编码参与叶绿素合成Mg-螯合酶基因、编码叶绿素a/b结合蛋白的基因、调控叶绿素降解的NAC转录因子基因等。差异表达基因还参与生长素、油菜素内酯、细胞分裂素等植物激素的合成与信号转导过程(表2)。
本研究所用矮稈材料对外源赤霉素施用敏感。转录组测序的结果表明,与株高正常植株相比,矮秆材料中与赤霉素合成代谢、信号通路相关的基因差异表达。与赤霉素合成相关的4个基因差异表达,包括上调的GA20ox5基因,下调的Dwarf1、dwarf3、KO1基因。与赤霉素代谢相关的2个GA2ox基因均下调表达。与赤霉素信号转导相关的6个基因,包括赤霉素受体基因、F-box蛋白基因等,其中2个基因表达上调、4个基因表达下调。与赤霉素通路调控相关的5个基因,在矮秆材料中均下调表达(表3)。
2.5 差异表达基因GO与通路富集分析
基于Gene Ontology Consortium resource数据库,对差异表达基因进行GO分析。设定了较严格的阈值(校正P值<0.05)用来发掘差异表达基因显著富集的GO term。在生物学过程中,差异表达基因富集在碳水化合物合成代谢、光合作用等过程。在分子功能方面,差异表达基因最显著富集的GO term与结构组分相关。为了进一步分析差异表达基因参与的生物学通路,采用KEGG数据库,对差异表达基因进行KEGG通路分析。与GO富集分析类似,校正P值<0.05作为显著富集KEGG通路筛选的标准。KEGG通路富集的结果表明,差异表达基因最显著富集的通路与糖酵解相关。差异表达基因可能参与糖的合成与代谢。此外,差异表达基因显著富集的通路与RNA转运、氨基酸合成、光合作用等过程相关(表4)。
2.6 差异表达基因共表达分析
共表达分析有助于发掘基因调控网络的关键节点,为后续基因调控网络的深入解析提供参考。本研究对转录组测序揭示的差异表达基因进行了共表达分析。结果表明,Class I-like SAM-binding甲基转移酶基因(ID: GRMZM2G064759)下调表达。在基因共表达网络中,该基因与10个差异表达基因互作,包括DUF947结构域蛋白基因(ID: GRMZM2G051197)、寡肽转运类蛋白基因(ID: GRMZM2G434935)等。果糖-1,6-双磷酸酶编码蛋白基因(ID: GRMZM2G306732)上调表达,是共表达调控网络的关键调节因子。该基因与多个差异表达基因功能相关,包括编码纤维素-1,7-双磷酸酶的shbp1基因、编码磷酸核酮糖激酶基因(ID: GRMZM2G026024)等。基因共表达分析的结果表明,转录组测序揭示的差异表达基因可能存在一定的功能关联。
3 讨论
本研究所用矮秆材料是田间自然突变所产生,表现为植株矮化。在前期研究中,对该矮秆材料的农艺、生理特征进行了分析。结果表明,外源赤霉素施用可以使该矮秆材料的株高变高,表明该矮秆材料属于赤霉素敏感型矮秆种质[14]。本研究基于高世代回交种质,通过转录组测序,对矮秆材料的基因表达调控进行了解析。采用高世代回交种质,有利于降低遗传背景对基因表达的影响,提高转录组测序结果的可靠性。在高世代回交群体中,与株高正常植株相比,矮秆材料中共检测到2 537个基因差异表达,其中1 120个基因上调表达、1 417个基因下调表达。差异表达基因功能注释、GO富集、通路富集的结果表明,差异表达基因参与多个生物学过程,包括细胞延伸、微管组成、木质素合成、叶绿素合成、叶绿体功能、植物激素合成与信号转导等。供试矮秆材料的矮化可能与细胞延伸的缺陷相关。叶绿素合成、叶绿体功能的异常,可能与矮秆材料的叶缘白化相关。木质素合成的变化与矮秆材料茎秆质地的改变相关[14]。不同生物学过程存在一定的关联性。例如,植物激素赤霉素、生长素、油菜素内酯、细胞分裂素、独脚金内酯等互作,协同调控了多个生物学过程[21-25]。此外,已有证据表明,植物激素赤霉素影响叶绿体的产生[26]。本研究转录组测序结果表明,供试矮秆材料中存在着复杂的正向、反向、交叉基因调控网络,进而影响矮秆材料的表型。
通过比较不同矮秆材料的转录组数据,可以发掘共有的、特异的差异表达基因,为矮秆基因介导的调控网络的解析提供科学依据。通过检索数据库,未能获得d1、d3、d5、br2、na2、bv1、D8、D9等玉米矮秆材料的转录组数据。通过将本研究获得的转录组数据与数据库中玉米矮秆材料的转录组数据进行比较分析,有助于发掘本研究矮秆材料中特异的差异表达基因,特异差异表达基因的发掘可以为供试矮秆材料基因调控网络的解析提供重要参考。
参考文献:
[1] KHUSH G S. Green revolution: the way forward[J]. Nature Reviews Genetics,2001,2(10): 815-822.
[2] MONNA L,KITAZAWA N,YOSHINO R, et al. Positional cloning of rice semidwarfing gene,sd-1: rice ‘green revolution gene encodes a mutant enzyme involved in gibberellin synthesis[J]. DNA Research,2002,9(1): 11-17.
[3] SPIELMEYER W,ELLIS M H,CHANDLER P M. Semidwarf (sd-1), ‘green revolution rice,contains a defective gibberellin 20-oxidase gene[J]. Proceedings of the National Academy of Sciences of the United States of America,2002,99(13): 9043-9048.
[4] PENG J,RICHARDS D E,HARTLEY N M,et al. ‘Green revolution genes encode mutant gibberellin response modulators[J]. Nature,1999,400(6741): 256-261.
[5] MULTANI D S,BRIGGS S P,CHAMBERLIN M A,et al. Loss of an MDR transporter in compact stalks of maize br2 and sorghum dw3 mutants[J]. Science,2003,302(5642): 81-84.
[6] MAKAREVITCH I,THOMPSON A,MUEHLBAUER G J,et al. Brd1 gene in maize encodes a brassinosteroid C-6 oxidase[J]. PLoS One,2012,7(1): e30798.
[7] KIR G,YE H,NELISSEN H,et al. RNA interference knockdown of Brassinosteroid Insensitive1 in maize reveals novel functions for brassinosteroid signaling in controlling plant architecture[J]. Plant Physiology,2015,169(1): 826-839.
[8] DE SAINT GERMAIN A,LIGEROT Y,DUN EA,et al. Strigolactones stimulate internode elongation independently of gibberellins[J]. Plant Physiology,2013,163(2): 1012-1025.
[9] WENG J,XIE C,HAO Z,et al. Genome-wide association study identifies candidate genes that affect plant height in Chinese elite maize (Zea mays L.) inbred lines[J]. PLoS One,2011,6(12): e29229.
[10]PEIFFER J A,ROMAY M C,GORE M A,et al. The genetic architecture of maize height[J]. Genetics,2014,196(4): 1337-1356.
[11]李清超,李永祥,杨钊钊,等. 基于多重相关RIL群体的玉米株高和穗位高QTL定位[J]. 作物学报,2013,39(9): 1521-1529.
[12]TENG F,ZHAI L,LIU R,et al. ZmGA3ox2,a candidate gene for a major QTL,qPH3.1,for plant height in maize[J]. The Plant Journal,2013,73(3): 405-416.
[13]XING A,GAO Y,YE L,et al. A rare SNP mutation in Brachytic2 moderately reduces plant height and increases yield potential in maize[J]. Journal of Experimental Botany,2015,66(13): 3791-3802.
[14]WANG Y,LU W,CHEN Y,et al. Revealing physiological and genetic properties of a dominant maize dwarf Dwarf11 (D11) by integrative analysis[J]. Molecular Breeding,2016,36(3): 31.
[15]CONESA A,MADRIGAL P,TARAZONA S,et al. A survey of best practices for RNA-seq data analysis[J]. Genome Biology,2016,17: 13.
[16]LI R,YU C,LI Y,et al. SOAP2: an improved ultrafast tool for short read alignment[J]. Bioinformatics,2009,25(15): 1966-1967.
[17]ROBERTS A,PIMENTEL H,TRAPNELL C,et al. Identification of novel transcripts in annotated genomes using RNA-Seq[J]. Bioinformatics,2011,27(17): 2325-2329.
[18]GENE ONTOLOGY CONSORTIUM. Creating the gene ontology resource: design and implementation[J]. Genome Research,2001,11(8): 1425-1433.
[19]KANEHISA M,GOTO S,SATO Y,et al. KEGG for integration and interpretation of large-scale molecular data sets[J]. Nucleic Acids Research,2012,40(Database issue): D109-D114.
[20]LIVAK K J,SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) Method[J]. Methods,2001,25(4): 402-408.
[21]王江英,朱朋波,湯雪燕,等. 外源赤霉素诱导矮生山茶恨天高植株生长的转录组分析[J].江苏农业学报,2020,36(1):47-56.
[22]员盎然,孙小娟,马小雯,等. GA3与ABA对黑穗醋栗二次萌芽总酚含量及代谢酶活性的影响[J].南方农业学报,2019,50(6):1263-1270.
[23]刘达潍,刘诗琴,易鹏程,等.淹水胁迫下外源激素对甜瓜幼苗根系生理特性的影响[J].江苏农业科学,2019,47(9):182-185.
[24]曹 帅,杜仲阳,刘 鹏,等. 碱胁迫对大豆光合特性及内源激素含量的影响[J].江苏农业学报,2020,36(2):284-291.
[25]VANSTRAELEN M,BENKOVá E. Hormonal interactions in the regulation of plant development[J]. Annual Review of Cell and Developmental Biology,2012,28: 463-487.
[26]JIANG X,LI H,WANG T,et al. Gibberellin indirectly promotes chloroplast biogenesis as a means to maintain the chloroplast population of expanded cells[J]. The Plant Journal,2012,72(5): 768-780.
(责任编辑:陈海霞)
