人前列腺癌中己糖激酶-2基因对TH1/TH2细胞的影响
2020-10-13沈德赟葛庆宇夏开国
李 斌,陶 陶,沈德赟,葛庆宇,夏开国,肖 峻
近年来,针对肿瘤的研究方向偏向于肿瘤代谢活动,肿瘤细胞倾向于进行活跃的葡萄糖摄取与有氧条件下的糖酵解,即Warburg效应。然而有氧糖酵解相比于进行三羧酸循环并不能供给大量的ATP,但是有氧糖酵解却能提供细胞快速增殖需要的其他物质,如葡萄糖-6磷酸、果糖-6-磷酸等生物大分子,这些生物大分子是细胞增殖所需的原料,故而为了满足细胞增殖需要,提供相应的能量同时还需要应付肿瘤生长过程中不得不面对的各种不利环境,肿瘤细胞需要进行高度的有氧糖酵解[1]。己糖激酶2(hexokinase-2,HK-2)是肿瘤细胞糖酵解中第一步限速酶,集葡萄糖摄取和促进反应过程的功能于一体,因此它能产生更多的乳酸,明显改变肿瘤周围的酸性环境,对肿瘤周围的淋巴细胞功能产生影响[2]。该实验通过使用人前列腺癌PC3细胞系培养后的上清液和人外周血单个核细胞(PBMCs)构建体外共培养体系,在特定诱导分化TH1/TH2条件下,观察两种淋巴细胞的细胞因子分泌情况从而评估高表达的HK2对肿瘤细胞周围免疫细胞功能的改变。
1 材料与方法
1.1 细胞来源及培养前列腺癌细胞系PC3来源于安徽医科大学基础医学实验室。PC3细胞系用含有10%胎牛血清、2 mmol/谷氨酰胺、100 U/ml青霉素、100 μg/ml链霉素的RPMI1640培养基(美国Gibco公司)培养,细胞常规置于37 ℃、5% CO2培养箱,2~3 d换液1次。人PBMCs使用淋巴细胞提取液(天津灏洋华科生物科技有限公司)从健康成人外周血中提取,1 300 r/min离心30 min,取白膜层富含淋巴细胞层,连续1 000 r/min,用PBS洗涤2次,后置于上述相同培养条件下培养。
1.2 PC3培养上清液与TH1/TH2的共培养体系建立12孔板每孔种PC3细胞1×105个(实验组细胞与阴性对照细胞,即sh-HK2与NC),同时设置空白组,不加入PC3细胞。3组均放置于培养箱中培养48 h,分离PC3细胞计数细胞且同时获得3种培养上清液:空白培养上清液,NC培养上清液,sh-HK2培养上清液。后在培养上清液中加入106个PBMCs,使共培养体系体积为1 ml。TH1培养条件下加入5 μl/ml CD3抗体、1 μl/ml CD28抗体、1 μl/ml IL-2、20 μl/ml IL-12、2 μl/ml 抗IL-4抗体(美国RD公司)。TH2培养条件下加入5 μl/ml CD3抗体、1 μl/ml CD28抗体、1 μl/ml IL-2、10 μl/ml IL-4、2 μl/ml 抗 IFN-γ抗体(美国RD公司)。体系命名TH1空白组:空白培养上清液+PBMCs在TH1培养条件下继续培养,TH1 NC组:NC培养上清液+PBMCs在TH1培养条件下继续培养,TH1 sh-HK2组:sh-HK2培养上清液+PBMCs在TH1培养条件下继续培养。同理TH2 空白组、TH2 NC组、TH2 sh-HK2组培养条件改为TH2培养条件,余下不变。
体系建立后常规置于37 ℃、5% CO2培养箱48 h后,分离上清液与PBMCs,上清液用于乳酸浓度测定,PBMCs用PBS洗涤,重新放置于12孔板,更换新鲜1640培养液,加入5 μg/ml植物血凝素PHA-M(Absin),培养24 h后,TH1培养条件下PBMCs上清液用于检测 IFN-γ,TH2培养条件下PBMCs上清液用于检测IL-4[3]。
1.3 PC3细胞shRNA慢病毒载体HK2基因敲低稳转株使用针对HK2基因的shRNA构建慢病毒载体,后包装慢病毒载体,得到含有慢病毒颗粒的病毒液,使用慢病毒颗粒病毒液感染目的细胞,筛选出活细胞,即实验组细胞(sh-HK2),相同方法运用于构建阴性对照细胞(NC),针对HK2的基因shRNA序列换为无义序列。
1.4 实时荧光定量PCR(RT-qPCR)将HK2基因敲低后的实验组细胞(shRNA)和阴性对照细胞(NC)分别提取总RNA在0.2 ml PCR管(无RNase酶)中,加入总RNA,PCR仪上65 ℃加热5 min,立即冰浴3 min,逆转录为cDNA后-80 ℃保存备用。以cDNA作为模板进行PCR扩增。PCR反应条件:95 ℃预变性2 min,95 ℃变性20 s,60 ℃退火30 s,共40个循环。β-actin上游引物(5′→3′):CCCTGGAGAAGAGCTACGAG,下游引物(5′→3′):GGAAGGAAGGCTGGAAGAGT;HK2上游引物(5′→3′):GACGAGAGCATCCTCCTCAA,HK2下游引物(5′→3′):GTTCACCACAGCAACCACAT。
1.5 Western blot法检测NC和sh-HK2中HK2蛋白的表达6孔板中每个孔种NC及sh-HK2各1×106个,48 h后胰酶消化细胞,收集细胞。具体步骤为:提取蛋白标本;BCA测定各蛋白样本浓度;上样;上层浓缩胶电压80 V、60 min,Marker分离后分离胶120 V、90 min;按Marker指示切下需要部分;转膜:条件为200 mA、120 min;5%脱脂牛奶室温封闭1 h;HK2蛋白一抗(美国Abcom公司,1 ∶500稀释)4 ℃孵育过夜,二抗室温1 h;曝光。
1.6 乳酸浓度测定共培养体系建立后48 h,各培养体系中最终的上清液用于乳酸浓度测定。
获得PC3细胞培养上清液时,同时计数贴壁的PC3细胞数用于后续乳酸检测实验结果的比对,计数结果用于各培养体系最终乳酸浓度结果比较,运用TH1 空白组、TH2空白组乳酸值为基数,TH1 NC组、TH1 sh-HK2组、TH2 NC组、TH2 sh-HK2组中最终乳酸含量减去对应的空白组基数值再除以计数的PC3细胞数,显示每105个PC3细胞对TH1 NC组、TH1 sh-HK2组、TH2 NC组、TH2 sh-HK2组中乳酸含量的改变,消除因细胞增殖能力不同导致乳酸含量改变的影响。上清液按照乳酸浓度试剂盒(北京solarbio公司)说明书用可见分光光度仪测OD值,根据OD值,使用乳酸浓度试剂盒标样绘制的标准曲线检测出乳酸浓度。
1.7 ELISA法测定IFN-γ与IL-4水平根据ELISA试剂盒(美国RD公司)说明书操作检测。① 使用试剂盒中的标样配置IFN-γ与IL-4的标样,形成浓度梯度,作为样品参照;② 待测样品用去离子水稀释10倍,避免超过测量范围;③ 按说明书操作加样,清洗,显色;④ 使用酶标仪在450 nm处读出结果数值。
1.8 统计学处理数据通过SPSS 17.0软件进行统计学处理,每组实验重复3次。组间比较采用t检验,P<0.05为差异有统计学意义。采用Graphpad prism 8进行统计定量图绘制。
2 结果
2.1 RT-qPCR检测HK2转录水平与阴性对照细胞(NC)相比,使用针对HK2基因的shRNA作用于PC3细胞后产生的实验组细胞(sh-HK2)转录的HK2基因mRNA显著降低,差异有统计学意义(P<0.05)。见图1。
2.2 Western blot法检测HK2蛋白表达水平与阴性对照细胞(NC)相比,使用针对HK2基因的shRNA作用于PC3细胞后产生的实验组细胞(sh-HK2)表达的HK2蛋白显著降低,差异有统计学意义(P<0.01 )。见图2。
2.3 糖酵解乳酸检测使用共培养体系建立48 h后培养上清液检测乳酸浓度,在TH1共培养体系中,与TH1 NC组相比,TH1 sh-HK2组中乳酸含量显著降低, 差异有统计学意义(P<0.05,t=16.17),见图3A。在TH2共培养体系中,与TH2 NC组相比,TH2 sh-HK2组中乳酸含量显著降低,差异有统计学意义(P<0.05,t=15.95),见图3B。
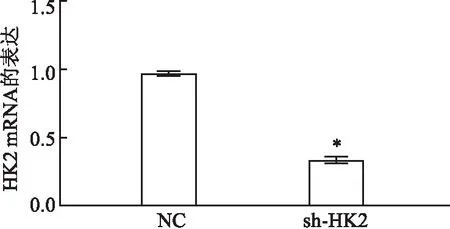
图1 RT-qPCR测定HK2基因mRNA表达
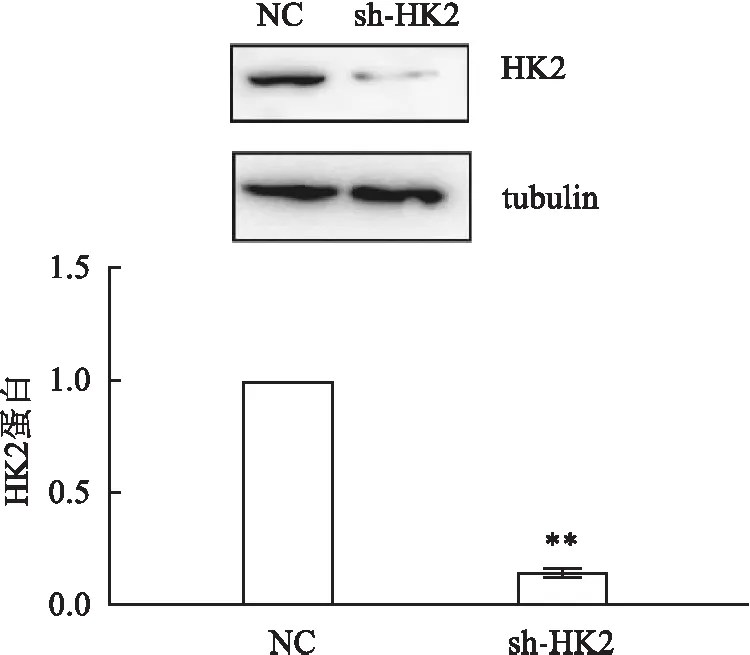
图2 Western blot法测定HK2蛋白表达
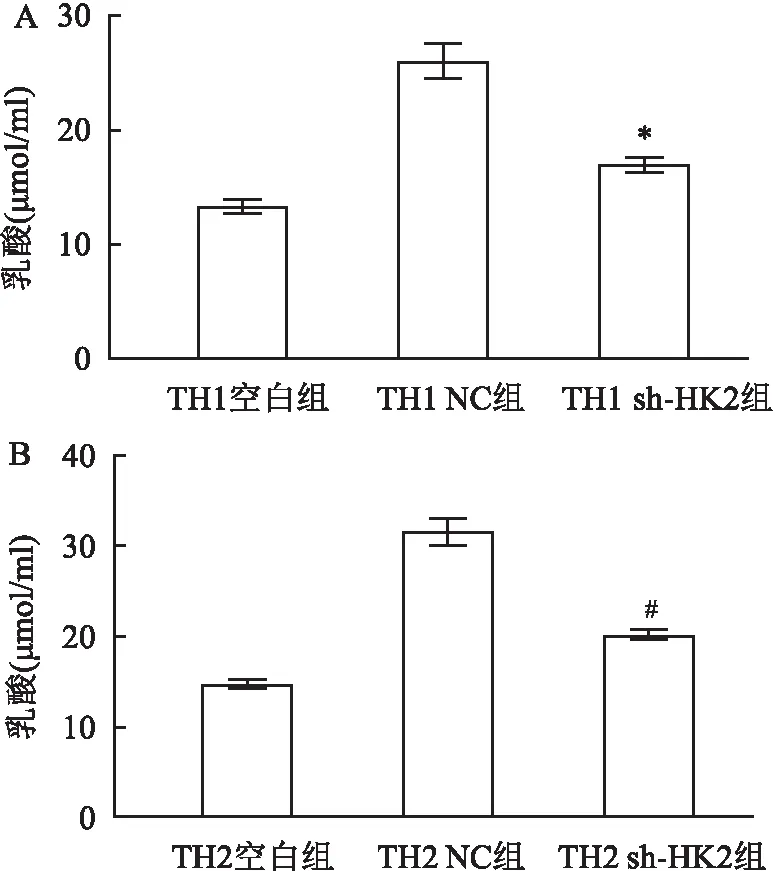
图3 TH1、TH2共培养体系中各组乳酸含量
在TH1共培养体系中,与TH1 NC组相比,TH1 sh-HK2组中每105个PC3细胞产生的乳酸改变显著降低,说明共培养体系中乳酸改变是由于PC3细胞产酸能力差别导致的,差异有统计学意义(P<0.05,t=21.54),见图4A。在TH2共培养体系中,与TH2 NC组相比,TH2 sh-HK2组中每105个PC3细胞产生的乳酸改变显著降低,说明共培养体系中乳酸改变是由于PC3细胞产酸能力差别导致的,差异有统计学意义(P<0.05,t=31.20),见图4B。
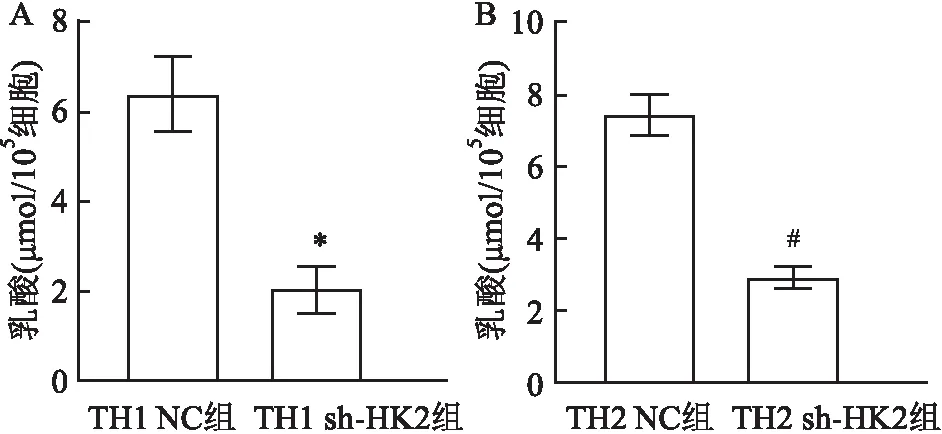
图4 TH1、TH2共培养体系中每105个PC3细胞数导致的乳酸改变
2.4 TH1共培养体系中PBMCs产生IFN-γ的能力在TH1空白组、TH1 NC组、TH1 sh-HK2组中,共培养完毕后分离提取PBMCs,使用PHA-M另外培养24 h后分离上清液测IFN-γ的浓度,结果显示相比于TH1 NC组,TH1 sh-HK2组中PBMCs产生IFN-γ能力显著升高,差异有统计学意义(P<0.05,t=10.13),见图5。
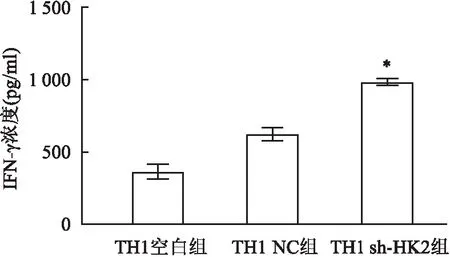
图5 TH1共培养体系中PBMCs产生IFN-γ的能力
2.5 TH2共培养体系中PBMCs产生IL-4的能力在TH2空白组、TH2 NC组、TH2 sh-HK2组中,共培养完毕后分离提取PBMCs,使用PHA-M另外培养24 h后分离上清液测IL-4的浓度,结果显示相比于TH2 NC组,TH2 sh-HK2组中PBMCs产生IL-4能力显著降低,差异有统计学意义(P<0.05,t=6.511),见图6。
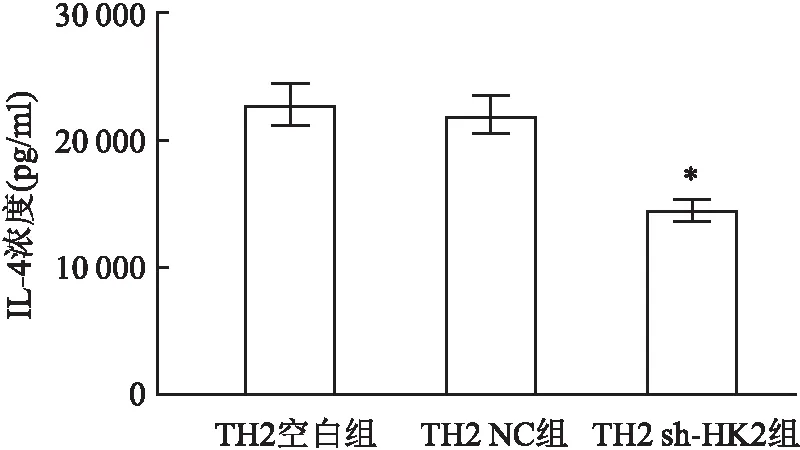
图6 TH2共培养体系中PBMCs产生IL-4的能力
3 讨论
恶性肿瘤细胞基因改变的一个表现即代谢程序的重新编程。在正常细胞中,常氧状态下,葡萄糖经过糖酵解途径和三羧酸循环(TCA)彻底氧化分解成水和二氧化碳,并大量生成ATP为细胞供能。而在肿瘤细胞中,为了满足肿瘤大量增殖的需求同时又要面对肿瘤生长过程中遇见的各种不利因素,肿瘤更倾向于进行有氧糖酵解过程,即葡萄糖最终生成乳酸过程中同时生成少量ATP。糖酵解过程中有三个关键酶:己糖激酶(HK)、6-磷酸果糖激酶1(PF1)和丙酮酸激酶(PK),HK2又因为其极低的米氏常数,兼备更加强大的葡萄糖摄取能力,增加了进入有氧糖酵解过程的葡萄糖量,使有氧糖酵解过程中生成的生物大分子物质用于肿瘤细胞增殖生长,这就是Warburg效应[4]。同时多项研究[5-7]显示:恶性肿瘤细胞中(包括前列腺癌)HK2基因高表达并且其与肿瘤恶性度高度相关。相应的肿瘤细胞的代谢改变也将导致肿瘤周围免疫细胞代谢及表型改变[8],研究发现即使肿瘤细胞抗原性强度足够的情况下,若周围T淋巴细胞葡萄糖摄取不足依然将导致T淋巴细胞激活抑制,肿瘤细胞对肿瘤微环境中葡萄糖的大量摄取可以抑制周围T淋巴细胞的糖酵解能力,mTOR活性和IFN-γ的产生[9-10],同时产生的高乳酸水平也将使肿瘤周围T细胞分泌IFN-γ下降及凋亡诱导[2,11]。可见乳酸是可以作为一个肿瘤增殖的提示因子,特别是在肿瘤对周围免疫细胞影响的方面上。
TH1作为辅助性CD4+ T细胞,其分泌的 IFN-γ是肿瘤细胞免疫的关键细胞因子,最终参与促进效应CD8+ T细胞活化与功能完全[12],甚至能直接抑制肿瘤细胞增殖[13]。TH2同样作为辅助性CD4+ T细胞,其主要功能是促进体液免疫及炎症,其分泌的IL-4更是有抑制TH0细胞向TH1方向分化的作用[14],同时在肿瘤周围酸性环境中,因为TH2细胞功能增强,将导致TH1细胞功能相对下降,最终导致针对肿瘤的细胞免疫功能下降,进而导致肿瘤进展。
本实验乳酸检测结果显示HK2基因受到抑制后,其产酸能力下降,同时TH1共培养体系中,IFN-γ浓度升高,TH2共培养体系中IL-4浓度降低,表示HK2抑制后,TH1由于低酸环境与葡萄糖摄取相对增多导致分泌IFN-γ增多,可以推断针对肿瘤细胞免疫功能将增强,后期CD8+T效应细胞、NK细胞活化增多,同时CD8+T效应细胞、NK细胞也分泌IFN-γ,将参与针对肿瘤的细胞免疫的维持与扩大化。IL-4浓度降低说明肿瘤细胞周围针对肿瘤无用的体液免疫与促炎反应减少,同时也减弱了IL-4抑制TH1活化的功能,使更多的参与细胞免疫的效应细胞活化。从侧面说明HK2抑制后针对肿瘤细胞免疫将增强。实验结果支持前列腺恶性肿瘤中高表达的HK2基因导致TH1细胞分泌 IFN-γ下降和TH2细胞分泌IL-4上升,进而抑制抗肿瘤细胞免疫功能。说明在前列腺癌的免疫治疗方面,HK2基因是可以作为一个潜在的治疗靶点,它可以改善肿瘤周围免疫微环境中免疫细胞的供能,减轻肿瘤酸性环境对免疫细胞的抑制作用,增强肿瘤免疫疗法的疗效。
