一起鹦鹉多重混合感染的诊治
2020-10-10
(青岛农业大学,山东青岛 266109)
鹦鹉喙羽病是由喙羽病病毒(psittacine beak and feather disease virus,PBFDV)引起的一种常见的鹦鹉传染病,患病鹦鹉羽毛、喙部变形,胸腺及法氏囊结构异常,通常造成幼雏死亡[1],可垂直传播;按病程长短可分为急性型、慢性型和亚临床型,急性型常发生于幼雏,患病鹦鹉突然死亡[2],慢性型和亚临床型常发生于成年鹦鹉,导致羽毛、喙和爪子畸形[3]。喙羽病于20世纪70年代在澳大利亚首次被发现,之后随着活禽贸易而蔓延至全球[4]。PBFDV属于圆环病毒科(Circoviridae)圆环病毒属(Circovirus)成员,为单链环形DNA病毒[5],基因组大小为2 000 bp,编码复制相关蛋白(replication-associated protein,Rep)和衣壳蛋白(capsid protein,Cap)2 个主要蛋白[2,5]。电镜观察病毒呈14~16 nm无包膜二十面体[6]。鹦鹉幼雏病(budgerigar fledgling disease,BFD)是由禽多瘤病毒(avian polyomavirus,APV)引起的急性传染病,是目前对鹦鹉危害最为严重的传染病之一[7],3周龄以下的鹦鹉雏鸟易感,表现为羽毛发育迟缓、消瘦、腹部肿胀和神经症状等,致死率极高。BFD于1980年初首先在美国被发现,随后在澳大利亚、日本、意大利、匈牙利、斯洛伐克和德国等被陆续报道,现已蔓延至世界各地[8]。我国于1994年首次在湖北省发现该病,并确认该病由APV引起[9]。APV为乳多空病毒科(Polyomaviridae)多瘤病毒属(Polyomavirus)成员,为无囊膜、环形双链 DNA[10],基因组大小为4 981 bp,编码Large T、Small t、VP1、VP2、VP3、VP4 和 VP4 Delta 等7种蛋白[11]。
鹦鹉作为一种观赏鸟类,越来越受人们的喜爱,因而鹦鹉养殖业随之兴起。随着鹦鹉养殖业的扩大和进口量的增加,疾病也越来越多。PBFDV和APV是感染鹦鹉的常见病毒,严重危害鹦鹉的健康,对鹦鹉养殖业带来巨大影响,导致严重经济损失。2019年12月山东省青岛市某虎皮鹦鹉养殖场2~3周龄幼鸟出现腹泻、脱水、腹部肿大,嗉囊饱满,排白绿色粪便,粪便糊肛,发育迟缓等临床症状,大量鹦鹉幼雏死亡,死亡率达到80%。成鸟无死亡,无明显发病症状,产蛋正常。该场鹦鹉未接种过任何疫苗,发病后曾用恩诺沙星、土霉素、双黄连等药物进行治疗。本研究对该养殖场的患病幼鸟进行了临床诊断,使用PCR方法进行了相关病毒检测,无菌采集发病幼鸟组织进行细菌分离鉴定等细菌学检测,确诊为PBFDV、APV及链球菌混合感染,并提出相应的治疗措施。
1 材料与方法
1.1 病理剖检及病料采集
对送检的死亡和发病的10~15日龄的虎皮鹦鹉幼鸟进行病理剖检观察,无菌采集发病鹦鹉的肝脏、肺脏及心包积液进行病原检测。
1.2 实验室检测及药敏试验
1.2.1 主要试剂 TSA、TSB培养基及革兰氏染色液,均购自青岛海博生物有限公司;MiniBEST Viral DNA/RNA Extraction Kit Ver.5.0试剂盒,购于宝日医生物技术有限公司(TaKaRa);一步法PCR试剂盒(Dye Plus),购自诺唯赞生物科技有限公司;禽腺病毒及鹦鹉热衣原体荧光定量PCR试剂盒,购自青岛巴特菲生物科技有限公司;细菌核酸提取试剂盒,购自天根生化科技(北京)有限公司;药敏纸片,购自杭州天和微生物试剂有限公司。
1.2.2 PCR检测 根据参考文献合成PBFDV、APV、新城疫病毒(NDV)、禽流感病毒(AIV)引物,由青岛擎科梓熙生物技术有限公司合成(表1)。无菌采集适量发病鹦鹉的肝、肺组织研磨后取上清,使用病毒核酸提取试剂盒提取上清液中的病毒核酸(DNA/RNA)采用普通PCR方法检测PBFDV、APV、NDV及AIV用荧光定量试剂盒检测禽腺病毒和衣原体。

表1 PCR检测引物
1.2.3 细菌分离鉴定 无菌采集鹦鹉肝脏及心包积液,划线接种于TSA培养基及血琼脂培养基上,37 ℃恒温培养18 h。挑取单个纯菌落,进行革兰氏染色镜检。取分离得到的单个菌落接种到肉汤试管中培养增菌,过夜培养菌液,使用细菌基因组DNA提取试剂盒提取细菌DNA,利用通用引物[15]扩增细菌16S rDNA,PCR产物送北京擎科新业生物技术有限公司测序,所得序列进行BLAST比对分析。
1.2.4 药敏试验 操作程序参考李桂喜等[16]试验方法。采用纸片琼脂扩散法对分离得到的菌株进行阿莫西林克拉维酸、强力霉素、头孢他啶、头孢曲松、妥布霉素、大观霉素、庆大霉素、多粘菌素B、林可霉素、左氧沙星、环丙沙星、氟苯尼考、磺胺甲恶唑等药物的药敏试验,用游标卡尺测量抑菌圈直径,根据美国NCCLS药敏试验标准判定药物的敏感性。
2 结果
2.1 临床病理剖检
剖检发现:肝脏表面有大小不等的黄白色坏死灶,呈大理石样外观(图1-A);心包积液,心肌出血;腹腔积液呈黄色,有胶冻样渗出(图1-B);十二指肠出血(图1-C),肌胃出血;肺出血,气管环出血(图1-D),输尿管有白色尿酸盐沉积,脾脏肿大。
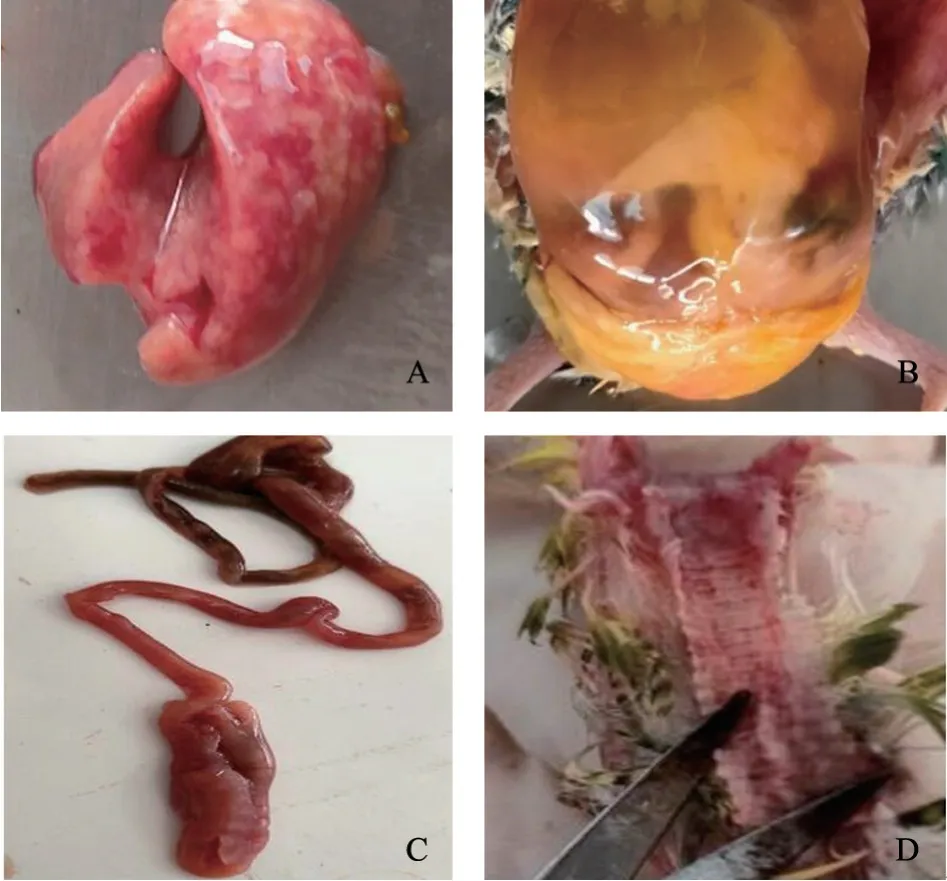
图1 病理剖检结果
2.2 实验室检测
2.2.1 PCR检测 对提取的核酸进行PCR、RTPCR以及荧光定量PCR扩增,结果NDV、AIV、禽腺病毒、衣原体均为阴性。PBFDV、APV的PCR扩增目的条带与预期大小一致,分别为495 bp、318 bp,PBFDV在肝组织检测为阳性,肺组织为阴性;APV在肝、肺组织均检测为阳性(图2)。
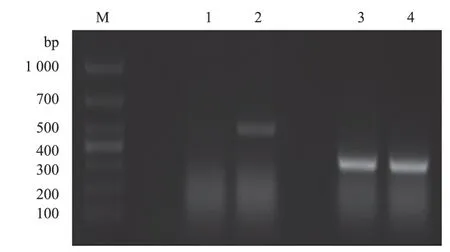
图2 PCR检测结果
2.2.2 细菌分离鉴定 TSA培养基上出现半透明、圆形、表面光滑、整齐的菌落(图3-A),血琼脂平板上出现不同程度的溶血(图3-B),革兰氏染色阳性,呈单个或双链排列,有些呈短链状排列(图3-C)。对提取的细菌核酸进行PCR扩增,得到长度为1 428 bp的目的条带(图4),与预期片段大小相符。PCR产物测序结果经BLAST比对分析确定该分离菌株为链球菌。
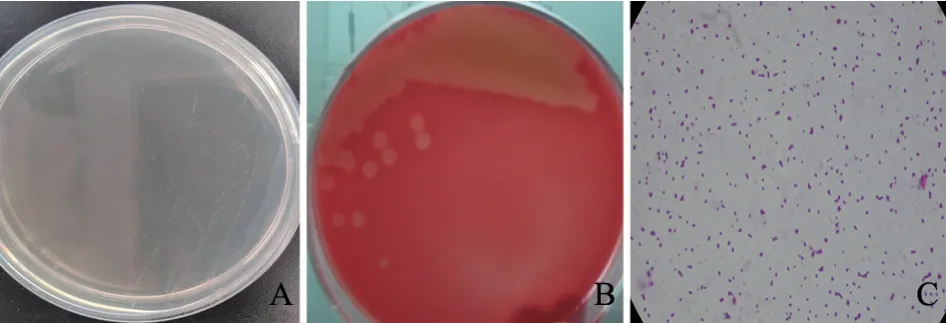
图3 细菌分离鉴定结果
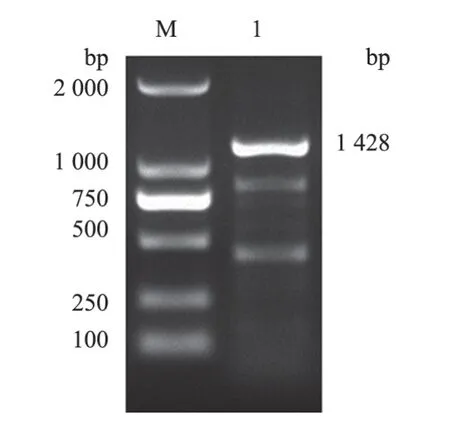
图4 16sDNA PCR检测结果
2.2.3 药敏试验 药敏试验结果(表2)显示,该分离菌对阿莫西林克拉维酸高度敏感,强力霉素中度敏感,而对头孢他啶、头孢曲松、妥布霉素、大观霉素、庆大霉素、多粘菌素B、林可霉素、左氧沙星、环丙沙星、氟苯尼考、磺胺甲恶唑不敏感。
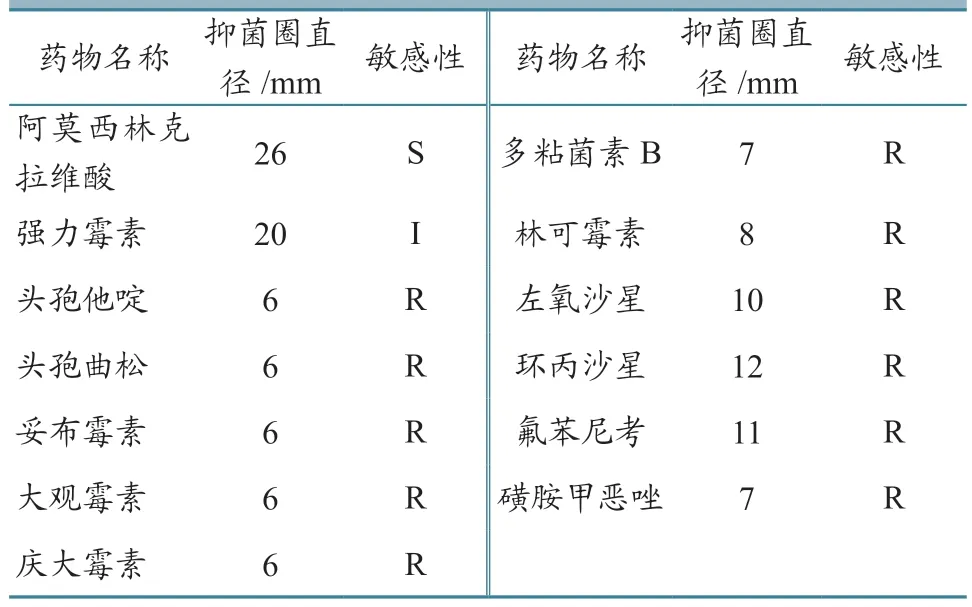
表2 药敏试验结果
3 防治
PBFDV和BFD目前尚无有效的治疗药物和疫苗。根据药敏试验结果对链球菌进行抗菌治疗,建议该场鹦鹉使用阿莫西林克拉维酸饮水5 d。同时建议鹦鹉养殖场的主人做好,严格消毒;保持鸟舍良好的环境卫生和丰富的营养饲料,饲料或饮水中加入适量的维生素、微量元素等营养成分,以提高免疫力。及时淘汰病鸟,防止疾病的传播和蔓延。场长反馈用药5 d后死亡率有所下降。
4 讨论
PBFD和BFD是鹦鹉的常见传染病,在鹦鹉养殖中较为多发,危害严重,对幼雏影响较大,致死率较高,成年鹦鹉无明显的临床症状,这为养殖场的疾病预防工作造成了极大影响。本研究针对青岛市某鹦鹉养殖场的发病情况进行了相关病毒PCR检测,结果显示PBFDV和APV呈阳性,排除了流感病毒、新城疫病毒、腺病毒以及衣原体的感染,并分离鉴定出链球菌,确诊该病例为PBFDV、APV及链球菌混合感染。PBFDV和APV感染鹦鹉的研究早已被多次报道,曾有研究者证明,1994年BFD在我国已经开始传播,并证明病原为APV[9]。APV引起BFD的病例被发现的时间较早,但始终没有引起人们重视。PBFD于20世纪70年代在澳大利亚首次被发现,之后随着活禽贸易而蔓延至全球[4]。蒋文明等[12]在2009年首次报道了PBFDV在我国大陆地区鹦鹉种群的传播,后PBFDV也陆续在我国养殖场中检出,但始终没有引起人们的重视。Fogell等[17]在8个没有报道过PBFDV的国家中检测出PBFDV,表明该病毒的分布比目前所掌握的更广泛。有研究发现,活禽贸易是PBFDV传播的重要方式[18]。因此,需要加强鹦鹉疾病的检测与防控工作,以及进口鹦鹉的防疫检测,建立合理有效的鹦鹉病检疫程序,以保证鹦鹉养殖业的平稳发展。PBFDV和APV混合感染的情况比较多见,而且PBFD和BFD症状相似,在诊断时要做到准确诊断,做好鉴别区分,如1998年Ramis等[19]首次在鹦鹉养殖舍中发现PBFDV和APV的混合感染,吴汝娟等[20]对青岛市的发病鹦鹉进行PCR检测,发现存在PBFDV和APV的双重感染。在疾病过程中常常继发细菌感染,因此对致病菌的检测必不可少。本研究在患病鹦鹉的肝脏组织中分离鉴定出链球菌。链球菌为条件性致病菌,通常在一定诱因的作用下才会发病。本研究推断,该养殖场发病的原因可能是由于冬季温度降低,舍内通风不良,导致PBFD、BFD及链球菌的混合感染。药敏试验结果显示,该菌对阿莫西林克拉维酸高度敏感,而对头孢他啶等多种药物均耐药,所以临床使用抗生素一定要选用敏感药物,切忌乱用药,以免造成更大的损失。
近年来,我国引进大量鹦鹉,造成外来鹦鹉疾病的传播,但对于鹦鹉疾病的研究却很少。由于对疾病的认识不足以及不够重视,导致许多疾病的防疫工作难以进行,治疗也无计可施。希望本研究能引起广大鹦鹉养殖户的重视,也为PBFD和PFD的防治提供一定的参考。
