姜黄素对婴儿血管瘤内皮细胞增殖、凋亡的影响及机制①
2020-09-29符垂师冯业成海南医学院第一附属医院儿科海口570102
符垂师 云 川 冯业成 黄 天 (海南医学院第一附属医院儿科,海口 570102)
婴幼儿血管瘤(infantile hemangioma,IH) 是婴幼儿最常见良性肿瘤,由中胚叶血管内皮细胞过度增殖所致[1]。IH通常发病于婴幼儿出生或出生后 3~6 个月内,发病率约为3%~10%,发病机制尚未明确,目前治疗手段主要为广泛性冷冻、放射疗法及口服类固醇类药物等,多种新治疗手段如干扰素、硬化剂、激光等也可用于IH治疗,但副作用较大[2]。姜黄素是从姜黄中提取的酚类色素,具有多种药理作用,其抗肿瘤作用不仅与抗肿瘤血管生成有关,还可诱导肿瘤细胞凋亡[3]。目前姜黄素用于婴幼儿IH治疗的作用及机制鲜有报道。本研究旨在探讨姜黄素对HemECs增殖、凋亡的影响及机制。
1 材料与方法
1.1材料
1.1.1试剂与仪器 姜黄素购自美国 Sigma公司;HIF-1α、VEGF抗体购自美国 Santa Cruz公司;Trio(A4902-1)购自美国 Invitrogen公司;兔抗人Ⅷ因子、CD31、CD34抗体购自武汉博士德公司;MCL-1、cl-Caspase-3和cl-PARP抗体及其二抗购于Santa Cruz 公司;Annexin Ⅴ/FITC凋亡检测试剂盒购自美国 Qbiogene 公司;RT-qPCR试剂盒购自日本 TaKaRa公司;Trizol 购自Invitrogen公司;Real-time PCR仪购自美国ABI公司;CO2培养箱购自美国 Thermo Scientific公司;FASCalibur流式细胞仪购自美国BD公司;荧光显微镜购自德国Zeis公司;ELX800UV 酶标仪购自美国 Bio-Tek 公司。
1.1.2组织来源 1例IH组织标本来源于我院小儿外科,3个月龄,男性,家属知情同意。
1.2方法
1.2.1细胞培养与鉴定 参照文献[4],取新鲜IH标本,剪成1~2 cm3组织块,酶消化法分离培养HemECs。将消化后的组织块剪碎至约1 mm3,接种于培养皿(1%明胶包被),加入内皮细胞培养基(含10%胎牛血清的RPMI1640培养基),37℃、5%CO2孵育。免疫荧光法鉴定 HemECs特异性表面标志物Ⅷ因子、CD31和CD34。
1.2.2CCK-8检测HemECs增殖 将HemECs接种于96孔培养板(3 000个/孔),孵育过夜,加入含不同浓度姜黄素(12.5、25、50、100 μmol/L)的培养液或DMSO(对照)培养液作用48 h,加入CCK-8试剂0.01 ml,孵育 4 h,取出后于酶标仪450 nm处测定各孔吸光度(A)。
1.2.3台盼蓝法染色 取各组细胞接种于96孔板,培养2 h后弃上清,PBS清洗,加0.4%台盼蓝溶液20 μl,静置2 min,吸去染液,PBS清洗,显微镜下观察并计数,台盼蓝染色呈蓝色为死细胞。
1.2.4流式细胞仪检测细胞凋亡 将HemECs接种于培养皿,加入含25 μmol/L姜黄素或DMSO(对照)培养48 h,收集细胞悬液,1 500 r/min离心5 min,Annexin V-FITC/PI试剂盒染色,流式细胞仪检测细胞凋亡情况。
1.2.5电镜观察凋亡细胞 将HemECs接种于培养皿,加入25 μmol/L姜黄素或DMSO(对照)培养48 h,5 000 r/min离心20 min,弃上清,加入500 μl戊二醛固定,透射电镜观察。
1.2.6免疫荧光分析 参考文献[5],调整细胞悬液密度为2×104/ml,加入25 μmol/L姜黄素或DMSO(对照)作用24 h后,PBS清洗,4%多聚甲醛室温固定,0.5% Tritonx-100室温作用10 min;3%H2O2室温作用20 min,羊血清室温封闭30 min,加入一抗4℃孵育过夜,PBS清洗,加入荧光标记的二抗,37℃孵育1 h,滴加终浓度为5 mg/L加入DAPI,避光染色,封片,荧光显微镜下检测拍照。
1.2.7RT-qPCR法检测HIF-1α mRNA表达 将HemECs接种于培养皿,加入25 μmol/L姜黄素或DMSO(对照)培养24 h,收集细胞。按照Trizol试剂盒说明书操作,提取各组细胞总RNA,反转录为cDNA,SYBER Green法实时荧光定量PCR仪检测。引物由上海生工公司合成,HIF-1α F:5′-GTCAGGAGACAACCACG-3′,R:5′-TGAATGGCCTGTGCA-GTG-3′;VEGF F:5′-TGTAAGGACGAAACGGGACT-3′,R:5′-AAAGCCAGCAGCAATTTCT-3′;GAPDH F:5′-CCAGGGCTTTTAACTC-3′,R:5′-GCTCCCCCGC-AAATGA-3′。2-ΔΔCt法计算。
1.2.8Western blot检测MCL-1、cl-Caspase-3和cl-PARP蛋白表达 收集细胞,预冷 PBS 清洗,加入RIPA 裂解液提取总蛋白。 BCA 法测定总细胞提取液中蛋白浓度,取总蛋白25 μg上样。经SDS-PAGE 分离,转膜,置于 5% 脱脂奶粉中封闭2 h,加入一抗4℃孵育过夜,TBST 缓冲液洗涤,加HRP 标记二抗室温孵育1 h,TBST缓冲液洗涤,ECL化学发光法显色。
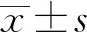
2 结果
2.1HemECs分离、鉴别 免疫荧光染色检测显示,细胞表面Ⅷ因子、CD31、CD34均显强阳性,提示从IH组织中分离的细胞为HemECs,见图1。
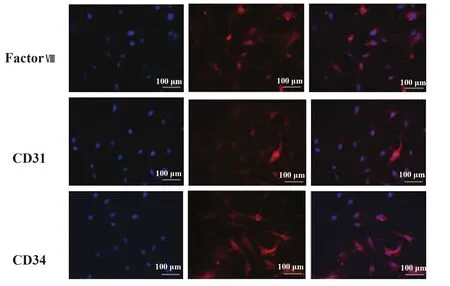
图1 HemECs鉴别(×200)
2.2姜黄素对HemECs增殖的抑制作用 CCK-8结果显示,48 h后不同浓度姜黄素均能抑制HemECs增殖,且姜黄素处理48 h后HemECs的IC50为31 μmol/L,台盼蓝法检测结果显示,姜黄素治疗48 h后HemECs死亡呈剂量依赖性,见图2。
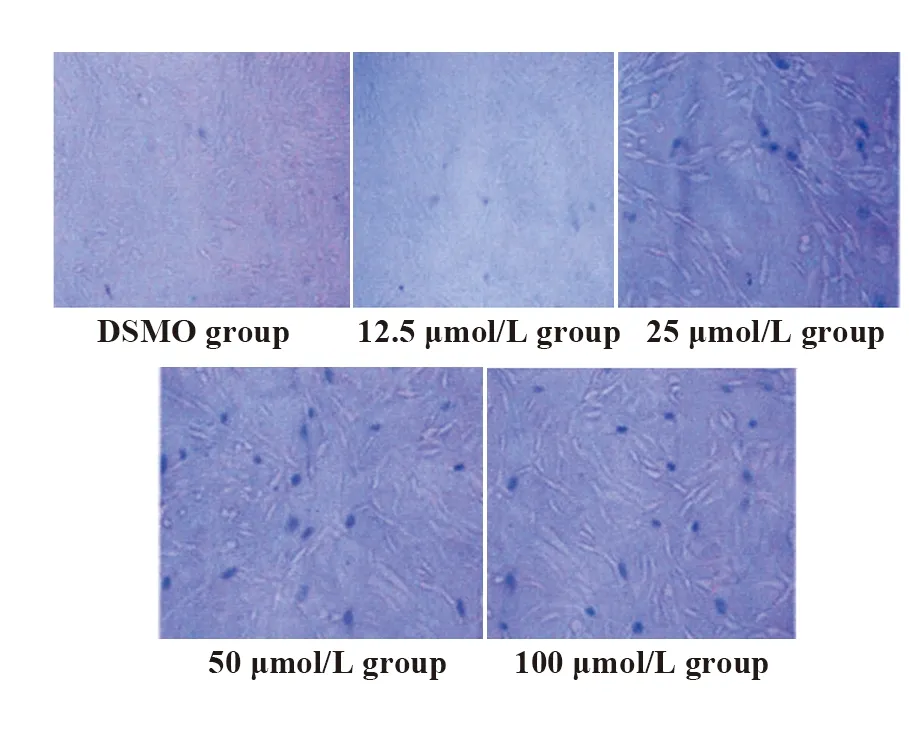
图2 姜黄素对HemECs增殖的抑制作用(×400)
2.3流式细胞仪检测HemECs凋亡及电镜观察结果 流式细胞仪检测结果显示,对照组和姜黄素组HemECs凋亡率分别为(3.9±0.2)%、(33.6±3.6)%,差异有统计学意义(P<0.05),见图3;透射电镜观察结果显示,对照组IH内皮细胞胞膜完整、胞浆均一,具有相对正常的内质网及线粒体结构。姜黄素组肿瘤细胞出现凋亡形态学特征,细胞膜形态基本完整,但核内染色质浓缩、细胞核形态不规则,发生碎裂,同时细胞内可见凋亡小体形成,见图4。
图3 流式细胞仪检测HemECs凋亡

图4 电镜观察HemECs结构变化(×700)
2.4姜黄素对HemECs中HIF-1α和VEGF表达的影响 免疫荧光结果显示,与对照组相比,48 h后姜黄素下调HIF-1α 和VEGF蛋白表达,见图5;RT-qPCR结果显示,姜黄素可明显抑制HemECs中HIF-1α mRNA及VEGF mRNA表达(P<0.05),见图6。
2.5HemECs中MCL-1、cl-Caspase-3和cl-PARP蛋白表达 Western blot结果可知,姜黄素组MCL-1蛋白表达水平明显低于对照组(P<0.05),而cl-Caspase-3 和cl-PARP蛋白表达明显高于对照组(P<0.05),见图7。
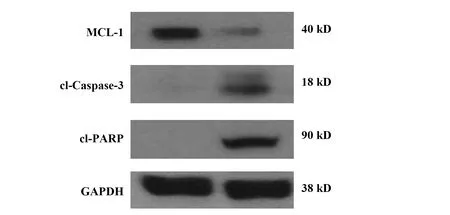
图7 Western blot检测HemECs MCL-1、cl-Caspase-3和cl-PARP蛋白表达
3 讨论
姜黄属姜科植物,主要生长于热带和亚热带地区。姜黄素为姜黄的主要活性成分,具有消肿止痛、行气活血、通经止痛等作用。研究表明,姜黄素具有抗微生物、清除自由基、抗炎、抗氧化、抗癌、抗肝纤维化、抗动脉粥样硬化等药理作用[6]。姜黄素可通过不同途径诱导肿瘤细胞凋亡,且对正常细胞无影响。美国国立肿瘤研究所已将姜黄素作为抗突变剂和抗癌剂列为第3代抗癌化学药,其抗肿瘤作用可通过多种信号传导途径实现,如细胞凋亡、免疫调节、细胞增殖、血管生成、浸润和转移等[7]。
缺氧诱导因子 HIF-1(hypoxia inducible factor-1,HIF-1)是最重要的低氧转录调节因子,在缺氧的肝癌细胞核提取物中发现[8]。 HIF-1α 是HIF-1的亚基,是唯一的氧调节单位,决定HIF-1活性,可促进肿瘤增殖、新生血管形成及维持肿瘤细胞的量代谢;VEGF是具有内皮细胞特异性的有丝分裂原,通过特异性受体VEGFR介导其生物学效应,诱导血管及淋巴内皮细胞增殖,促进多种肿瘤血管形成和肿瘤生长[9]。本研究发现,48 h后不同浓度姜黄素均可抑制HemECs增殖,且呈剂量依赖性。免疫荧光结果显示,48 h后姜黄素下调HIF-1α 和VEGF蛋白表达,RT-qPCR结果显示,姜黄素能明显抑制HemECs中HIF-1α mRNA表达,提示姜黄素可抑制HemECs中HIF-1α蛋白表达,从而下调VEGF蛋白表达,上调其抗增殖活性,与既往研究结论一致[10]。HIF-1α可在正常和肿瘤细胞中调节MCL-1转录,表明抑制HIF-1α也可抑制MCL-1表达[11]。
流式细胞仪检测结果显示,对照组和姜黄素组HemECs凋亡率差异具有统计学意义,透射电镜观察结果显示姜黄素处理后HemECs超微结构具有凋亡形态学特征。同时,Western blot检测姜黄素组HemECs中cl-Caspase-3蛋白表达明显升高,提示姜黄素可诱导HemECs凋亡。
细胞凋亡是指细胞在一定生理或病理条件下出现的正常的选择性死亡,由于其被细胞内部某些特定基因所操纵,故称程序性死亡。过度凋亡可能会引发神经退行性疾病、中风、心脏衰竭等,而抑制凋亡则与肿瘤等疾病发生有关。髓细胞白血病基因-1(myeloid cell leukemin-1,MCL-1)是Bcl-2家族基因中抗细胞凋亡成分,MCL-1基因在人多种肿瘤细胞中高表达,且和肿瘤耐药性关系密切。研究显示,MCL-1作用于 Caspase-3 上游,其裂解产物可促进细胞凋亡,Bcl-2 家族蛋白激活可诱导线粒体膜透化,调节Cyt-C在线粒体中的释放进而激活Caspase-9前体,最终引起Caspase-3剪切活化,导致细胞凋亡[12,13]。Caspase-3 在细胞凋亡中扮演死亡执行者角色,参与多种重要细胞成分切割,如DNA依赖的蛋白激酶(DNA-PK)、聚ADP核糖聚合酶(PARP)等,从而促进细胞凋亡[14]。PARP广泛存在于真核细胞核内,是细胞活力的稳定器和DNA损伤的感受器,可识别结构损伤DNA片段而被激活,进而修复损伤的DNA。c-PARP是细胞凋亡的特征性标志物,其无法识别损伤DNA,但具有DNA修复的聚合酶活性,聚集于细胞质[15]。本研究Western blot检测结果显示,姜黄素组MCL-1蛋白表达明显低于对照组,而cl-Caspase3 和cl-PARP蛋白表达水平明显高于对照组,表明姜黄素可能通过下调HemECs中MCL-1表达,从而上调下游因子Caspase-3及cl-PARP表达,促进细胞凋亡。
综上所述,本研究显示姜黄素可在体外剂量依赖性抑制HemECs增殖、凋亡,其机制可能为抑制MCL-1和HIF-1α表达,从而上调cl-Caspase-3 和cl-PARP表达,但具体机制有待进一步研究。
