鱼藤素对急性髓系白血病KG-1a细胞增殖和凋亡的影响及机制
2022-01-21赵小强吴雅莉仝佳音席晓平程英英杨海平
赵小强,吴雅莉,仝佳音,席晓平,程英英,杨海平
(河南科技大学第一附属医院/河南科技大学临床医学院血液内科,河南 洛阳 471000)
急性髓系白血病(acute myeloid leukemia,AML)是造血干细胞发生异常增殖的一种恶性疾病,病死率较高[1]。随着多药联合化学治疗、免疫治疗、造血干细胞移植等的应用,AML的预后得以改善,但化学治疗毒副作用大、完全缓解率低、易复发且易发展为难治性白血病;免疫治疗通过人为增强或抑制机体的免疫功能以达到治疗疾病目的,容易影响自身免疫系统;造血干细胞移植可根治该病,但来源不足[2-3]。鱼藤素是从一种自豆科植物绢毛萌豆中分离的拟鱼藤酮类化合物,具有抗病毒、抗肿瘤等药理作用,已被证实对肝癌、乳腺癌细胞有增殖抑制及凋亡诱导作用,且可增强肿瘤细胞对放射治疗和化学治疗的敏感性[4-5]。但目前关于鱼藤素对AML治疗作用及相关机制的研究尚少[6-7]。因此, 本研究旨在探讨鱼藤素对AML KG-1a细胞增殖、凋亡的影响及机制,以期为AML的临床治疗提供参考。
1 材料与方法
1.1 细胞、试剂与仪器AML KG-1a细胞购自上海名劲生物科技有限公司;RPMI 1640培养基购自北京诺为生物技术有限公司,胰蛋白酶购自深圳乐芙生物科技有限公司,鱼藤素购自湖州展舒生物科技有限公司,氯化锂(lithium chloride,LiCl)购自江西赣锋锂业股份有限公司,二甲基噻唑(dimethylthiazole,MTT)溶液、二甲基亚砜(dimethyl sulfoxide,DMSO)溶液购自上海士锋生物科技有限公司,Annexin V binding buffer标记液、Annexin V-异硫氰酸荧光素(fluorescein isothiocyanate,FITC)、碘化丙啶(propidium iodide,PI)购自北京中杉金桥生物技术有限公司,TRIzol试剂盒、反转录试剂盒均购自美国Invitrogen公司,实时荧光定量聚合酶链反应(quantitative real-time polymerase chain reaction,qRT-PCR)试剂盒、SYBR Green Mix、二喹啉甲酸(bicinchoninic acid,BCA)蛋白定量试剂盒购自美国Sigma公司,放射免疫沉淀(radio-immunoprecipitation,RIPA)裂解液购自西安赫特生物科技有限公司,兔抗人S期激酶相关蛋白2(S-phase kinase-associated protein 2,SKP2)一抗、β-链接素(β-catenin)一抗、聚腺苷酸二磷酸核糖转移酶[poly (ADP-ribose) polymerase,PARP]一抗、山羊抗兔IgG二抗购自美国Sigma公司,电化学发光(electrochemiluminescence,ECL)显色液购自上海西唐生物科技有限公司;倒置显微镜购自日本奥林巴斯株式会社,Tecan-5082 Sunrise型全自动酶标仪购自奥地利TECAN公司,Amnis ImageStream X MK Ⅱ型流式细胞仪购自德国Luminex公司;引物由生工生物工程(上海)股份有限公司合成。
1.2 研究方法
1.2.1 细胞培养及分组将KG-1a细胞接种于含体积分数10%胎牛血清的RPMI 1640培养基,置于37 ℃、含体积分数5% CO2、饱和湿度细胞培养箱中培养。待细胞生长至密度75%时,用胰蛋白酶消化并传代,2~3 d传代1次。取对数生长期KG-1a细胞,胰蛋白酶消化后以每孔1×108L-1个细胞接种于6孔板,随机分为0.00 nmol·L-1鱼藤素组、10.00 nmol·L-1鱼藤素组、20.00 nmol·L-1鱼藤素组、40.00 nmol·L-1鱼藤素组、80.00 nmol·L-1鱼藤素组,分别用含有0.00、10.00、20.00、40.00、80.00 nmol·L-1鱼藤素的培养基培养,每组设5个复孔。
另取对数生长期KG-1a细胞,胰蛋白酶消化后以每孔2×105个细胞接种于6孔板,随机分为空白组、鱼藤素组、LiCl组、鱼藤素+LiCl组。空白组细胞用正常培养基培养,鱼藤素组细胞用含80.00 nmol·L-1鱼藤素的培养基培养 72 h,LiCl组细胞用含30 mmol·L-1LiCl的培养基培养72 h,鱼藤素+LiCl组细胞用含80.00 nmol·L-1鱼藤素和30 mmol·L-1LiCl的培养基培养72 h,每组设5个复孔。
1.2.2 细胞形态学观察倒置显微镜下观察0.00 nmol·L-1鱼藤素组、10.00 nmol·L-1鱼藤素组、20.00 nmol·L-1鱼藤素组、40.00 nmol·L-1鱼藤素组、80.00 nmol·L-1鱼藤素组细胞干预48 h的生长状态。
1.2.3 MTT实验检测细胞增殖能力0.00 nmol·L-1鱼藤素组、10.00 nmol·L-1鱼藤素组、20.00 nmol·L-1鱼藤素组、40.00 nmol·L-1鱼藤素组、80.00 nmol·L-1鱼藤素组细胞干预24、48、72 h后,每孔加入20 μL新鲜制备的MTT溶液(5.00 g·L-1),4 h后离心弃上清,每孔加入150 μL DMSO溶液,振荡10 min,观察到甲瓒颗粒完全溶解后,应用酶标仪测定波长570 nm处吸光度值,吸光度值越大表示细胞增殖能力越强。实验重复3次,取均值。
1.2.4 流式细胞术检测细胞凋亡情况取空白组、鱼藤素组、LiCl组、鱼藤素+LiCl组细胞,用胰蛋白酶消化并收集细胞至离心管中,磷酸盐缓冲溶液(phosphate buffered saline,PBS)洗涤,Annexin V binding buffer标记液冲洗后离心,弃上清,200 μL Annexin V binding buffer标记液重悬,加入5 μL AnnexinV- FITC混合均匀,4 ℃避光孵育15 min,加入5 μL PI染液混合均匀,避光反应30 min,应用流式细胞仪上样并检测各组细胞凋亡率。实验重复3次,取均值。
1.2.5 流式细胞术检测细胞周期分布取空白组、鱼藤素组、LiCl组、鱼藤素+LiCl组细胞,用胰蛋白酶消化并收集细胞至离心管中,4 ℃ 、1 800 r·min-1离心10 min(离心半径12 cm),使用预冷PBS冲洗细胞后4 ℃ 、1 800 r·min-1离心10 min,预冷PBS重悬细胞,加入预冷体积分数70%乙醇混匀,4 ℃固定12 h,4 ℃ 、1 800 r·min-1离心10 min,预冷PBS冲洗细胞,加入RNA酶A(RNaseA)使其终质量浓度为25 mg·L-1,37 ℃水浴30 min,加入PI染液使其终质量浓度为50 mg·L-1,4 ℃避光染色30 min,使用300目尼龙网过滤。使用流式细胞仪上样并检测细胞周期。实验重复3次,取均值。
1.2.6 qRT-PCR法检测细胞中SKP2、β-catenin、PARP mRNA表达取空白组、鱼藤素组、LiCl组、鱼藤素+LiCl组细胞,用胰蛋白酶消化并收集细胞至离心管中,采用TRIzol试剂盒提取总RNA,按反转录试剂盒说明书反转录为cDNA,采用qRT-PCR法检测SKP2、β-catenin、PARP mRNA表达。SKP2上游引物序列为5′-GTCTGCACCATGCGCAATGCGTCA-3′,下游引物序列为5′-CTACGCGTGCACACGCTGCACCGC-3′;β-catenin上游引物序列为5′-ACGTGCACGCGTGCAAGGGCCTGC-3′, 下游引物序列为5′-CATGTGTACGTCCACGGTTGCGTA-3′;PARP上游引物序列为5′-TGGCACGTGCAGCTAGTCACGTGC-3′, 下游引物序列为5′-GTGCGCTCTGTGTCGTGTCACGTG-3′;内参甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)上游引物序列为5′-CTTTGCACCGCACGTGCGCATTAG-3′ , 下游引物序列为5′-GTGCACGCTGCACGCTGTCAATGC-3′。 反应体系为SYBR Green Mix 11 μL,cDNA模板1.5 μL,上、下游引物各1.0 μL,加入双蒸水至总反应体系为20.0 μL。反应条件为95 ℃变性35 s,60 ℃退火30 s,72 ℃延伸30 s, 40个循环,72 ℃延伸5 min。采用2-△△Ct法计算SKP2、β-catenin、PARP mRNA相对表达量。实验重复3次,取均值。
1.2.7 Western blot法检测细胞中SKP2、β-catenin、PARP蛋白表达取空白组、鱼藤素组、LiCl组、鱼藤素+LiCl组细胞,用胰蛋白酶消化并收集细胞至离心管中,预冷PBS洗涤,加入100 μL预冷RIPA裂解液裂解,使用BCA蛋白定量试剂盒测定蛋白浓度。取40 μg蛋白样本,沸水煮10 min使其变性,使用十二烷基磺酸钠-聚丙烯酰胺凝胶电泳分离蛋白,将蛋白恒压转至聚偏氟乙烯膜上,脱脂奶粉室温摇床封闭2 h,Tris缓冲生理盐水洗涤;加入兔抗人SKP2、β-catenin、PARP一抗(稀释度均为11 000),4 ℃孵育过夜,加入辣根过氧化物酶标记的山羊抗兔IgG二抗(稀释度均为12 000),常温孵育2 h,Tris缓冲生理盐水洗涤;滴加ECL显色剂,暗室中曝光、显影,应用凝胶成像系统扫描、分析各条带灰度值,以GAPDH为内参,以SKP2、β-catenin、PARP蛋白条带灰度值与GAPDH灰度值比值表示蛋白相对表达量。实验重复3次,取均值。
2 结果
2.1 5组细胞形态学变化结果见图1。鱼藤素干预48 h时,与0.00 nmol·L-1鱼藤素组比较,10.00 nmol·L-1鱼藤素组、20.00 nmol·L-1鱼藤素组、40.00 nmol·L-1鱼藤素组、80.00 nmol·L-1鱼藤素组细胞间隙增大,细胞数量显著减少,形态不规则,细胞核固缩、碎片增加,且随着鱼藤素药物干预浓度的增加,细胞数量逐渐减少,形态变化逐渐明显。

A:0.00 nmol·L-1鱼藤素组;B:10.00 nmol·L-1鱼藤素组;C:20.00 nmol·L-1鱼藤素组;D:40.00 nmol·L-1鱼藤素组;E:80.00 nmol·L-1鱼藤素组。
2.2 5组细胞增殖能力比较结果见表1。鱼藤素干预24、48、72 h时,10.00 nmol·L-1鱼藤素组、20.00 nmol·L-1鱼藤素组、40.00 nmol·L-1鱼藤素组、80.00 nmol·L-1鱼藤素组细胞增殖能力显著低于0.00 nmol·L-1鱼藤素组,20.00 nmol·L-1鱼藤素组、40.00 nmol·L-1鱼藤素组、80.00 nmol·L-1鱼藤素组细胞增殖能力显著低于10.00 nmol·L-1鱼藤素组,40.00 nmol·L-1鱼藤素组、80.00 nmol·L-1鱼藤素组细胞增殖能力显著低于20.00 nmol·L-1鱼藤素组,80.00 nmol·L-1鱼藤素组细胞增殖能力显著低于40.00 nmol·L-1鱼藤素组,差异有统计学意义(P<0.05)。鱼藤素干预24、48、72 h时,5组细胞的增殖能力随培养时间延长而降低,组内各时间点之间两两比较差异均有统计学意义(P<0.05)。

表1 5组细胞增殖能力比较
2.3 4组细胞凋亡率比较结果见图2。空白组、鱼藤素组、LiCl组、鱼藤素+LiCl组细胞凋亡率分别为(5.37±0.61)%、(34.89±4.57)%、(2.54±0.36)%、(21.10±4.69)%。空白组、鱼藤素组、LiCl组、鱼藤素+LiCl组细胞凋亡率比较差异有统计学意义(F=104.037,P<0.05)。空白组、LiCl组、鱼藤素+LiCl组细胞凋亡率均显著低于鱼藤素组,差异有统计学意义(P<0.05)。空白组、LiCl组细胞凋亡率均显著低于鱼藤素+LiCl组,差异有统计学意义(P<0.05)。LiCl组细胞凋亡率显著低于空白组,差异有统计学意义(P<0.05)。
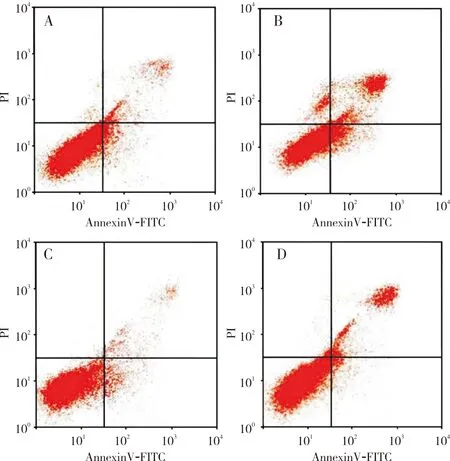
A:空白组;B:鱼藤素组;C:LiCl组;D:鱼藤素+LiCl组。
2.4 4组细胞周期分布比较结果见表2和图3。空白组、鱼藤素组、LiCl组、鱼藤素+LiCl组G0/G1、G2/M细胞占比比较差异有统计学意义(F=19.150,P<0.05)。空白组、鱼藤素+LiCl组、鱼藤素组的G0/G1细胞占比显著低于LiCl组,G2/M细胞占比显著高于LiCl组,差异有统计学意义(P<0.05)。鱼藤素+LiCl组、鱼藤素组的G0/G1细胞占比显著低于空白组,G2/M细胞占比显著高于空白组,差异有统计学意义(P<0.05)。鱼藤素组的G0/G1细胞占比显著低于鱼藤素+LiCl组,G2/M细胞占比显著高于鱼藤素+LiCl组,差异有统计学意义(P<0.05)。4组S期细胞占比比较差异无统计学意义(F=0.696,P>0.05)。

表 2 4组细胞周期分布比较
2.5 4组细胞中SKP2、β-catenin、PARP mRNA相对表达量比较结果见表3。空白组、鱼藤素组、LiCl组、鱼藤素+LiCl组细胞中SKP2、β-catenin、PARP mRNA相对表达量比较差异有统计学意义(F=77.343、77.343、44.555,P<0.05)。空白组、鱼藤素+LiCl组、鱼藤素组细胞中SKP2、β-catenin、PARP mRNA相对表达量显著低于LiCl组,差异有统计学意义(P<0.05)。鱼藤素+LiCl组、鱼藤素组细胞中SKP2、β-catenin、PARP mRNA相对表达量显著低于空白组,差异有统计学意义(P<0.05)。鱼藤素组细胞中SKP2、β-catenin、PARP mRNA相对表达量显著低于鱼藤素+LiCl组,差异有统计学意义(P<0.05)。

表3 4组细胞中SKP2、β-catenin、PARP mRNA相对表达量比较
2.6 4组细胞中SKP2、β-catenin、PARP蛋白相对表达量比较结果见表4和图4。空白组、鱼藤素组、LiCl组、鱼藤素+LiCl组细胞中SKP2、β-catenin、PARP 蛋白相对表达量比较差异有统计学意义(F=98.313、102.853、114.515,P<0.05)。空白组、鱼藤素+LiCl组、鱼藤素组细胞中SKP2、β-catenin、PARP 蛋白相对表达量显著低于LiCl组,差异有统计学意义(P<0.05)。鱼藤素+LiCl组、鱼藤素组细胞中SKP2、β-catenin、PARP 蛋白相对表达量显著低于空白组,差异有统计学意义(P<0.05)。鱼藤素组细胞中SKP2、β-catenin、PARP 蛋白相对表达量显著低于鱼藤素+LiCl组,差异有统计学意义(P<0.05)。

表4 4组细胞中SKP2、β-catenin、PARP蛋白相对表达量比较

1:空白组;2:鱼藤素组;3:LiCl组;4:鱼藤素+LiCl组。
3 讨论
AML属于恶性克隆性疾病,源自淋巴源性多潜能祖细胞或髓系祖细胞,细胞克隆中的白血病干细胞发生失控性增生、分化障碍,大量累积在外周血、骨髓及其他造血组织中,并对其他器官与组织造成浸润,抑制正常造血系统,导致器官浸润、感染、贫血、出血等症状[8-9]。尽管白血病干细胞与正常干细胞均具有自我更新及分化潜能,但白血病干细胞自我调控能力丧失,并抵抗常规放射治疗和化学治疗,是AML复发及转移的种子细胞[10]。因此,探寻白血病干细胞靶向治疗方式,抑制其不可控性增殖,同时诱导其凋亡,为治愈AML提供了新的希望。
有研究显示,AML实质上是一类细胞周期性疾病,其发生、发展与细胞周期关系密切,临床上常用的AML化学治疗药物基本上是通过影响DNA的合成进而阻滞细胞周期来达到抑制白血病干细胞生长的目的[11]。鱼藤素是一种异黄酮类化合物,近年来有研究表明,鱼藤素对细胞增殖、生长、细胞周期分布、凋亡等具有调节作用,可抑制血管新生,以癌变细胞及癌变前细胞为攻击目标,通过介导相关特定分子代谢途径阻断其生长,从而发挥强大的抗癌活性[12-13]。此外,鱼藤素作为天然植物提取物在起到抗肿瘤作用的同时对病灶周边组织的正常细胞影响较小,安全性高,具有广阔的应用前景。ZHANG等[14]研究表明,无论是体内实验还是体外实验,鱼藤素均表现出诱导AML细胞分化的效果,认为鱼藤素具有AML治疗作用。本研究结果显示,鱼藤素干预24、48、72 h后,10.00 nmol·L-1鱼藤素组、20.00 nmol·L-1鱼藤素组、40.00 nmol·L-1鱼藤素组、80.00 nmol·L-1鱼藤素组细胞增殖能力显著低于0.00 nmol·L-1鱼藤素组,20.00 nmol·L-1鱼藤素组、40.00 nmol·L-1鱼藤素组、80.00 nmol·L-1鱼藤素组细胞增殖能力显著低于10.00 nmol·L-1鱼藤素组, 40.00 nmol·L-1鱼藤素组、80.00 nmol·L-1鱼藤素组细胞增殖能力显著低于20.00 nmol·L-1鱼藤素组,80.00 nmol·L-1鱼藤素组细胞增殖能力显著低于40.00 nmol·L-1鱼藤素组;且鱼藤素组凋亡率、G2/M细胞占比显著高于空白组,提示鱼藤素对AML细胞具有增殖抑制、促进凋亡及细胞周期阻滞作用,且表现为剂量依赖性。
Wnt信号通路是重要的细胞增殖、分化调控途径,参与细胞极化、黏附、迁移等行为,且与其他信号通路具有交叉、协同作用,调控祖细胞及干细胞增殖、分化。β-catenin是Wnt信号通路的重要因子,且是将AML细胞生物信号自细胞膜转运到细胞质的信使。Wnt信号通路被激活后,β-catenin可在细胞内大量累积,并参与细胞连接位置黏合带的形成。此外,游离性β-catenin可进入细胞核参与SKP2、PARP等下游基因表达的调控。KANG等[15]研究显示,Wnt信号通路的失控将触发骨髓造血干细胞髓样再生,并损害下游多能祖细胞的产生及血液输出,从而参与AML发生及发展。YUAN等[16]研究发现,激活Wnt/β-catenin信号通路将进一步增强AML细胞恶性程度,提示该通路在AML发病机制中发挥作用。本研究结果发现,空白组、LiCl组、鱼藤素+LiCl组细胞凋亡率均显著低于鱼藤素组,空白组、LiCl组细胞凋亡率均显著低于鱼藤素+LiCl组,LiCl组细胞凋亡率均显著低于空白组;空白组、鱼藤素+LiCl组、鱼藤素组G0/G1细胞占比显著低于LiCl组,G2/M细胞占比显著高于LiCl组;鱼藤素+LiCl组、鱼藤素组G0/G1细胞占比显著低于空白组,G2/M细胞占比显著高于空白组;鱼藤素组G0/G1细胞占比显著低于鱼藤素+LiCl组,G2/M细胞占比显著高于鱼藤素+LiCl组;提示Wnt/β-catenin信号通路激活剂LiCl干预KG-1a细胞后,鱼藤素凋亡抑制及细胞阻滞作用被削弱,说明鱼藤素通过抑制激活Wnt/β-catenin信号通路发挥对AML细胞的凋亡抑制及细胞阻滞作用。本研究结果发现,空白组、鱼藤素+LiCl组、鱼藤素组细胞中SKP2、β-catenin、PARP mRNA及蛋白相对表达量显著低于LiCl组,鱼藤素+LiCl组、鱼藤素组细胞中SKP2、β-catenin、PARP mRNA及蛋白相对表达量显著低于空白组,鱼藤素组细胞中SKP2、β-catenin、PARP mRNA及蛋白相对表达量显著低于鱼藤素+LiCl组,提示鱼藤素可能通过调控Wnt/β-catenin信号通路相关下游基因SKP2、β-catenin、PARP影响AML细胞的增殖及凋亡。
综上所述,鱼藤素对AML KG-1a细胞具有增殖抑制、细胞周期阻滞及促进凋亡作用,其机制可能与抑制SKP2、β-catenin、PARP表达有关。
