miR-19b过表达抑制阿霉素诱导的H9c2心肌细胞凋亡
2020-09-29骆春艳同济天佑医院心血管内科武汉461000
周 琦 刘 敏 骆春艳 明 强 (同济天佑医院心血管内科,武汉 461000)
阿霉素(doxorubicin,DOX)是一种蒽环类抗生素,临床上用于多种癌症的治疗[1]。但治疗过程中DOX会引发多种不良反应,其中心脏毒性最为常见[1,2]。DOX引起的心脏损伤临床表现为左心室收缩功能降低,最终导致心力衰竭[3]。其诱导的心脏毒性的确切机制尚未完全阐明。许多研究证实DOX诱导的心脏毒性与大量活性氧(reactive oxygen species,ROS)的生成和Caspase-3激活有关[4,5]。
MicroRNA(miRNA)是一种在进化上高度保守的内源性非编码RNA,长度约20~25个核苷酸,与多种疾病密切相关,其中包括自身免疫性疾病以及肿瘤等。除此之外,miRNA在心脏疾病领域中的研究也日益深入[6,7]。miR-19b是miRNA家族成员之一,大量研究表明miR-19b参与心脏的早期发育过程,同时参与包括心肌梗死、病毒性心肌炎等在内的多种心血管疾病的发展过程[8],但其在DOX诱导的心脏毒性方面的研究较少。本研究通过调控miR-19b在DOX诱导后的H9c2心肌细胞中的表达,探讨miR-19b对DOX诱导的心肌细胞损伤的影响,以期为减少DOX对心脏的毒副作用提供新思路。
1 材料与方法
1.1材料 大鼠心肌细胞系H9c2(中国科学院细胞库);DMEM培养基(Hyclone公司);胎牛血清(Gibco公司);miR-19b mimic/inhibitor序列(广州瑞博生物技术有限公司);Trizol总RNA提取试剂盒(Ambion公司);Advantage RT-PCR反转录试剂盒(宝生物工程有限公司);SYBR Green PCR试剂盒(KAPA Biosystems公司);MTT、RIPA(强)组织细胞快速裂解液、BCA蛋白浓度测定试剂盒、PBS缓冲液、兔抗Bad抗体、兔抗Bcl-2抗体、兔抗Caspase-3抗体、兔抗GAPDH抗体、羊抗兔IgG抗体、ROS检测试剂盒、线粒体膜电位检测试剂盒(武汉华联科生物技术有限公司);兔抗Caspase-9、兔抗细胞色素C(Cytochrome C,Cyt-C)抗体、兔抗p53抗体(Abcam公司);ATP含量检测试剂盒(南京建成生物工程研究所)。
1.2方法
1.2.1细胞培养与分组 大鼠心肌细胞H9c2于DMEM培养基(10%胎牛血清+100 U/ml青霉素+ 100 U/ml链霉素)中,置于37 ℃、5%CO2培养箱中培养。细胞密度达90%时用0.25%胰酶消化、传代。
取对数期生长状况良好的细胞,分成6组:①空白对照组(Control组):H9c2细胞正常培养;②DOX组:250 ng/ml DOX处理H9c2细胞[9];③mimic NC组:H9c2细胞经250 ng/ml DOX处理24 h后,转染miR-19b mimic NC;④inhibitor NC组:H9c2细胞经250 ng/ml DOX处理24 h后,转染miR-19b inhibitor NC;⑤miR-19b mimic组:H9c2细胞经250 ng/ml DOX处理24 h后,转染miR-19b mimic;⑥miR-19b inhibitor组:H9c2细胞经250 ng/ml DOX处理24 h后,转染miR-19b inhibitor。
1.2.2MTT法检测细胞活性 采用MTT实验检测250 ng/ml DOX处理12、24、48 h后H9c2细胞的活性,确定DOX的处理时间。将对数期细胞接种于96孔板中,180 μl/孔,细胞浓度为5×103个/孔,37℃培养过夜,使细胞贴壁。加入DOX分别培养12、24、48 h后取出孔板,每孔加入20 μl MTT溶液(5 mg/ml),37 ℃培养4 h。弃上清,加入150 μl二甲亚砜,振荡10 min,在490 nm波长处检测各孔吸光度。
1.2.3细胞转染 取对数生长期细胞接种于培养皿中,当细胞70%融合时,采用DOX处理细胞 24 h,随后根据LipofiterTM2000转染试剂盒说明书,分别转染miR-19b mimic和miR-19b inhibitor以及对应的阴性对照,37 ℃培养6 h后换新鲜培养基。
1.2.4RT-PCR检测miR-19b的表达 转染24 h后,采用Trizol法提取各组细胞中总RNA,随后将RNA反转录成cDNA。以cDNA为模板,分别扩增U6和miR-19b。U6上游引物:5′-CTCGCTTCGGCAGCACATATACT-3′,下游引物:5′-ACGCTTCACGAATTTGCGTGTC-3′;miR-19b上游引物:5′-GGGTGTGCAAATCCATGC-3′,下游引物:5′-AACTGGTGTCGTGGAGTCGGC-3′。反应程序为:95 ℃预变性3 min;95℃变性5 s,56℃退火10 s,72℃延伸25 s,共39个循环;65℃延伸5 s。
1.2.5流式细胞术检测ROS水平 转染24 h后根据ROS检测试剂盒说明书进行操作。DCFH-DA稀释至10 μmol/L,将处理后的各组细胞悬浮于其中,细胞密度为1×107个/ml,37℃孵育20 min,每隔4 min 颠倒混匀1次。收集各组细胞,流式细胞仪检测ROS水平。
1.2.6流式细胞术检测线粒体膜电位 转染24 h后取10万~60万细胞重悬于0.5 ml细胞培养液中,加入0.5 ml JC-1染色液,混匀后37 ℃ 孵育20 min。600 μg,4 ℃离心4 min,弃上清。1 ml JC-1染色液重悬细胞,600 μg,4 ℃离心4 min,弃上清(重复2次)。用JC-1染色液重悬细胞,流式细胞仪检测线粒体膜电位。
1.2.7ATP水平检测 转染24 h后根据ATP含量检测试剂盒说明书进行操作,在636 nm波长处检测各孔吸光度。
1.2.8Western blot检测凋亡相关蛋白表达 转染24 h后,收集各组细胞提取总蛋白,蛋白采用BCA试剂盒定量后经SDS-PAGE电泳分离,再将蛋白转印至PVDF膜上,5%脱脂牛奶室温封闭2 h。加入一抗稀释液(Bad,Bcl-2,Caspase-9,Caspase-3,Cyt-C,p53,GAPDH),室温孵育1 h。PBS洗涤3次,每次5 min,加入二抗稀释液(HRP标记的IgG),室温孵育1 h。PBS洗涤3次,每次5 min,加入化学发光试剂,全自动化学发光分析仪检测。GAPDH为内参。
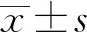
2 结果
2.1DOX 抑制H9c2心肌细胞增殖 与对照组相比,H9c2心肌细胞的活性随着DOX作用时间的增长逐渐降低(图1);当DOX处理细胞12 h后,细胞存活率无差异无统计学意义(P>0.05);处理24 h后,细胞存活率差异有统计学意义(P<0.05);处理48 h后细胞存活差异也有统计学意义(P<0.05),但毒副作用较大;因此,后续实验DOX的处理时间选用24 h。
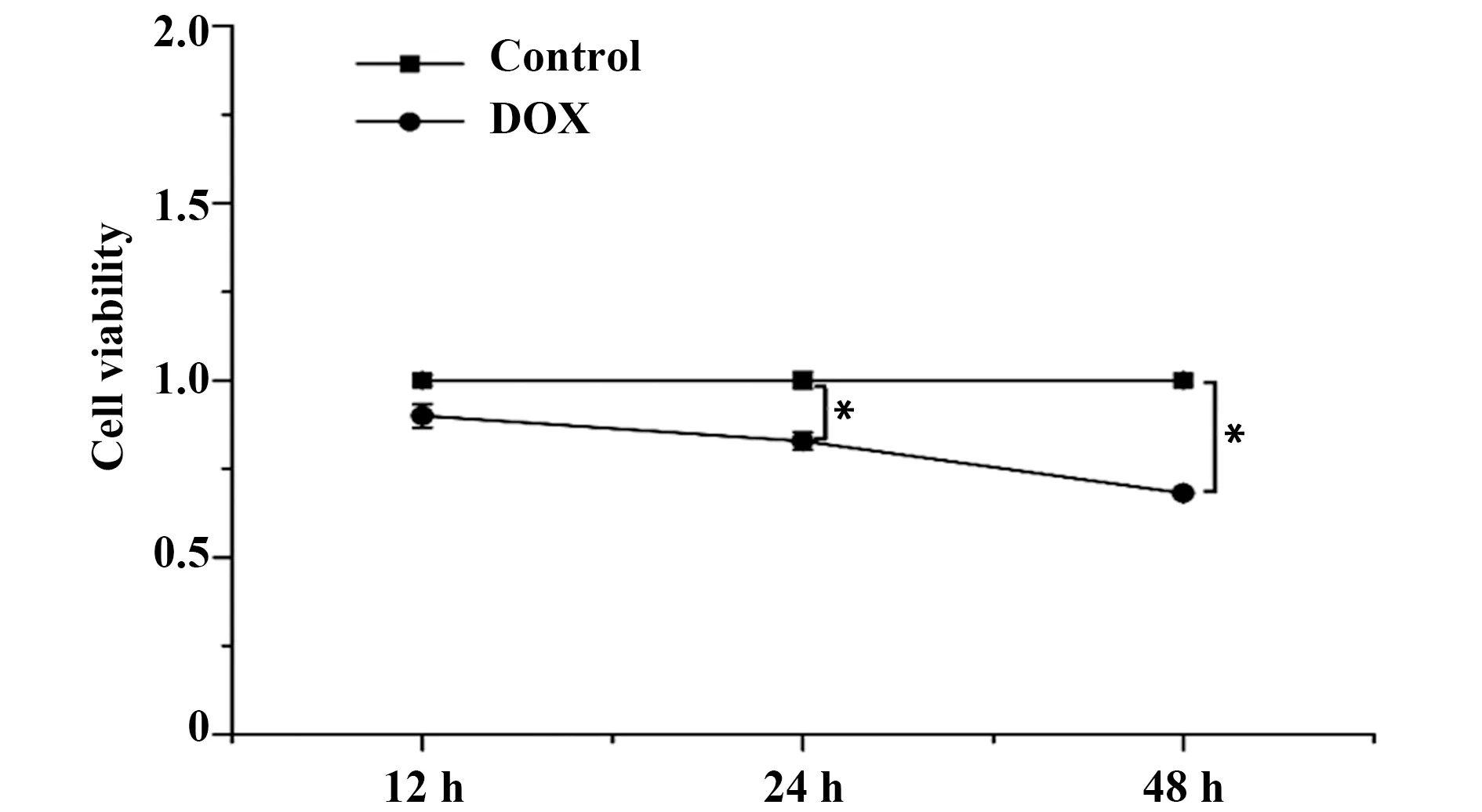
图1 DOX降低H9c2心肌细胞活性
2.2miR-19b mimic/inhibitor明显改变H9c2心肌细胞中miR-19b的表达量 与对照组相比,DOX组细胞中miR-19b的表达量降低(P<0.05)。与DOX组相比,mimic NC组和inhibitor NC组miR-19b的表达量无明显变化;miR-19b inhibitor 组miR-19b的表达量明显降低(P<0.05),而miR-19b mimic 组miR-19b的表达量明显升高(P<0.05),见图2。
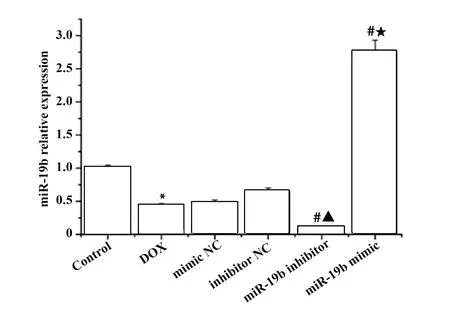
图2 转染后H9c2心肌细胞中miR-19b的表达情况
2.3miR-19b过表达抑制DOX诱导H9c2心肌细胞ROS的产生 与DOX组比较,mimic NC组和inhibitor NC组细胞中ROS的产生无明显变化;miR-19b inhibitor组细胞中ROS的产生增多;miR-19b mimic 组细胞中ROS的产生减少,见图3。
图3 DOX对H9c2心肌细胞中ROS表达的影响
2.4miR-19b过表达抑制DOX诱导后H9c2心肌细胞线粒体膜电位的降低 与DOX组比较,mimic NC组和inhibitor NC组中处于正常线粒体膜电位的细胞比例无明显变化;miR-19b inhibitor组中线粒体低电位细胞比例增多;miR-19b mimic组中线粒体低电位细胞比例减少,见图4。
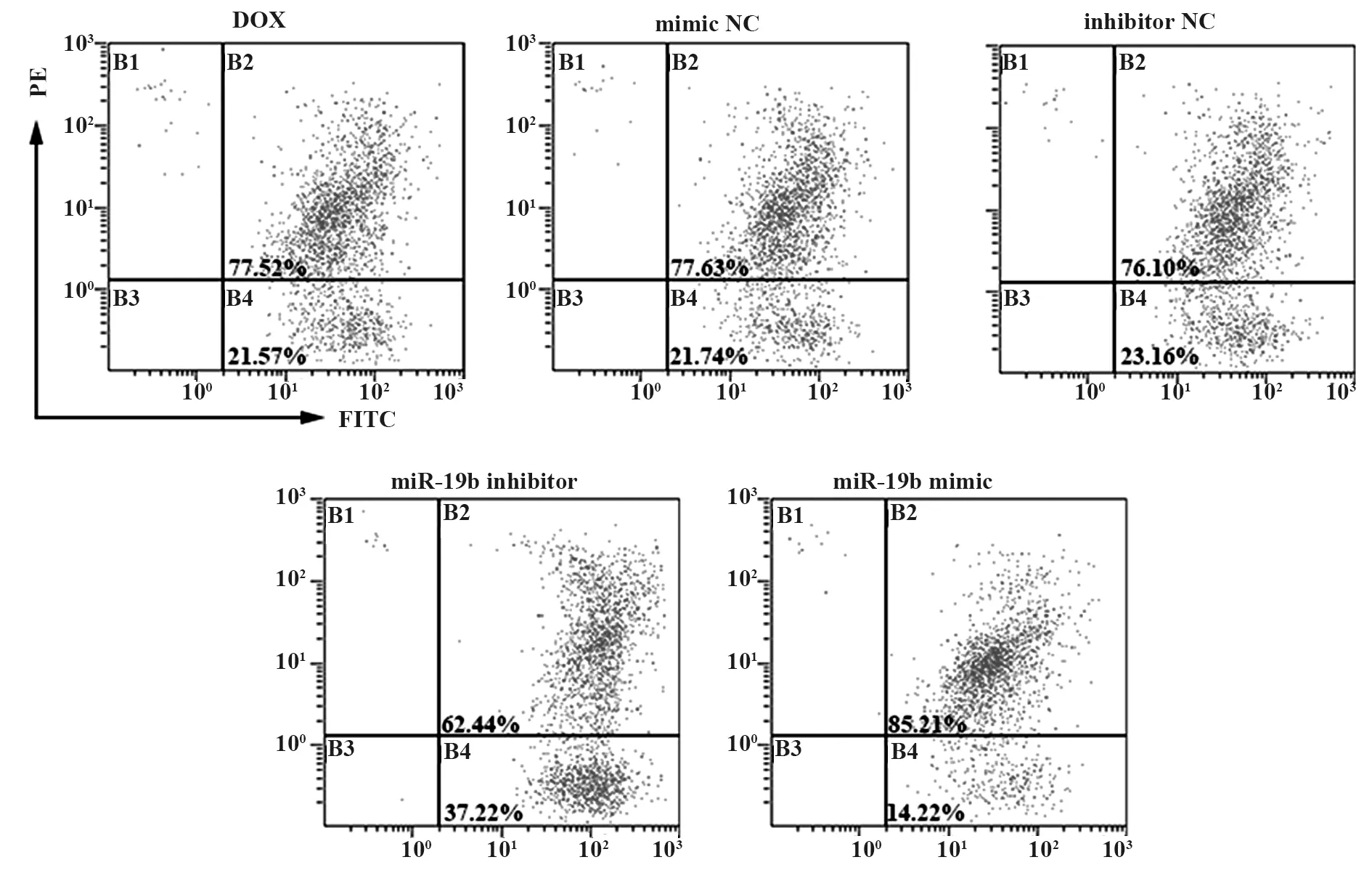
图4 DOX对H9c2心肌细胞线粒体膜电位情况的影响
2.5miR-19b过表达提高DOX诱导后H9c2心肌细胞中ATP含量 与DOX组比较,mimic NC组和inhibitor NC组细胞中ATP的含量无明显变化;miR-19b inhibitor组细胞中ATP的含量降低(P<0.05);miR-19b mimic组细胞中ATP的含量升高(P<0.05),见图5。
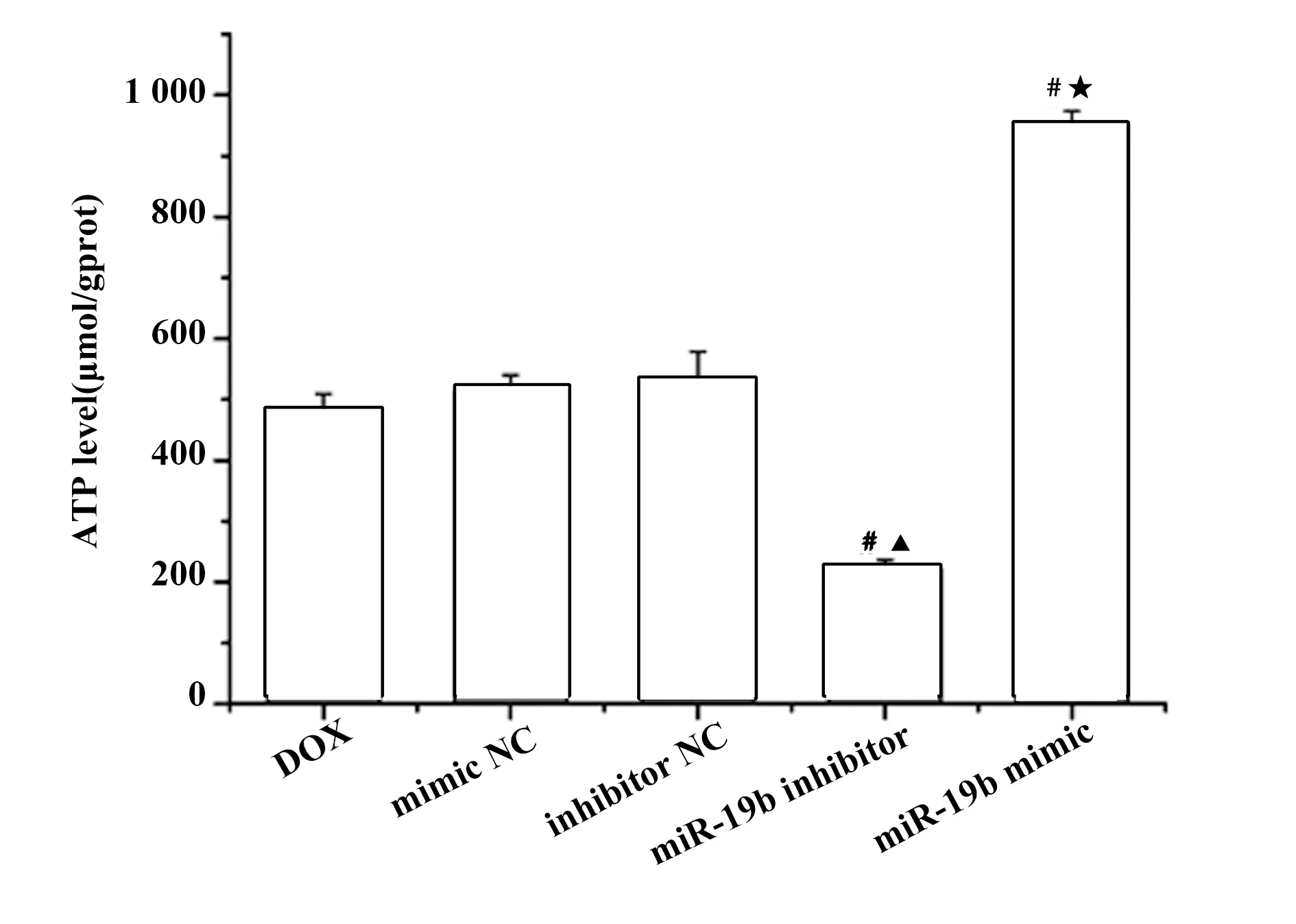
图5 DOX对H9c2心肌细胞中ATP含量的影响
2.6miR-19b过表达抑制H9c2心肌细胞凋亡 与DOX组比较mimic NC组和inhibitor NC组细胞中Bad、Bcl-2、Caspase-9、Caspase-3、Cyt-C和p53蛋白的表达水平无明显变化;miR-19b inhibitor组细胞中Bad、Caspase-9、Caspase-3、Cyt-C和p53蛋白的表达水平升高(P<0.05),Bcl-2蛋白表达水平降低(P<0.05);miR-19b mimic组细胞中Bad、Caspase-9、Caspase-3、Cyt-C和p53蛋白的表达水平降低(P<0.05),Bcl-2蛋白表达水平升高(P<0.05),见图6。

图6 DOX对H9c2心肌细胞中凋亡相关蛋白的表达的情况影响
3 讨论
DOX可以显著提高癌症患者的生存率,但是DOX引发的心脏毒性,并伴随左心室功能障碍和心力衰竭,严重影响了癌症患者的生活质量[10]。越来越多的证据表明,ROS的过量产生参与DOX诱导的心脏毒性过程,过量产生的ROS引起氧化损伤和心肌细胞凋亡,最终导致心力衰竭[11]。心肌细胞凋亡在DOX诱导的慢性心肌毒性过程中起重要作用[12,13]。体内和体外实验均表明,DOX诱导产生的ROS可导致心肌细胞凋亡,这可能与ROS导致DNA损伤、线粒体功能障碍、蛋白质合成抑制及细胞膜结构和功能破坏有关[5,14,15]。
线粒体是产生ROS的主要细胞器,也是ROS诱导氧化损伤的重要靶点,并在能量生产、细胞生长和凋亡诱导等多种生物学功能中发挥重要作用[16-18]。ROS诱导线粒体损伤主要是通过调控线粒体蛋白、线粒体脂质体和线粒体DNA的改变实现的[19]。p53是重要的抑癌基因,同时参与细胞凋亡的调控。当ROS诱导DNA发生严重损伤且无法修复时,p53可以通过增加Bax蛋白的表达或促使Bcl-2蛋白失活对细胞凋亡进行调节[20]。Bax和Bcl-2均属于Bcl-2家族蛋白,该家族蛋白是一类可以通过调节线粒体膜通透性从而调控细胞凋亡的蛋白质。Bax的激活表达和Bcl-2的抑制可促进线粒体通透性转变孔的打开,从而导致Cyt-C从线粒体释放进入细胞质,进而激活Caspase-9及其下游因子Caspase-3,诱导细胞凋亡[20]。Bad是Bcl-2家族的另外一种蛋白,在促进线粒体相关凋亡中同样起重要作用[21]。ATP是生物体最直接的能量来源,主要由线粒体产生。上调ATP水平,可以抑制心肌细胞线粒体中Cyt-C的释放,缓解ROS诱导的线粒体损伤[22]。
研究表明,miR-19b在心肌炎患者血浆中低表达,过表达miR-19b可以明显提高心肌细胞的存活率,抑制心肌细胞凋亡[23]。本研究发现,DOX可下调H9c2心肌细胞中miR-19b的表达,上调DOX诱导后的H9c2心肌细胞中miR-19b的表达,可以抑制心肌细胞中ROS的产生,降低细胞线粒体膜电位下降的细胞比例,同时抑制Bad、Caspase-9、Caspase-3、Cyt-C和p53蛋白的表达,促进Bcl-2蛋白的表达;而miR-19b抑制与miR-19b过表达的作用相反。
综上所述,miR-19b过表达能缓解DOX诱导的心肌细胞损伤,其机制可能与抑制ROS产生及线粒体相关凋亡有关,这为减少DOX对心脏的毒副作用方面研究提供研究思路。
