基于TGF-β2/Smad2信号通路探讨长链非编码RNA NEAT1对膀胱癌T24细胞生物学行为的影响
2020-09-29刘远灵曾昭昌张建军广州市花都区人民医院泌尿外科广州510000
刘远灵 曾昭昌 张建军 (广州市花都区人民医院泌尿外科,广州 510000)
膀胱癌(bladder cancer,BC)作为临床最常见的尿路系统肿瘤之一,具有发病迅速,转移率高的特点,男性发病率高于女性[1]。BC早期症状不明显,患者在就诊时往往已经处于晚期,目前治疗BC的主要手段是手术及术后化疗药物灌注,但仍有50%以上的患者复发[2]。研究表明,上皮间质转化( epithelial-mesenchymaltransition,EMT)是癌症转移的主要因素,也是治疗失败的重要原因,因此寻找新的治疗靶点尤为迫切[3]。长链非编码RNA(long-chain noncoding RNA,lncRNA)是一类不编码蛋白的RNA分子,长度介于200~100 000 nt之间[4]。研究表明,lncRNA在肿瘤细胞周期、肿瘤细胞侵袭转移与化疗耐药等相关信号通路中均发挥调节作用,其作用类似于癌基因或抑癌基因[5]。作为lncRNA 家族成员之一,lncRNA NEAT1已被证实在多种疾病的发生发展中发挥分化调控的作用,且在多种肿瘤中异常表达[6]。BC的发生发展及EMT过程中有诸多非编码RNA、抑癌基因、促癌基因及蛋白因子的参与,但目前鲜有关于lncRNA NEAT1在BC中的作用研究。因此,本研究通过对BC组织和细胞株的研究,探讨lncRNA NEAT1对BC细胞增殖、侵袭、迁移及EMT的影响及其可能的作用机制,为临床治疗BC提供新思路。
1 资料与方法
1.1资料
1.1.1组织标本 收集2015年3月~2018年5月于我院接受手术治疗的143例BC患者癌组织及距离癌组织超过2cm处的正常组织,用以上组织构建BC组织芯片。在经免疫组织化学染色后有15例组织标本出现不同程度的缺失,其余128例标本经组织病理学检测证实为原发性BC,并纳入研究。其中男性患者85例,女性患者43例,年龄38~78岁,平均年龄(55.28±6.76)岁,组织学分型:高分化患者25例,中分化患者56例,低分化患者47例,术前患者均未进行放化疗。本研究经我院伦理委员会审核批准,所有患者均同意并签署知情同意书。
1.1.2细胞来源 人正常膀胱上皮细胞SV-HUC-1、人源BC细胞株T24、5637、SCaBER、J82、UM-UC-3均购自上海博古生物技术有限公司。
1.1.3仪器与试剂 siNEAT1及阴性对照物NC、lncRNA NEAT1及U6引物均由上海吉玛制药技术有限公司设计完成。DMEM培养基(D777)、SYBR Green 荧光定量PCR 检测试剂盒(QPK-201)购自TOYOBO;TRIzol reagent(9009)购自TaKaRa;免疫荧光试剂盒、Transwell小室采购自BD;E-cadherin、Vimentin、TGF-β2、Smad2一抗、二抗均购自北洋百川生物技术有限公司;MTT试剂盒购自上海碧云天生物技术有限公司;Alexa Fluor594-偶联二抗购自美国Invitrogen公司。苏净Airtech超净工作台;三洋 MCO-15AC细胞培养箱;尼康 Ti-U/Ti-s倒置荧光显微镜;艾本德5810R 型高速离心机;罗氏 R480实时荧光定量PCR仪;蔡司LSM710共聚焦激光扫描显微镜。
1.2方法
1.2.1细胞转染 调整BC T24细胞株浓度至1×106个/ml,取2 ml接种于6孔板,培养过夜,采用Lipofectamine 2000将浓度为100 nmol/L的siNEAT1和NC转染至细胞,以不转染的T24细胞为空白对照,得到T24-siNEAT1及T24-NC细胞株。
1.2.2qRT-PCR检测lncRNA NEAT1表达 TRIzol法提取各组细胞总RNA,并按照PrimeScrip反转录试剂盒说明书反转录成cDNA,按照SYBR Premix Ex Taq说明书配置PCR反应体系,反应条件为:95℃预变性10 min,95℃ 10s,60℃ 30 s,72℃ 10s,40 个循环;95℃ 5 s,60℃ 1 min,95℃ 30s。PCR引物序列:U6(F:5′-CTCGCTTCGGCAGCACA-3′,R:5′AACGCTTCACGAATTTGCGT-3′),lncRNA NEAT1(F:5′-ACTGTCTCCCAACCCTTGTA-3′,R:5′-GTGCAGGGTCCGAGGT-3′),miR-200a-3p(F:5′-ACTGTCTCCCAACCCTTGTA-3′,R:5′-GTGCAGGG-TCCGAGGT-3′),相对表达量采用2-ΔΔCt表示。每个样本独立重复实验3 次。
1.2.3MTT及平板克隆实验检测细胞增殖 将T24、T24-NC及T24-siNEAT1细胞按照500~1 000个/孔铺至96 孔板,轻轻混匀后,置入37℃培养箱继续培养,每孔加20 μl MTT溶液,37℃避光4 h 后,弃掉孔内液体,各加入100 μl DMSO,37℃摇床快速振荡15 min充分溶解结晶物,酶标仪检测492 nm 处的OD值。将上述两种稳转细胞以5 000个/孔铺6孔板继续培养,隔周更换新鲜培养液,2周后用考马斯亮蓝染色,记录菌落形成数量。
1.2.4Transwell实验检测细胞侵袭 实验前12 h更换为无血清培养基,将40 μl matrigel基质胶铺于Transwell小室消化细胞,并用1×PBS清洗2遍,将500 μl 完全培养基加入24 孔板,细胞计数,取5×105个细胞重悬,向Transwell小室中加200~250 μl 细胞悬液,保证下层完全培养基与Transwell小室间无气泡,置于培养箱内正常培养 24 h,加用甲醇配制、PBS 稀释的0.1 %结晶紫染液500 μl染色,室温避光15 min,PBS 漂洗后用棉棒擦Transwell小室内部,倒置晾干,倒置荧光显微镜观察穿过膜的细胞并拍照计数。
1.2.5免疫荧光检测E-cadherin和Vimentin表达 细胞接种于玻片上,培养固定,4℃孵育过夜,用E-cadherin或Vimentin抗体进行免疫荧光分析(1∶1 000)。乙醇梯度洗脱后,室温下用Alexa Fluor 594-偶联二抗(1∶5 000)孵育1 h,DAPI染色,激光共聚焦显微镜下观察。
1.2.6生物信息学预测 利用生物信息学网站starBase预测可与NEAT1互补结合的miRNA,根据Targetscan网站预测相应miRNA可靶向结合的基因。
1.2.7Western blot检测蛋白表达 向培养48 h后的细胞中加入适量RIPA裂解液裂解30 min,12 000 r/min 4℃离心10 min,收集上清,BCA试剂盒检测蛋白浓度,将蛋白样品和Loading buffer混合,100℃水浴变性5 min,加入至制备好的SDS-PAGE凝胶(5%浓缩胶,10%分离胶),25 μl/孔上样,调整浓缩胶电压为60 V,分离胶电压为120 V,结束后取出凝胶,4℃转膜1.5 h,5%脱脂奶粉封闭PVDF膜2 h,加入相应一抗,4℃过夜,TBST冲洗膜后加入辣根过氧化物酶标记的羊抗兔IgG,37℃孵育2 h后加入ECL显影,采用自动凝胶成像系统采集图像,分析蛋白水平。
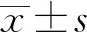
2 结果
2.1lncRNA NEAT1在BC组织、癌旁组织中的表达 qRT-PCR结果显示,BC组织中NEAT1表达水平高于正常组织,差异有统计学意义(P<0.05);NEAT1在肿瘤细胞中的表达明显高于人正常膀胱上皮细胞SV-HUC-1,差异均有统计学意义(P<0.05),且在T24细胞中表达量最高(P<0.01),适合使用RNA干扰的方法进行后续NEAT1基因功能的研究,见图1。

图1 lncRNA NEAT1在BC组织和不同BC细胞系中的表达
2.2细胞系构建 qRT-PCR结果显示,空白对照组与T24-NC组NEAT1表达差异无统计学意义(P>0.05),T24-siNEAT1组细胞中NEAT1表达量明显低于空白对照组和T24-NC组,差异具有统计学意义(P<0.05),提示成功构建NEAT1沉默细胞系,见图2。
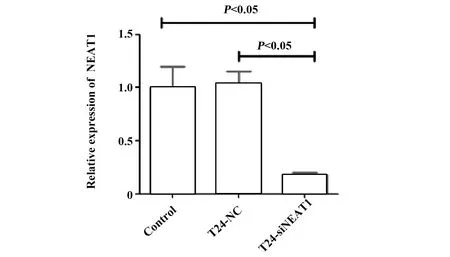
图2 lncRNA NEAT1在各组T24细胞中的表达
2.3NEAT1对BC细胞株T24增殖能力的影响 转染2周后T24-siNEAT1组细胞中NETA1表达与空白对照组和T24-NC组相比差异有统计学意义(P<0.05);MTT实验结果显示,与空白对照组和T24-NC组相比,NEAT1被沉默后,T24-siNEAT1组OD492值明显降低,差异有统计学意义(P<0.05)。平板克隆实验结果显示,沉默NEAT1后,T24-siNEAT1细胞克隆数显著减少(P<0.05)。提示NEAT1被沉默后,细胞增殖能力显著降低,见图3。
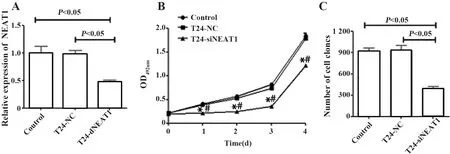
图3 lncRNA NEAT1对各组T24细胞增殖能力的影响
2.4lncRNA NEAT1对BC细胞株T24侵袭能力的影响 Transwell实验显示,与空白对照组和T24-NC组相比,沉默NEAT1后,T24-siNEAT1细胞通过matrigel基质胶的数量明显减少,差异具有统计学意义(P<0.05)。该结果表明沉默NEAT1后,细胞侵袭能力明显降低(图4)。
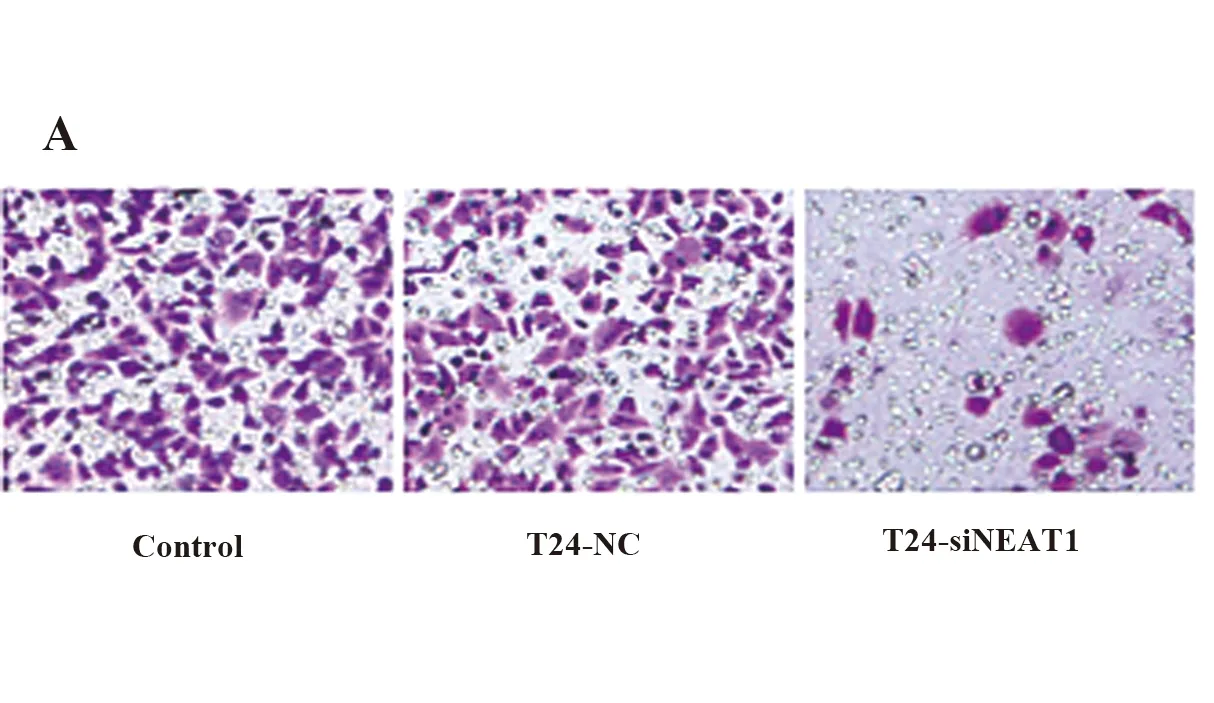
图4 lncRNA NEAT1对各组T24细胞侵袭能力的影响
2.5lncRNA NEAT1对EMT相关分子表达的影响 Western blot结果显示, 与空白对照组和T24-NC组相比,T24-siNEAT1组细胞E-cadherin表达明显升高,Vimentin表达明显下降,差异具有统计学意义(P<0.05);E-cadherin和Vimentin在免疫荧光中呈现红色,结果显示,T24-siNEAT1组细胞中E-cadh-erin明显增多,Vimentin明显降低。提示沉默NEAT1影响细胞EMT,见图5。
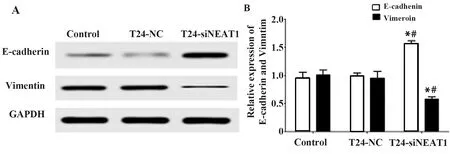
图5 lncRNA NEAT1对E-cadherin和Vimentin表达的影响
2.6生物信息学预测 starBase网站预测结果显示,NEAT1可与miR-200a-3p互补结合(图6A),Targetscan 网站预测分析显示,miR-200a-3p与TGF-β2存在靶向结合位点(图6B)。
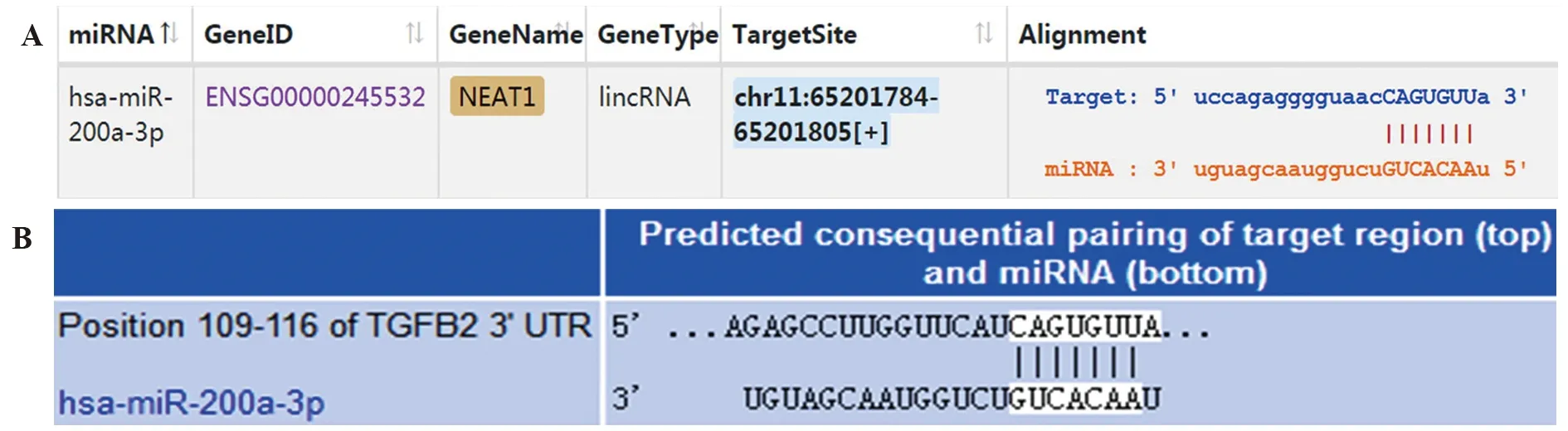
图6 生物信息学预测lncRNA NEAT1与TGF-β2的关系
2.7lncRNA NEAT1与TGF-β2/Smad2的作用关系 qRT-PCR和Western blot结果显示T24-siNE-AT1组中miR-200a-3、TGF-β2及p-Smad2表达明显低于空白对照组与T24-NC组(P<0.05),空白对照组和T24-NC组中上述指标的表达量差异无统计学意义(P>0.05),提示NEAT1对TGF-β2/Smad2通路蛋白表达具有促进作用,见图7。
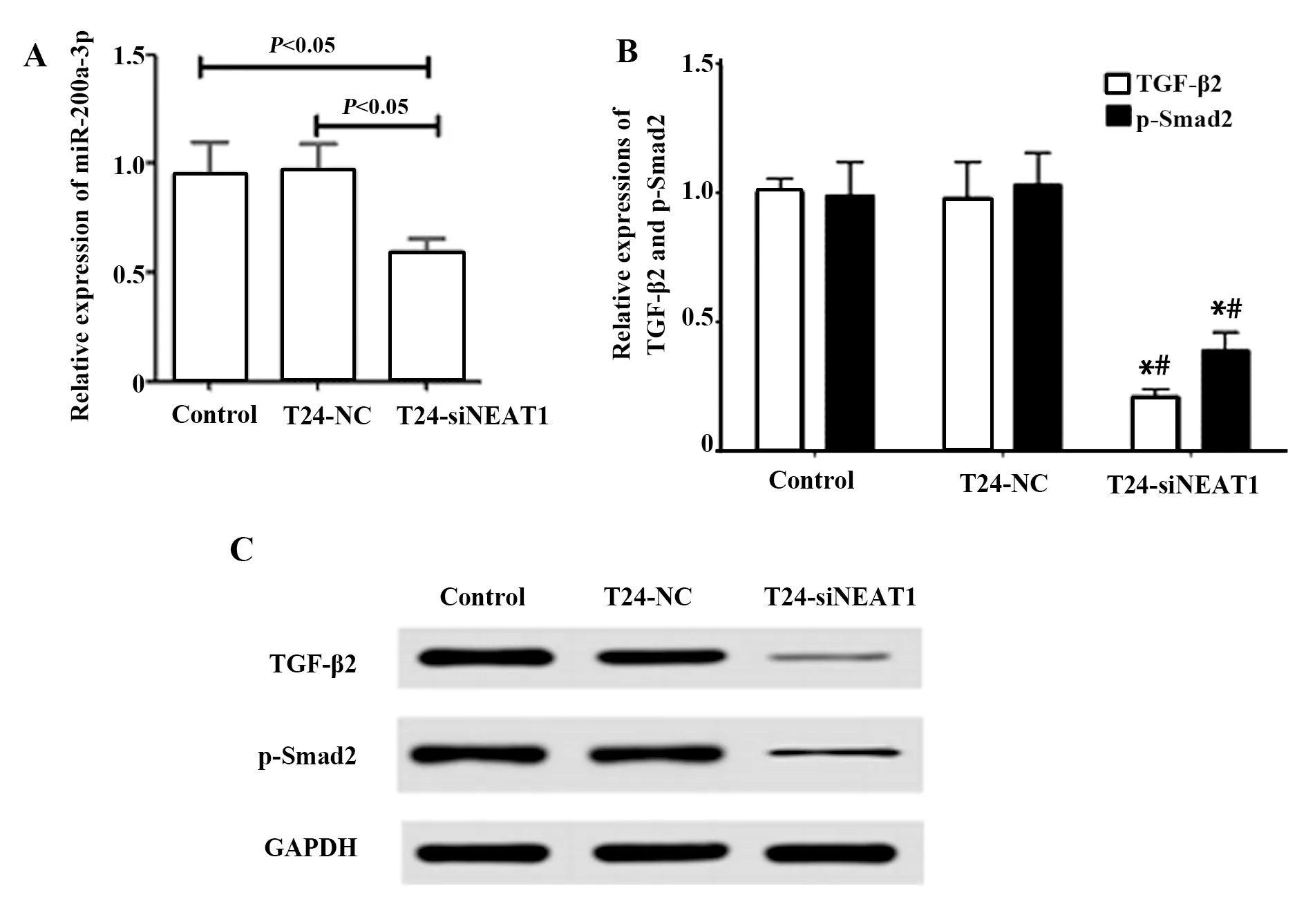
图7 lncRNA NEAT1与TGF-β2/Smad2的作用关系
3 讨论
膀胱尿路上皮细胞癌因发病位置比较隐蔽,不易检查,且早期症状复杂,缺少明显特征,常导致诊断和治疗延误[7]。因此从分子生物学角度出发寻找其进展和转移的标志物,对于患者选择合适的治疗方法及预后指标的判定具有重要意义。
有研究表明,一些lncRNA在肿瘤中异常表达,功能类似于癌基因或抑癌基因,其可通过参与调控细胞周期影响肿瘤的发生发展[8]。尚无标志性lncRNA可以直接预测BC。目前已经证实lncRNA NEAT1在多种癌症中特异性表达[9]。Qi等[10]采用RT-PCR检测发现NEAT1在肺癌组织中的表达明显高于癌旁组织。Zheng等[11]研究表明在胰腺癌患者癌组织和血清中,NEAT1表达量上调。NEAT1在胰腺癌细胞分化过程中表达量显著升高,而被沉默后,胰腺癌细胞的增殖能力明显减弱,且与增殖相关的基因表达亦降低,推测lncRNA NEAT1可促进胰腺癌细胞增殖[12]。本研究采用qRT-PCR检测lncRNA NEAT1在BC组织、癌旁组织及不同细胞系中的表达,发现在BC组织和癌细胞中其表达水平明显高于癌旁组织及正常细胞,提示NEAT1可能在BC的发生发展中发挥作用。为了进一步研究lncRNA NEAT1在BC中的作用,本研究在构建了NEAT1沉默细胞系的基础上研究发现,NEAT1下调后,BC细胞T24的侵袭能力和迁移能力明显降低。
EMT是指上皮细胞转化为间质细胞的生物学行为,在胚胎形成、器官发育、组织再生和肿瘤转移过程中起重要作用。在肿瘤进展中,分别代表上皮细胞和间质细胞的标记物E-cadherin和Vimentin的异常表达可以反映出肿瘤细胞的侵袭能力、药物敏感性及抗凋亡能力的变化[13]。 NEAT1在乳腺癌中表达明显高于癌旁组织,对肿瘤的迁移和EMT起到促进作用[14]。本研究显示,与对照组相比,T24-siNEAT1细胞中E-cadherin表达明显升高,Vimentin表达明显降低。提示NEAT1可能通过促进BC T24细胞的EMT过程提高细胞的迁移能力。
研究表明,miRNA是通过碱基不完全互补的方式结合于靶基因,从而影响肿瘤细胞的凋亡、迁徙与转移,并引发周围细胞的坏死与凋亡[15]。同时,miRNA也是lncRNA发挥作用的重要环节。本研究应用starBase数据库,预测NEAT1可与miR-200a-3p互补结合。Sharp等[16]研究发现,miR-200a-3p在食管癌组织中表达高于癌旁组织,上调其表达可促进食管癌细胞的增殖、迁移及EMT,miR-200a-3p作为癌基因对食管癌的进展发挥促进作用。本研究中,T24细胞NEAT1沉默后,miR-200a-3p下降。提示NEAT1对BC细胞株T24的增殖及EMT的促进作用可能与miR-200a-3p上调有关。Targetscan 网站预测显示,miR-200a-3p可互补结合TGF-β2,进一步分析显示,miR-200a-3p表达下调后,TGF-β2蛋白表达降低。TGF-β2/smad2 信号通路在肿瘤的发生发展中扮演重要角色,该通路通过磷酸化转录因子Smad 蛋白实现细胞内通路信号的传导[17]。Smad 蛋白包括 Smad1-Smad9,其中当 Smad2磷酸化水平升高时,TGF-β2/Smad2信号通路的生物学功能发生转变,对肿瘤细胞增殖和侵袭起促进作用[18]。这可能是由于Smad2蛋白通过与E-cadherin启动子区域的E-box结合,抑制E-cadherin的表达,进而促进EMT和细胞侵袭[19]。本研究发现T24-siNEAT1组细胞中Smad2磷酸化水平明显降低。 既往研究发现,下调NEAT1表达后,TGF-β2蛋白表达降低,从而抑制结直肠癌的侵袭与迁移[20]。提示NEAT1可能通过调节 TGF-β2/smad2 信号通路抑制细胞EMT过程,从而影响肿瘤的发生发展。
综上所述,lncRNA NEAT1在膀胱癌组织及细胞中高表达,高表达的NEAT1可能通过上调miR-200a-3p,调控TGF-β2/Smad2信号通路,促进EMT过程,从而影响BC的发展。
