冷刺激诱导弱精子症大鼠模型的建立及其性腺轴改变研究
2020-09-29童卓云斯依提阿木提刘文娟张盼盼阿地力江伊明
童卓云, 斯依提·阿木提, 刘文娟, 张盼盼, 阿地力江·伊明
(1新疆维吾尔自治区第八人民医院检验科, 乌鲁木齐 830000; 2新疆医科大学基础医学院, 乌鲁木齐 830011)
根据世界卫生组织规定,育龄期夫妇在1年以上未进行任何避孕措施下,进行有规律的性生活仍无法受孕为不孕不育症,男性则为不育症。近年来,男性不育症患病率呈增长趋势,精液质量呈逐年降低趋势[1-2]。研究表明,全球约15%育龄夫妇面临不孕不育的困扰[3],亚洲地区仅男性因素造成的不孕不育达37 %。有学者通过冷水浸没[4]、短期冷暴露[5]等急性造模方式进行了冷刺激对精子功能影响的研究和报道,但是,将冷环境作为致病因素,将弱精子症作为一项疾病,模拟其发生发展过程并建立模型的系统性研究则鲜有报道。本研究采用冷环境刺激干预建立弱精子症大鼠模型,探究弱精子症大鼠精子功能及其性腺轴神经内分泌机制的改变,现报道如下。
1 材料与方法
1.1 仪器DHP-360型电热恒温培养箱(北京市光明医疗仪器有限公司);GC-2016型γ放射免疫计数器(安徽科大创新股份有限公司)。
1.2 试剂M199培养基(美国Hyclone公司,批号:AE27981284);胎牛血清(德国BIO-FROXX公司,批号:EZ2811F232);精子伊红-苯胺黑活体染色试剂盒(北京索莱宝科技有限公司,批号:20190423)。
1.3 实验动物SPF级清洁雄性SD大鼠28只,体质量(190±10)g,由新疆医科大学动物实验中心提供,动物生产许可证号:SCXK(新)2018-0002。
1.4 建模与分组方法取28只SD大鼠随机分为正常对照组(12只)和冷刺激建模组(16只),适应性饲养1周后,将2组大鼠分别在正常温度环境(22±2)℃和冷环境(4.0±0.5)℃,10:00~18:00中饲养,光控昼/夜12 h/12 h,大鼠均自由进食饮水。23周后取冷刺激建模组大鼠精子,参照文献[1]中方法进行精子悬液制备和精子活力检测与评定,即以前向运动精子(Progressive motility, PR)百分率低于32 %,或前向+非前向运动精子(Progressive motility+Non-progressive motility, PR +NP)百分率低于40 %为弱精子症大鼠筛选标准,结果弱精子症组(8只),未成模组(8只),见图1。
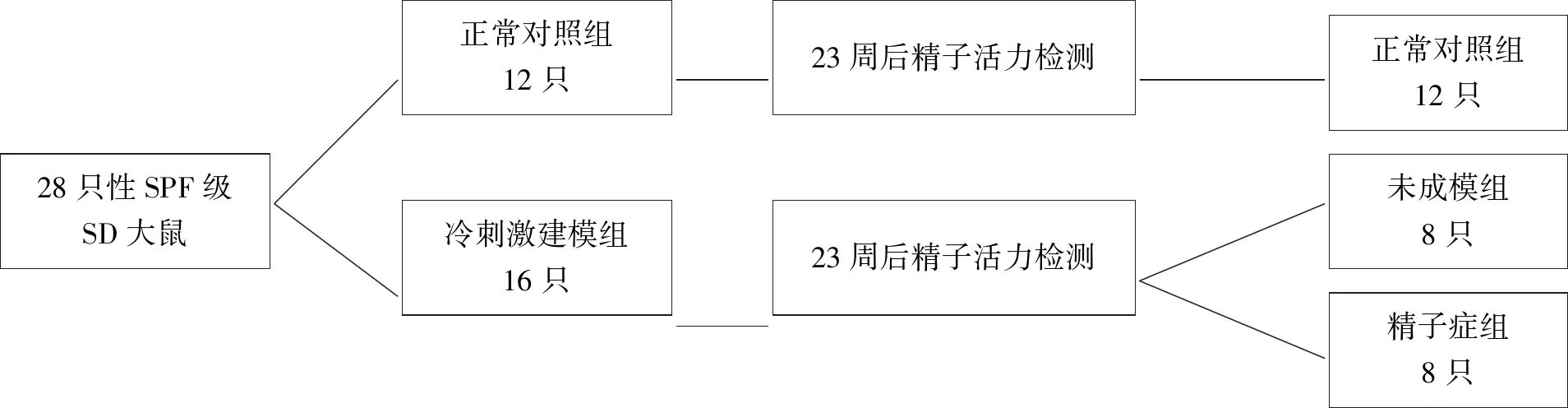
28只性SPF级SD大鼠正常对照组12只冷刺激建模组16只 23周后精子活力检测23周后精子活力检测 正常对照组12只未成模组8只精子症组8只
1.5 组织取材与处理方法造模结束后将各组大鼠称重后麻醉,腹主动脉采血制备血清,-80℃冻存备用。取大鼠左侧附睾制作精子悬液,将大鼠下丘脑、垂体、右侧睾丸和右侧附睾用4 %甲醛固定。
1.6 指标测定
1.6.1 精子功能的评定 钝性分离大鼠左侧附睾尾,剔除周围脂肪及结缔组织,置于4 mL含有2% BSA的M199培养基中(提前37℃预热),用眼科剪将附睾尾迅速剪碎, 37℃孵育15 min。精子悬液参照参考文献[1]中方法操作测定精子浓度和活力,参照精子伊红-苯胺黑活体染色试剂盒说明书方法操作测定精子活率。
1.6.2 器官系数的测定 称取各组大鼠睾丸和附睾重量,计算器官系数。
1.6.3 外周血清性腺轴激素水平的测定 参照放射免疫检测试剂盒说明书方法操作测定血清中睾酮(Testosterone, T)、雌二醇(Estradiol, E2)、黄体生成素(Luteinizing hormone, LH)、卵泡刺激素(Follicle stimulating hormone, FSH)、泌乳素(Prolactin, PRL)水平。
1.6.4 下丘脑、垂体、睾丸、附睾组织形态学观察 取各组大鼠下丘脑、垂体、睾丸、附睾组织用4%甲醛固定后,常规石蜡包埋、切片。HE染色,光镜下观察各组组织形态学改变。
2 结果
2.1 冷刺激建模组大鼠精子浓度、活力、活率的比较与正常对照组相比,冷刺激建模组大鼠精子活力(PR、NP)和活率均降低,差异有统计学意义(P<0.01),见表1。
2.2 弱精子症模型组大鼠精子浓度、活力、活率的比较与正常对照组相比,弱精子症组大鼠精子活力(PR、NP)和活率均降低,差异有统计学意义(P<0.01),见表2。
表1 冷刺激对大鼠精子浓度、活力和活率的比较
表2 各组大鼠精子浓度、精子活力、精子活率的比较
2.3 各组大鼠弱精子症成模率的比较与正常对照组相比,冷刺激建模组大鼠弱精子症成模率增大,差异有统计学意义(P<0.01,χ2=28.000),见表3。

表3 各组大鼠弱精子症成模率的比较
2.4 各组大鼠精子伊红-苯胺黑活率染色结果比较染色后活精子头部呈白色,死精子头部呈红色。与正常对照组相比,弱精子症组较多见头部红染的精子,见图2。
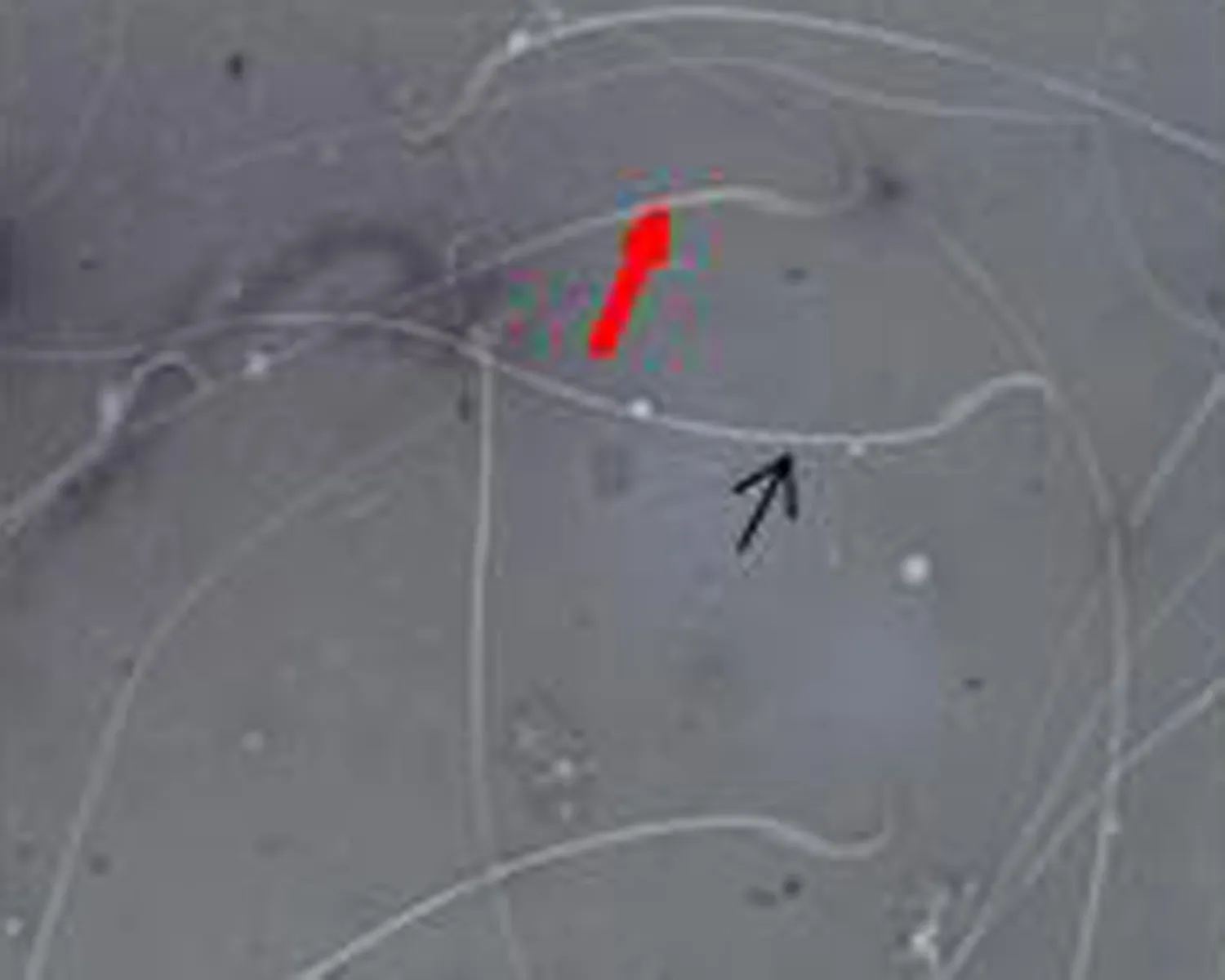
a.正常对照组
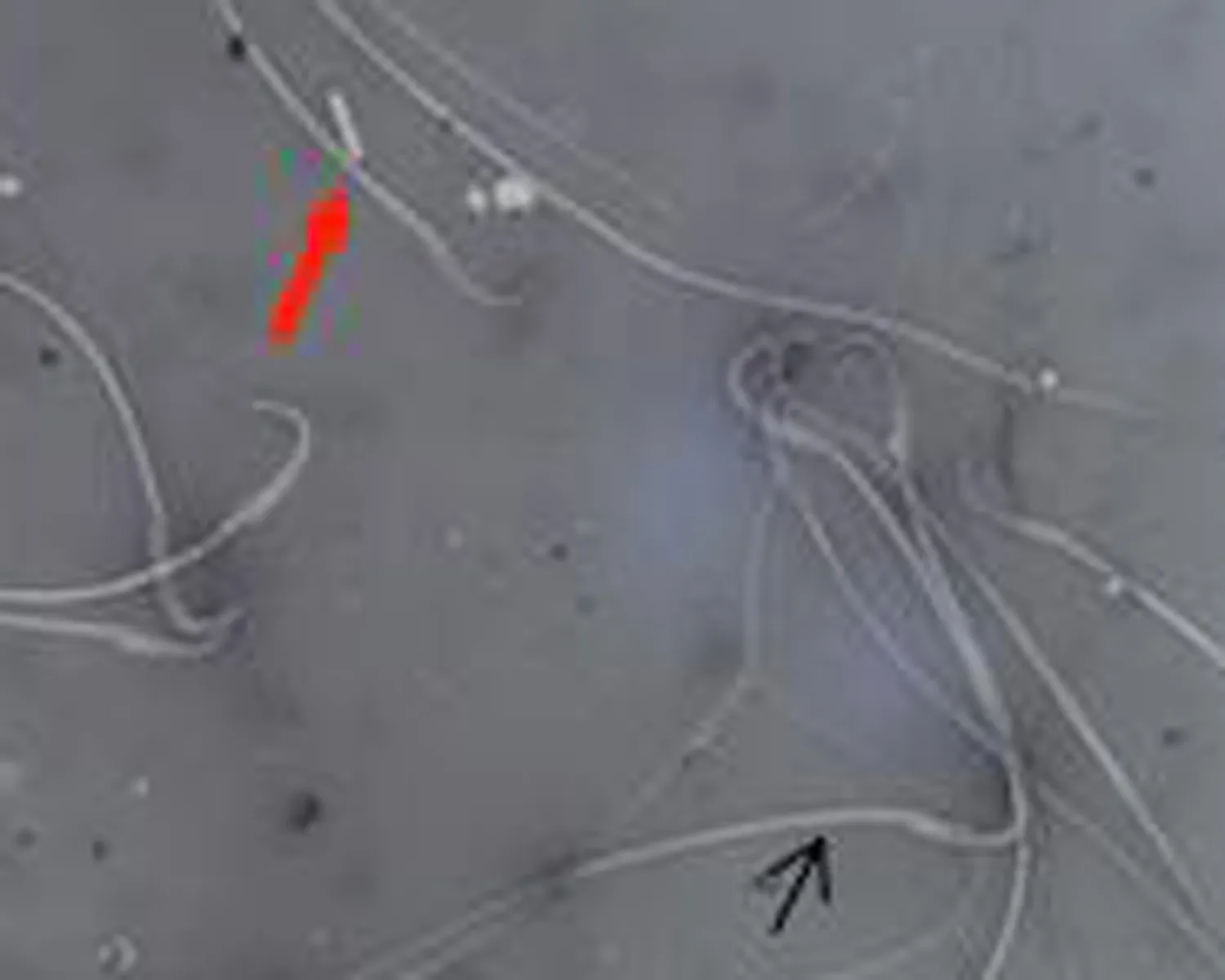
b.未成模组
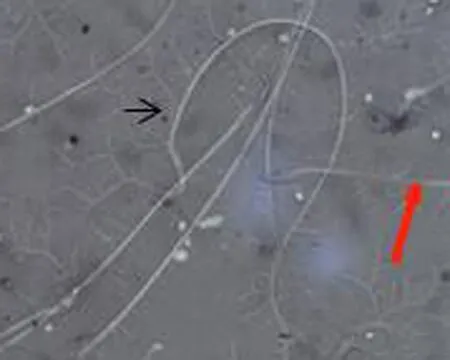
c.弱精子症组
2.5 各组大鼠器官系数的比较与正常对照组相比,弱精子症组大鼠睾丸系数和附睾系数降低,差异有统计学意义(P<0.05);与未成模组相比,弱精子症组大鼠睾丸系数降低,差异有统计学意义(P<0.05),见表4。
2.6 各组大鼠外周血清性腺轴激素含量的比较与正常对照组相比,未成模组、弱精子症组T含量上升,差异无统计学意义(P>0.05);与正常对照组、未成模组相比,弱精子症组E2水平升高,LH水平降低,差异有统计学意义(P<0.05),见表5。
表4 各组大鼠睾丸、附睾系数的比较
2.7 各组大鼠性腺轴相关组织结构改变情况
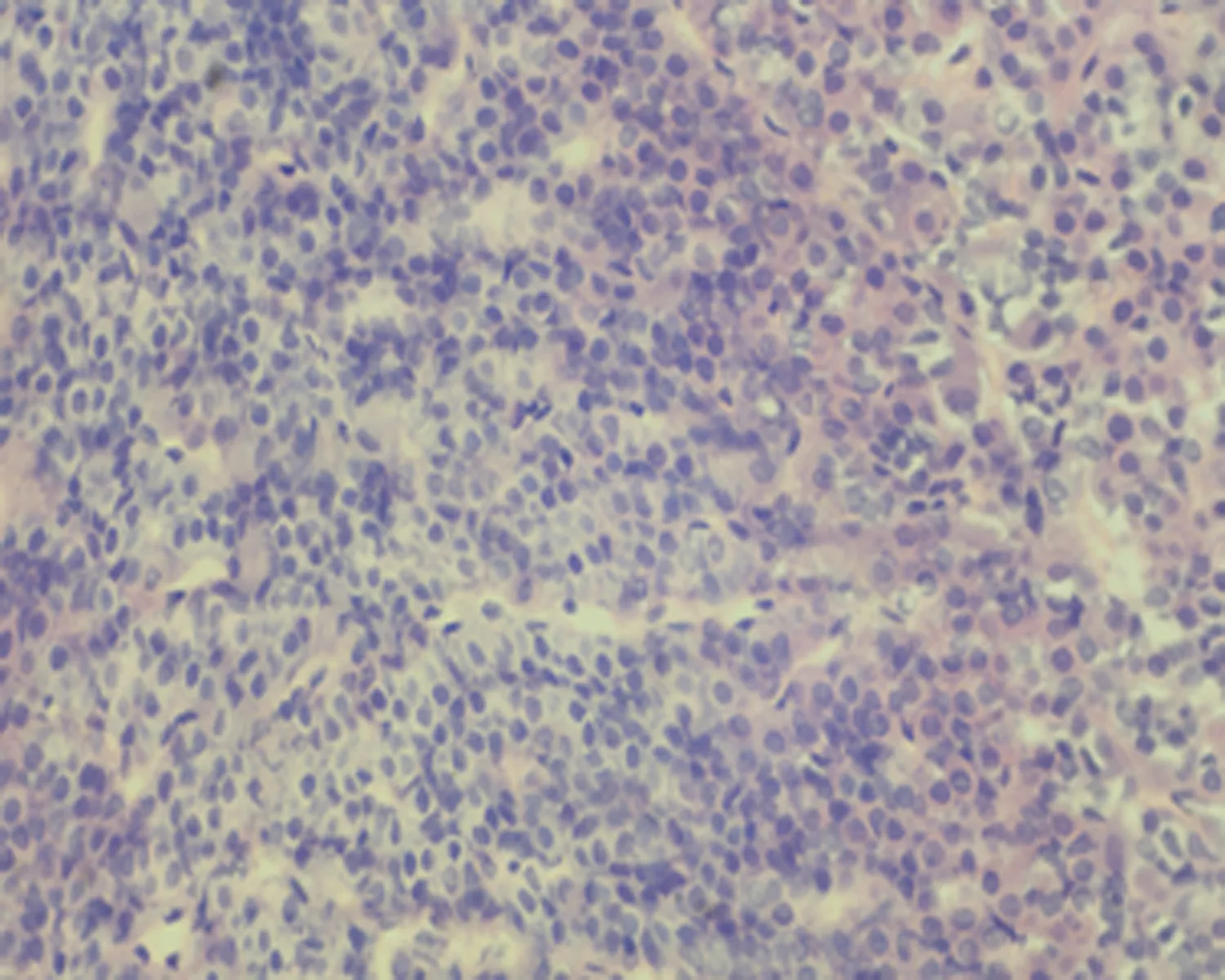
2.7.1 下丘脑组织形态结构 低倍镜下正常对照组大鼠下丘脑组织形态结构正常,细胞丰富,未成模组无明显改变;高倍镜下可见弱精子症组大鼠下丘脑组织毛细血管呈袖套状改变,神经元细胞增生,排列紊乱,见图3。
表5 各组大鼠外周血清性腺轴激素水平的比较
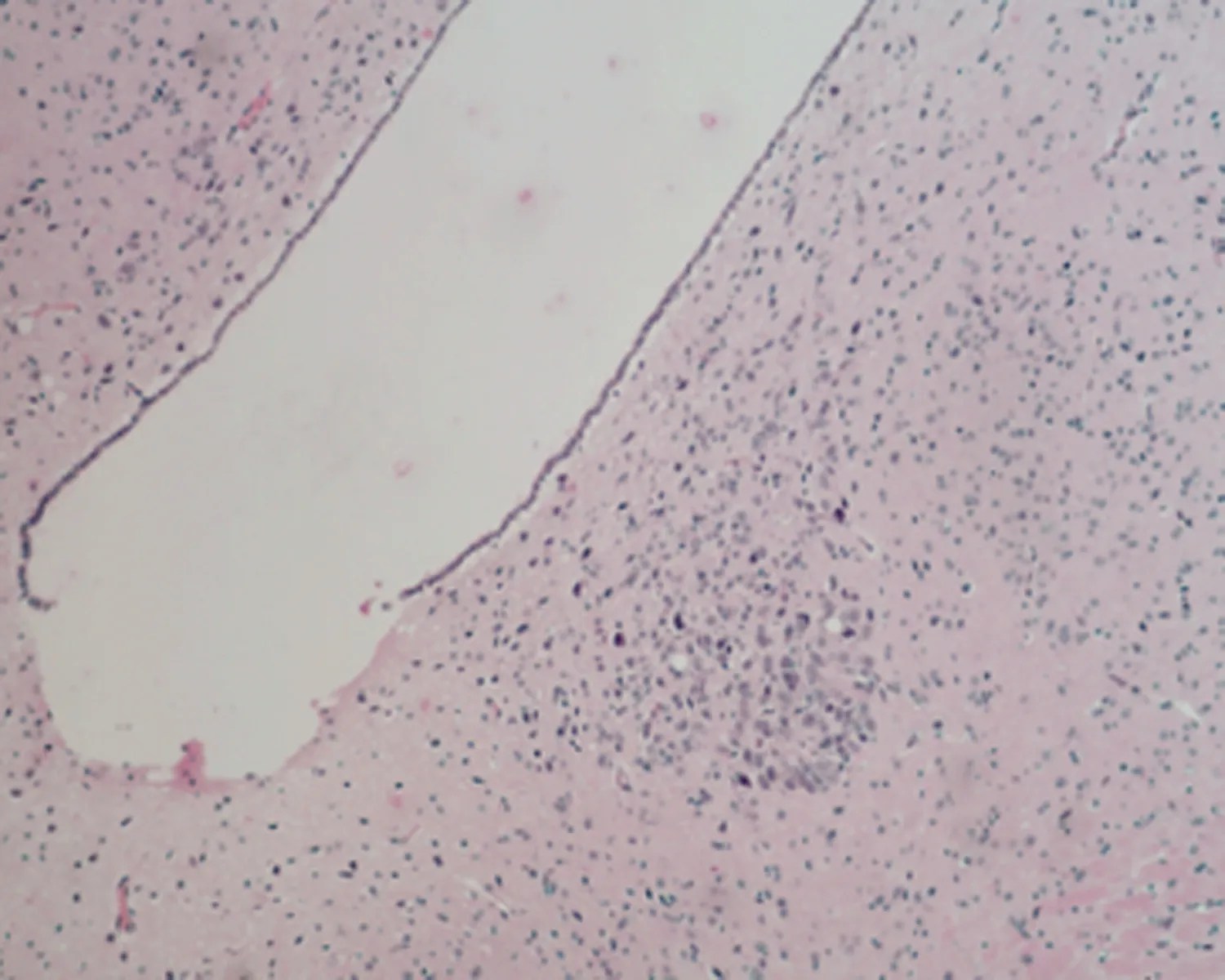
a.正常对照组 (×100)
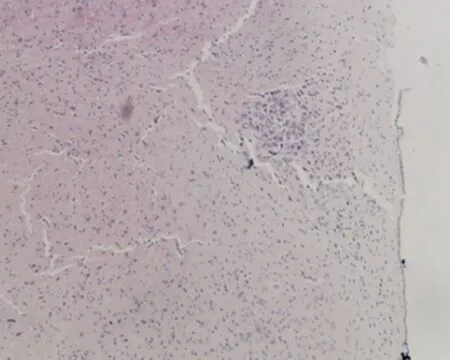
b.未成模组 (×100)

c.弱精子症组 (×100)

d.正常对照组 (×400)
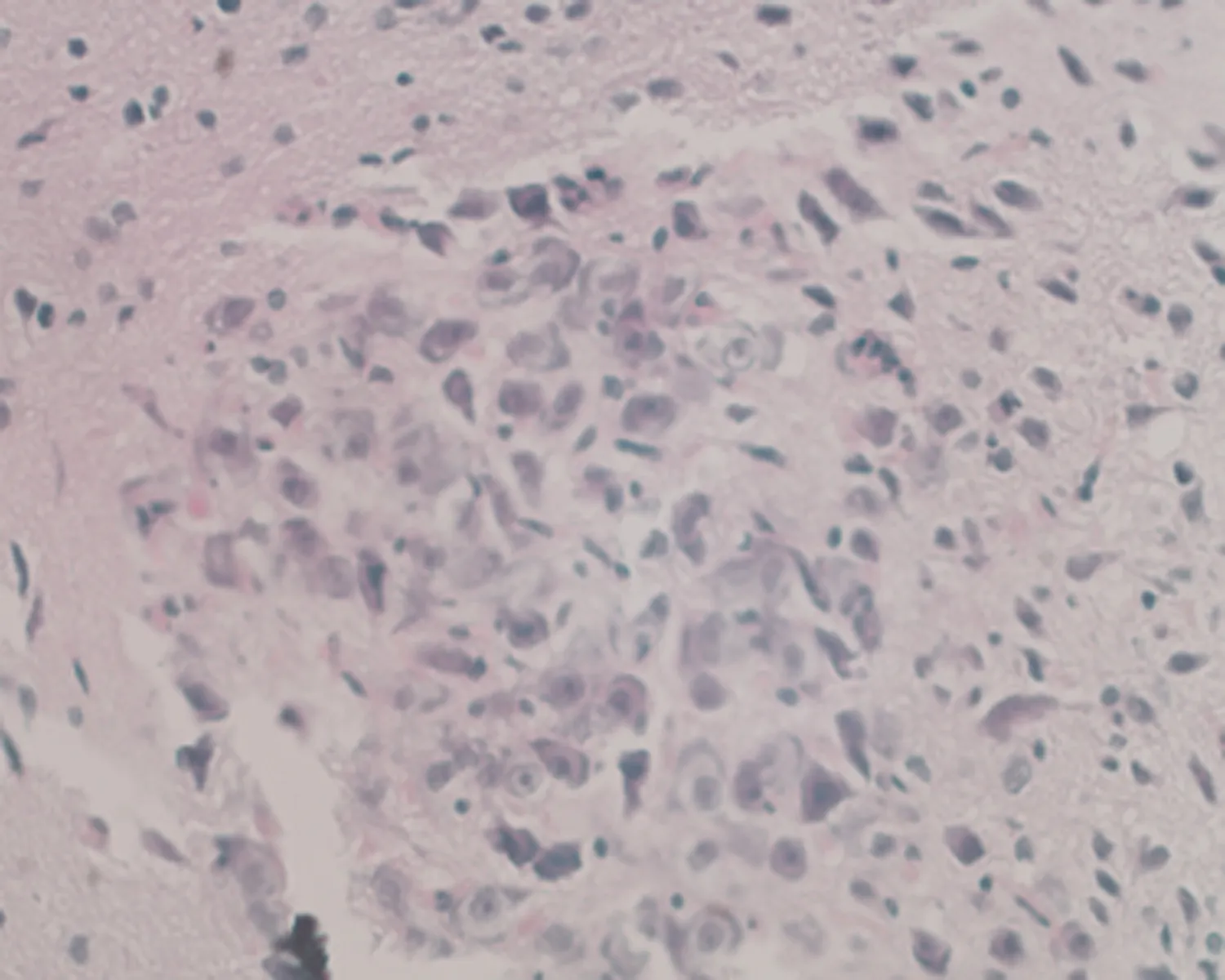
e.未成模组 (×400)
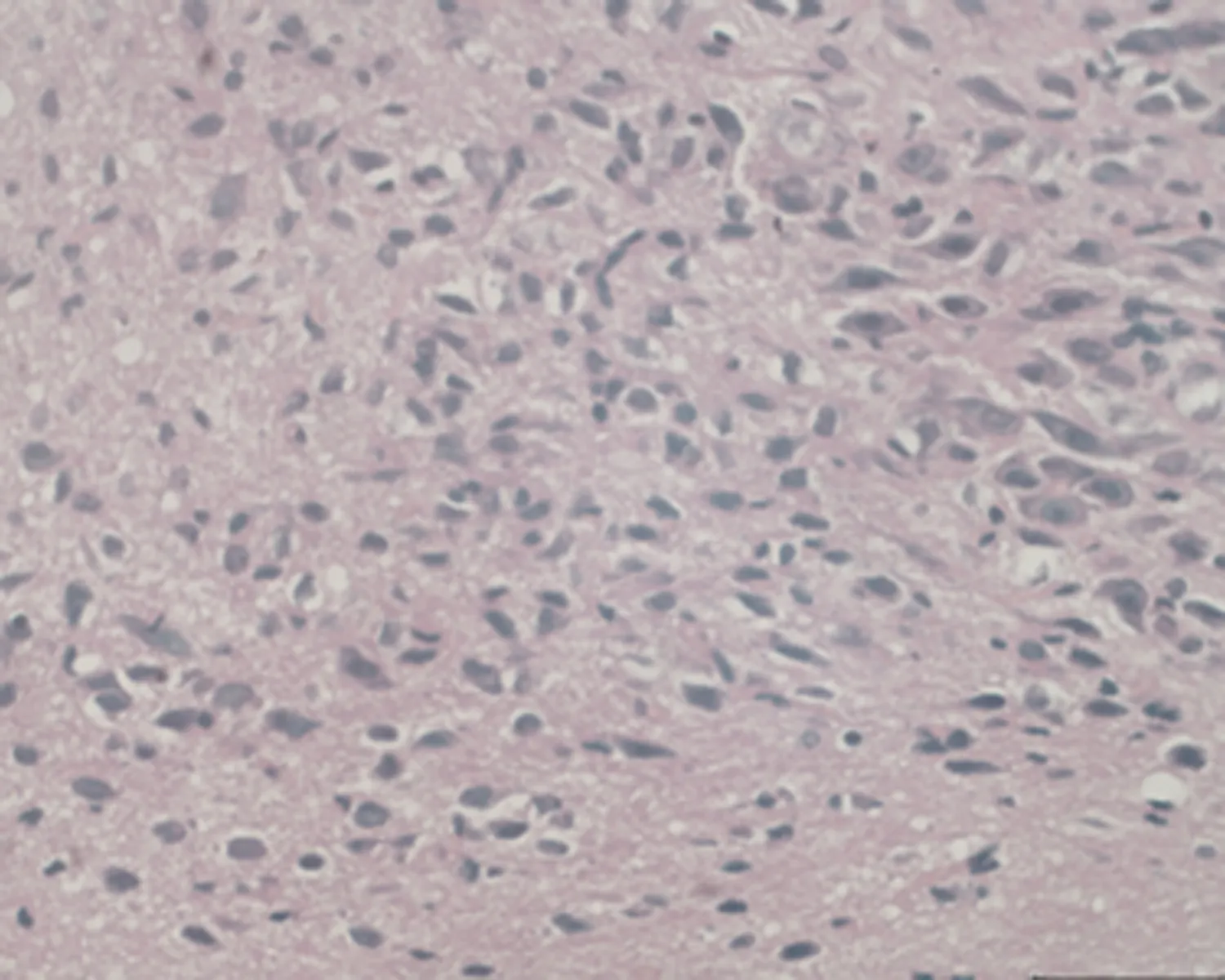
f.弱精子症组 (×400)
2.7.2 垂体组织形态结构 低倍镜下正常对照组大鼠垂体组织形态结构正常,细胞呈团索状分布, 弱精子症组嗜碱性细胞较少;高倍镜下冷刺激建模组大鼠垂体组织可见细胞空泡化、细胞水肿及毛细血管扩张,以弱精子症组更为明显,见图4。
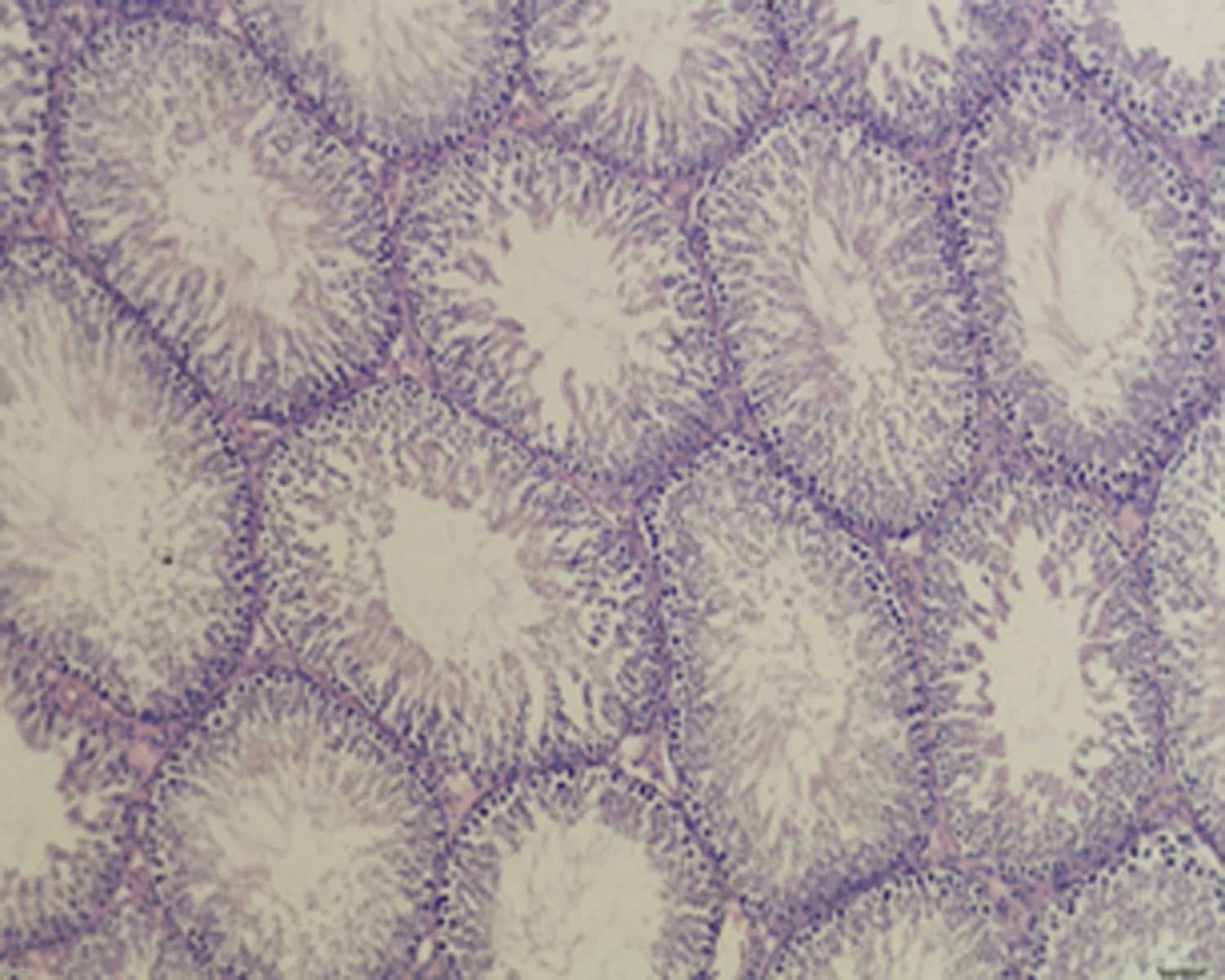
2.7.3 睾丸组织形态结构 低倍镜下正常对照组大鼠睾丸组织多见生精小管紧密排列,生精小管饱满,以富含精子的生精小管为主。与正常对照组相比,未成模组未见明显变化,弱精子症组生精小管间距略宽,高倍镜下弱精子症组生精上皮较正常对照组薄,间质水肿,可见毛细血管扩张,见图5。
2.7.4 附睾组织形态结构 低倍镜下正常对照组大鼠附睾组织形态结构正常;高倍镜下正常对照组大鼠附睾组织上皮细胞排列整齐,与正常对照组相比,未成模组、弱精子症组上皮结构均排列紊乱,上皮变薄,并以弱精子症组更为明显,见图6。
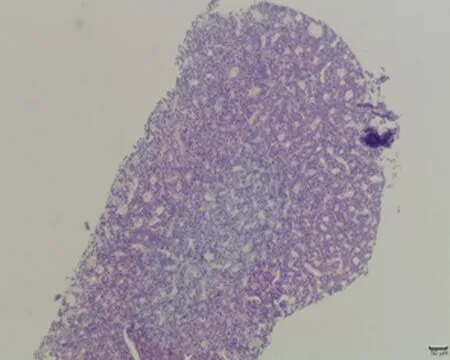
a.正常对照组 (×100)
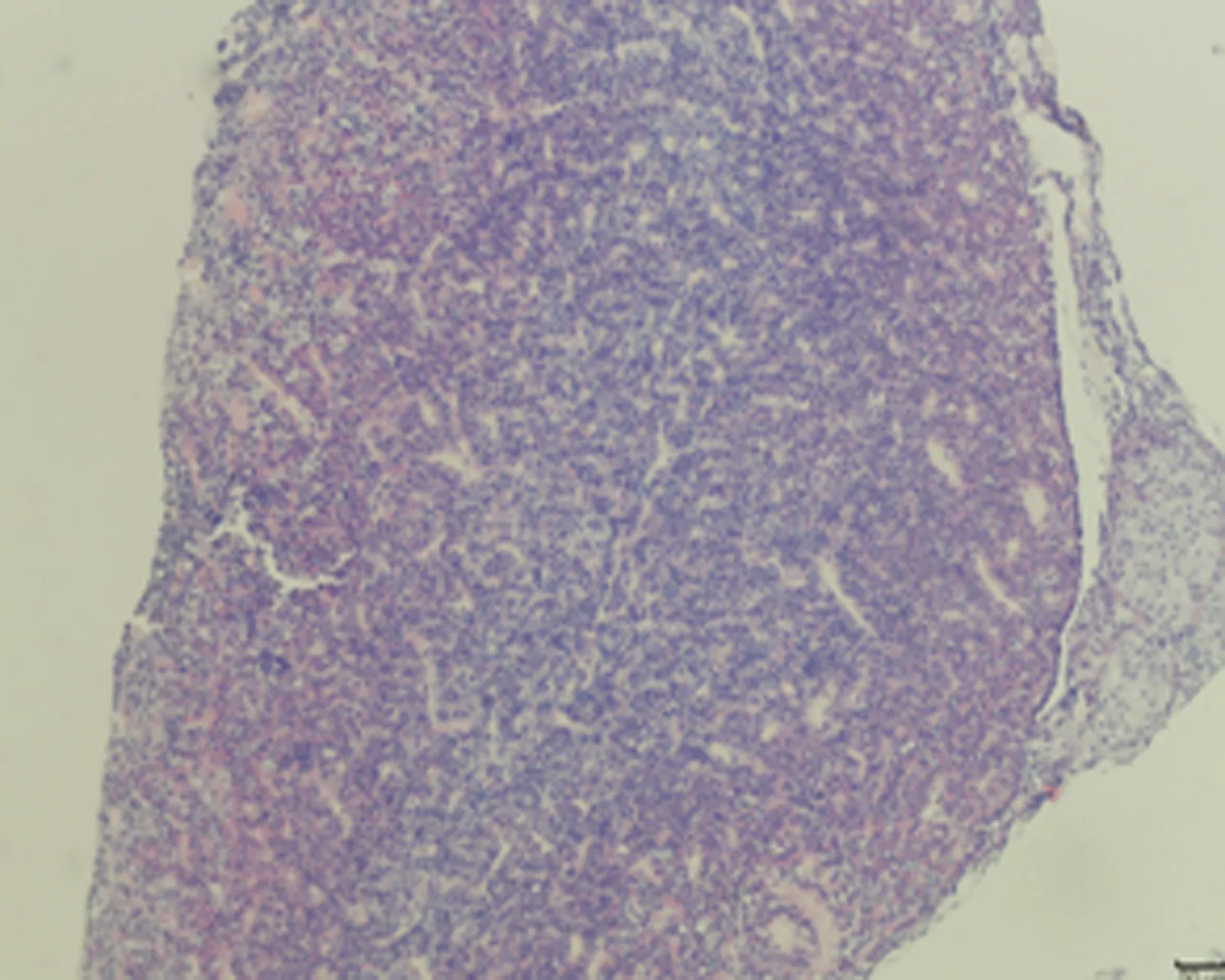
b.未成模组 (×100)
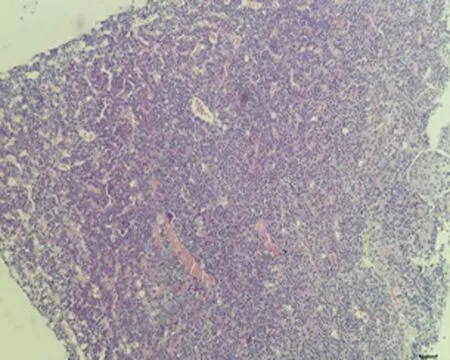
c.弱精子症组 (×100)
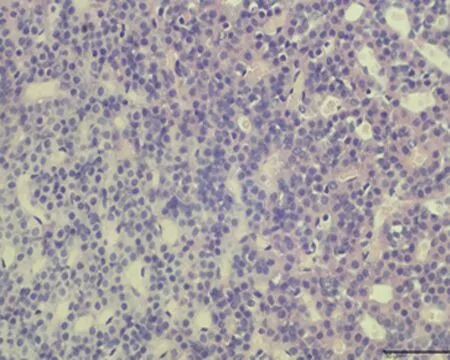
d.正常对照组 (×400)
e.未成模组 (×400)
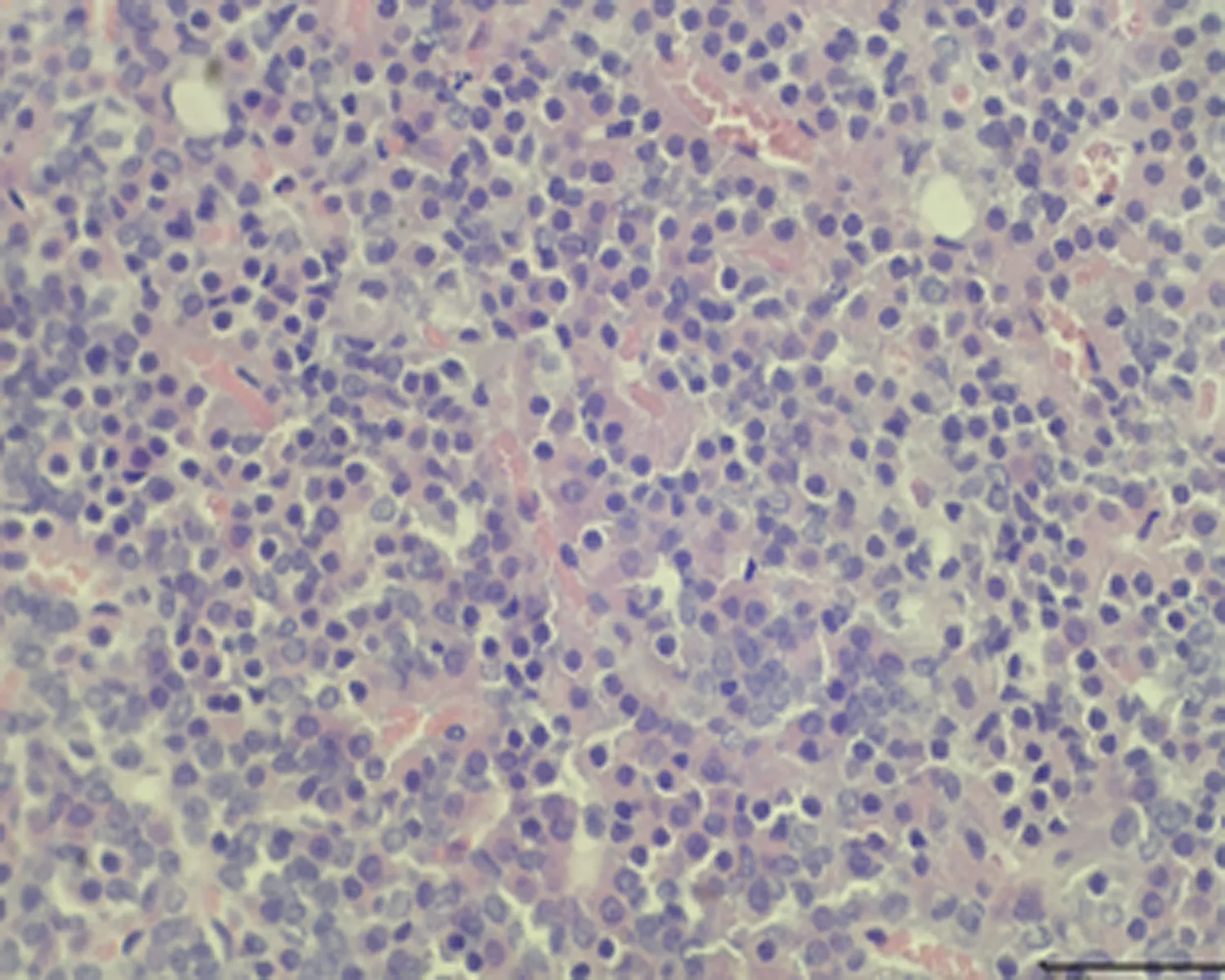
f.弱精子症组 (×400)
a.正常对照组 (×100)
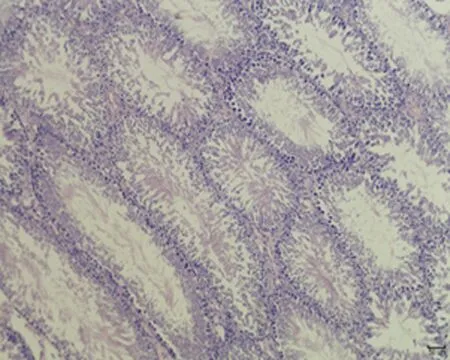
b.未成模组 (×100)
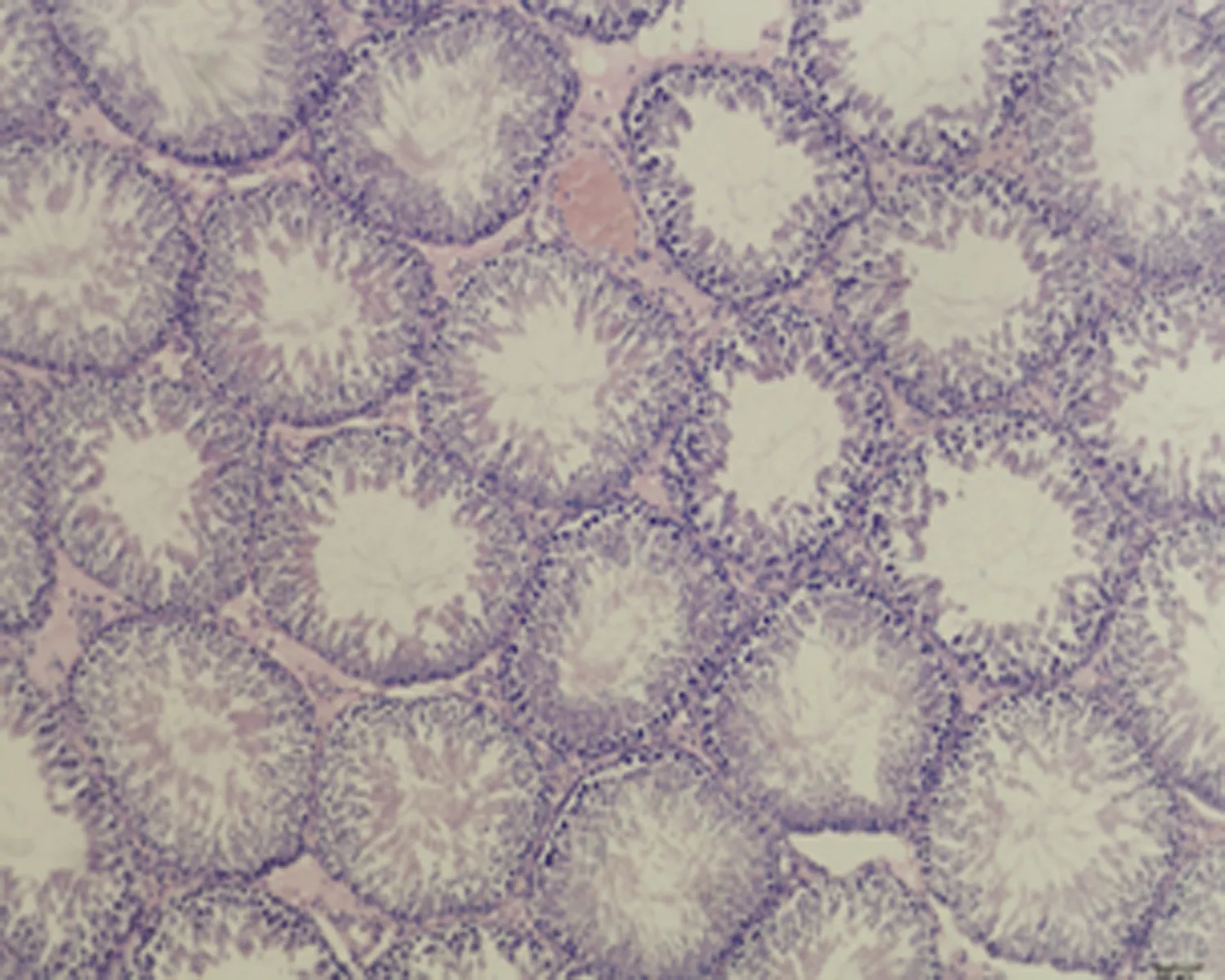
c.弱精子症组 (×100)

d.正常对照组 (×400)
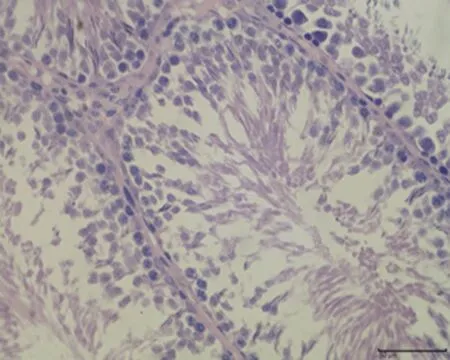
e.未成模组 (×400)
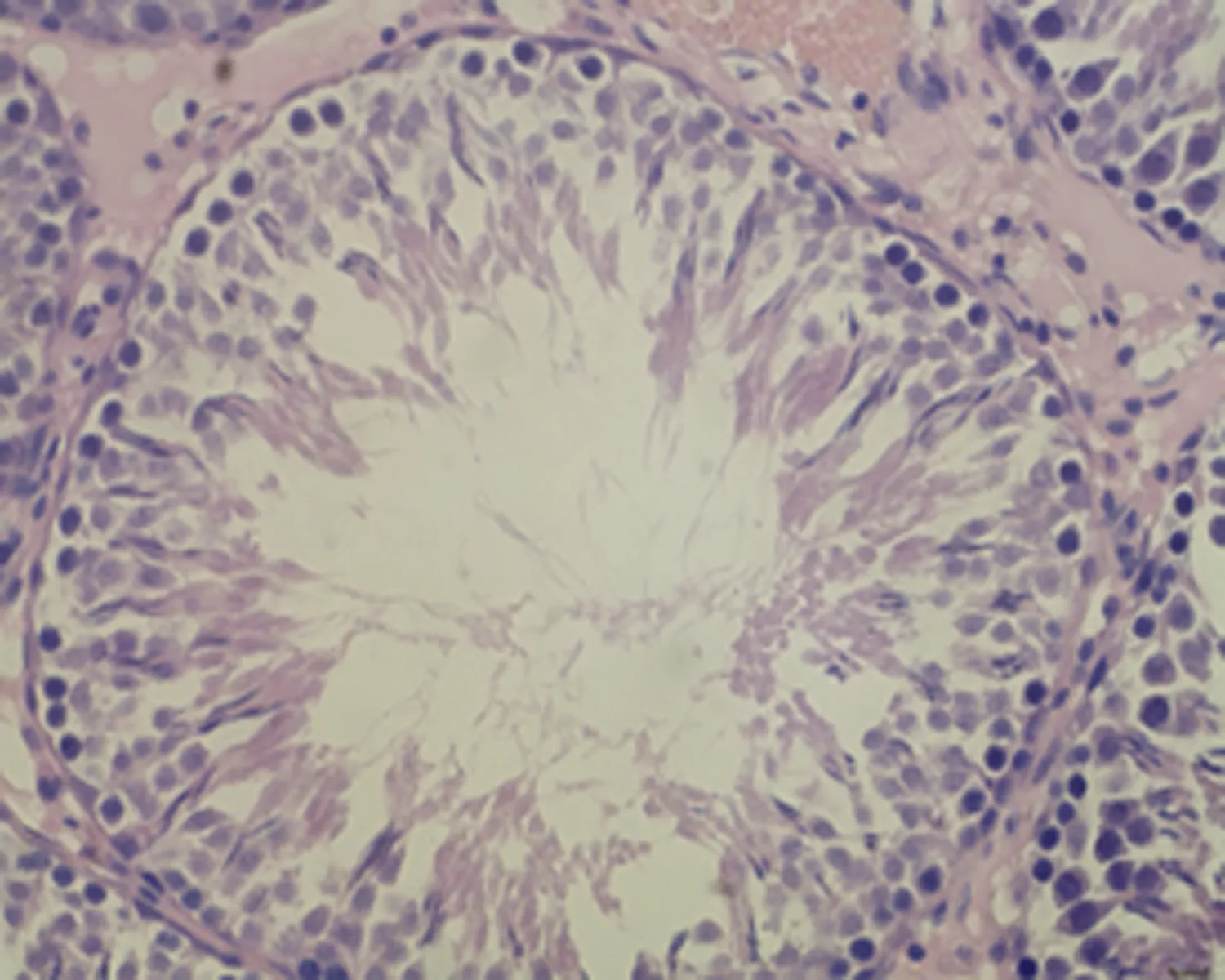
f.弱精子症组 (×400)
3 讨论
弱精子症作为男性不育的重要原因之一,与男性生活环境、气候、物理化学损伤及生活方式有关。近年来基于弱精子症模型研究不断增加,弱精子症动物模型多采用化学损伤[6]、电离辐射等急性损伤方式建立[7]。本研究经过23周的慢性、长期冷环境刺激后,冷刺激建模组大鼠精子活力、活率较正常对照组降低,其中PR降低42.55%,PR+NP降低43.51%,活率降低57.12%,有50%大鼠出现弱精子症,弱精子症组较正常对照组PR和PR+NP分别降低82.97%和 79.08%,精子活率则降低57.12%,表明稳定的冷环境慢性、长期刺激下,不仅可以从精子的运动能力和活率层面影响精子功能,进一步发展后还可形成弱精子症模型。有报道称冷水浸没可导致精子活力降低[4],与本研究结果一致,但该研究中冷刺激未引起精子浓度的改变,究其原因可能是大鼠对全身冷环境刺激与睾丸局部冷刺激产生反应的不同有关。
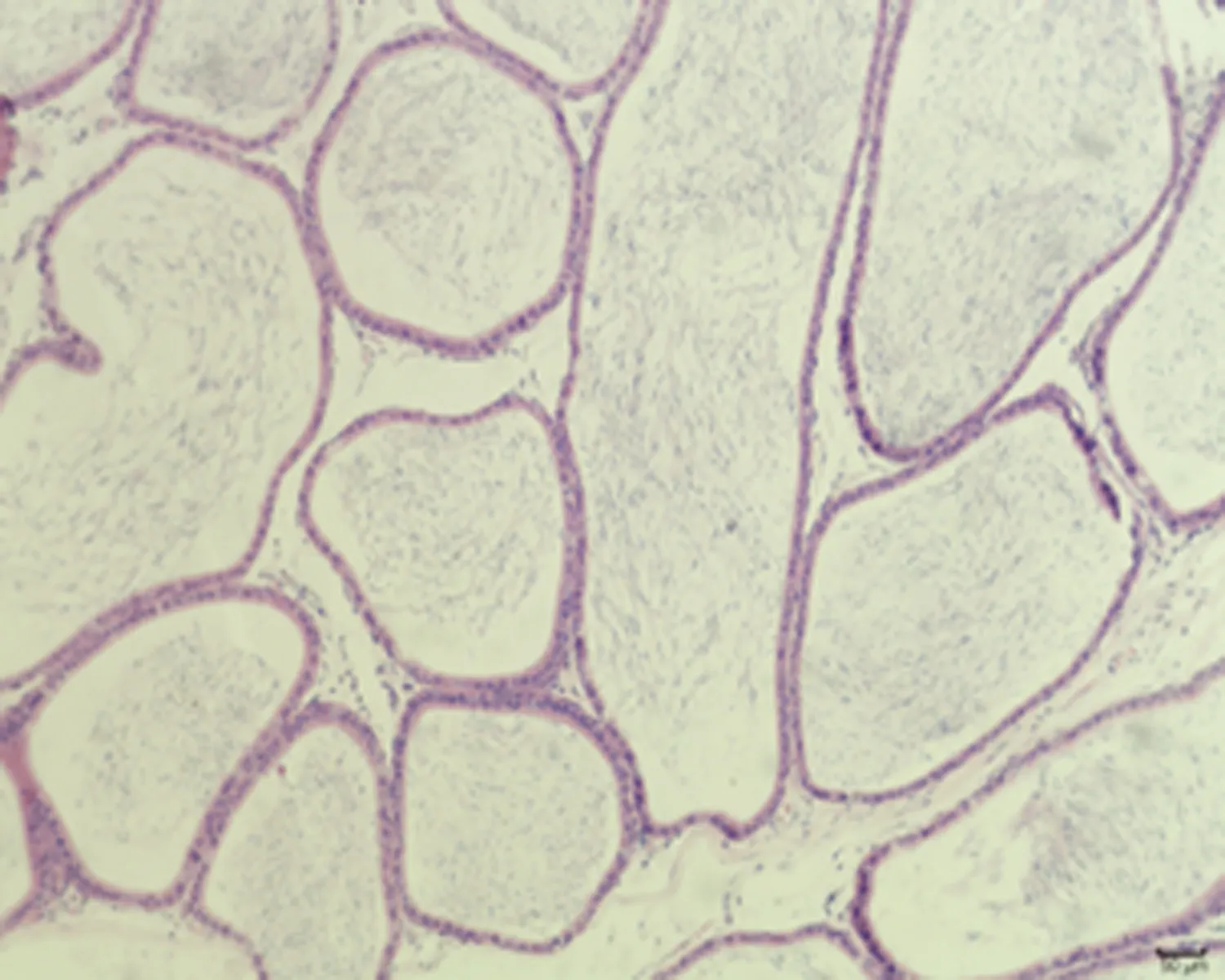
a.正常对照组 (×100)
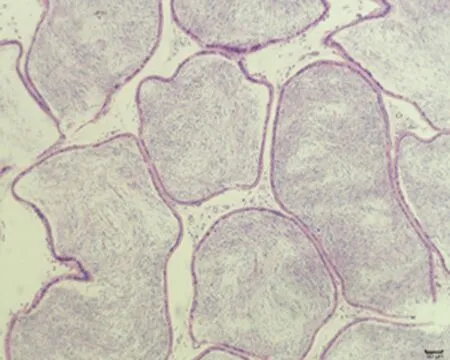
c.弱精子症组 (×100)
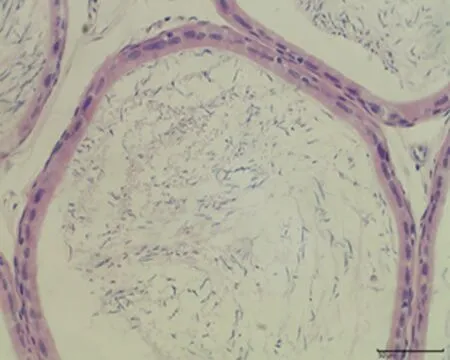
d.正常对照组 (×400)
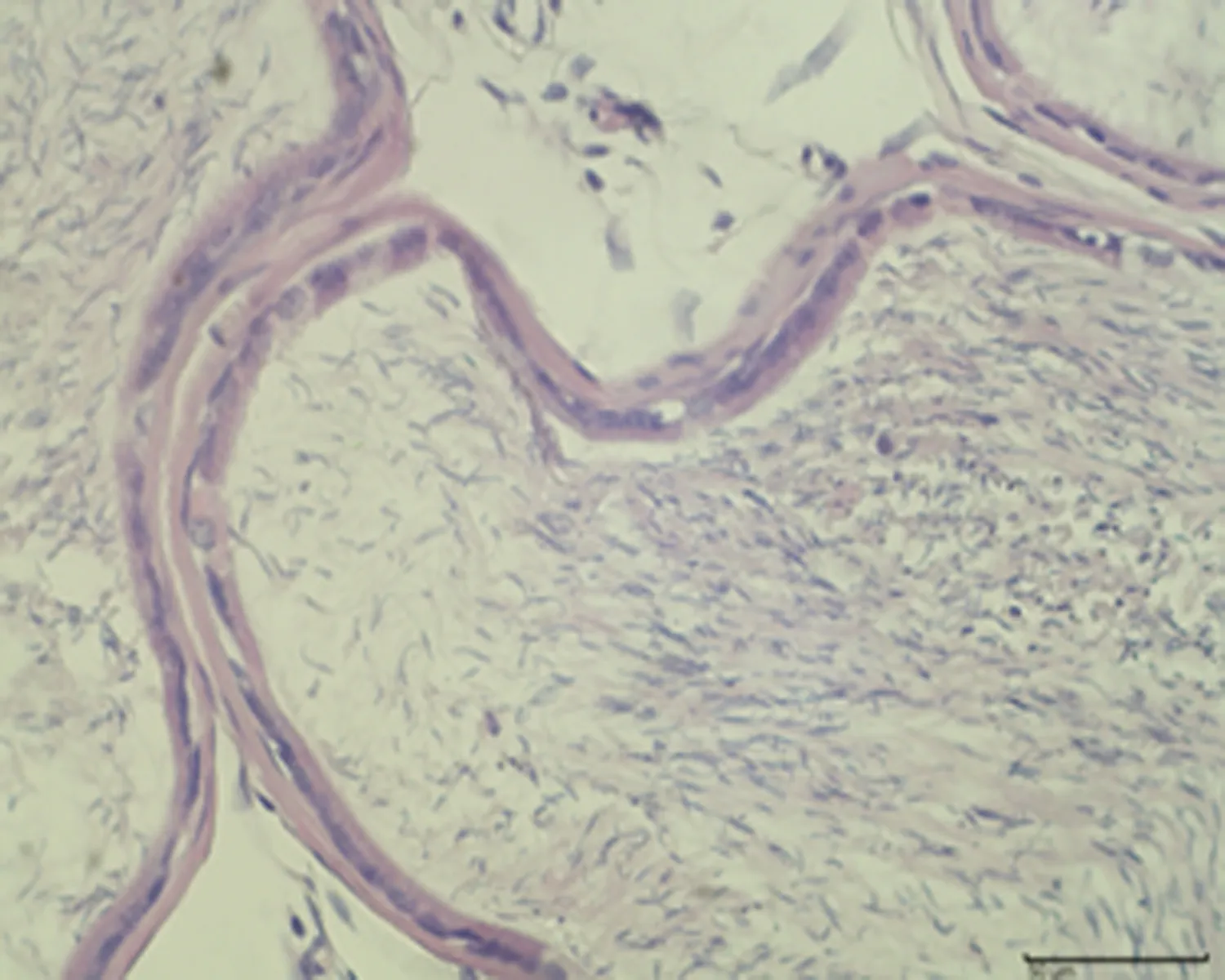
e.未成模组 (×400)
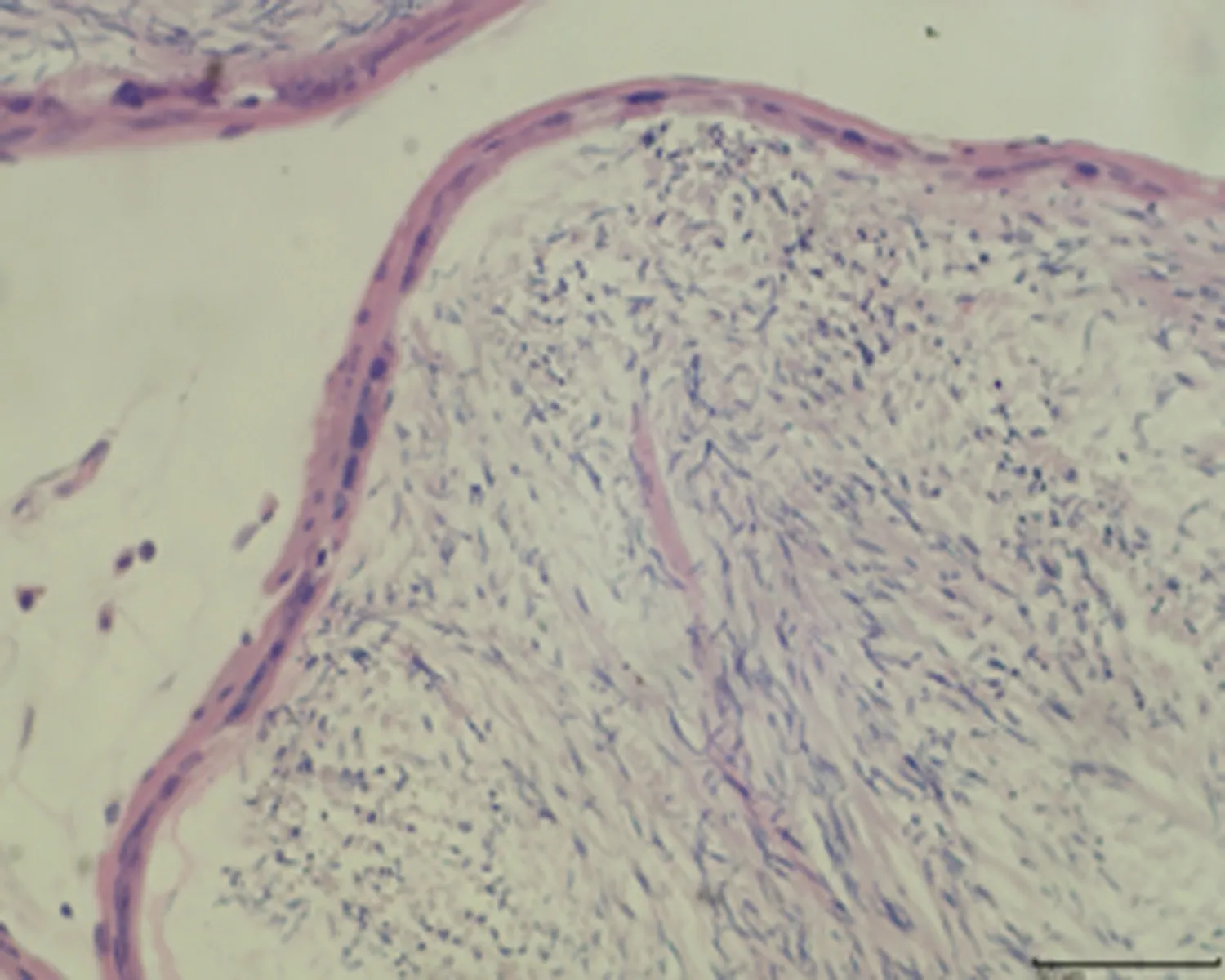
f.弱精子症组 (×400)
精子的产生和运动能力有赖于正常的性激素水平,睾丸作为生殖腺,不仅是产生生殖细胞的器官,同时也产生性激素,发挥内分泌功能,受到上级性腺轴激素的调控,其中腺垂体分泌的LH和FSH可对睾丸生精功能发挥调控作用[9]。LH主要作用于睾丸间质细胞产生T,而FSH主要作用于支持细胞并维持其细胞数量与功能[10],促进生精小管产生精子,控制T向E2转化[11]。睾丸内高浓度T在精子的生成与成熟过程中发挥着重要作用,T水平不足可影响精子发生,导致精子浓度降低[12]。与此同时雌激素在生精过程中也起重要作用,涉及精子正常发育及形成过程[13-14]。精子自身合成E2可提高精子的运动能力和活率[15-16]。但过高水平E2反而会降低精子运动能力,引起不育[17-18]。因此,致病因素可通过损害性腺轴,发挥对生殖系统发育的损害作用[19]。长期冷环境刺激,使雄性大鼠呈现性腺轴激素紊乱的状态,其中E2水平的升高在弱精子症模型的形成中可能发挥着重要作用,包括通过负反馈调节降低血清LH。T水平升高,无统计学意义,具体机制尚不清楚。有研究者[5]将勃兰特田鼠暴露于4℃冷环境时发现, T水平在造模后期由降低变为升高。因此,T水平变化可能与冷刺激干预周期有关。性腺轴形态学观察结果显示,弱精子症组下丘脑、垂体及睾丸、附睾均产生不同程度的水肿样病理改变,可能和炎性改变有关。下丘脑中神经元细胞增生、排列紊乱、毛细血管袖套改变及垂体中嗜碱性细胞较少可解释弱精子症组显著降低的LH水平。结合睾丸、附睾系数的变化,该弱精子症模型的发生发展中,性腺轴的神经内分泌功能紊乱应发挥着重要的作用。综上所述,冷环境长期刺激下可影响大鼠精子的运动能力,进而诱发弱精子症,其机制与性腺轴内分泌功能改变相关,但具体发病机制尚待进一步研究证实。
