宫颈癌组织中Ⅲ型和Ⅴ型胶原蛋白的表达水平研究
2020-09-29艾尔肯肉孜比拉力木叶斯尔买买提
艾尔肯·肉孜比拉力, 焦 谊, 木叶斯尔·买买提, 林 晨
(新疆医科大学基础医学院1生物化学暨分子生物学教研室, 2病理学教研室, 乌鲁木齐 830011)
宫颈癌是最常见的女性生殖道恶性肿瘤,发病率在女性恶性肿瘤中居第二位,中国每年新发病例达13.15万,死亡人数每年约5.3万,新疆是宫颈癌高发地区,发病率高达490/10万[1-2]。近年研究发现肿瘤微环境中的细胞外基质不仅提供了细胞黏附的物理支架,还参与调节许多生物学过程,如肿瘤细胞的生长、迁移、分化和内稳态等[3]。胶原蛋白作为细胞外基质中含量最多的蛋白,其在肿瘤发生发展中的作用尚存在争议。本课题组前期研究中对宫颈癌和正常对照组织采用同位素标记的相对和绝对定量(isobaric tags for relative and absolute quantization, iTRAQ)技术进行蛋白质组学研究发现,在宫颈癌中Ⅲ型胶原(COL3A1)和Ⅴ型胶原α1链(COL5A1)、α2链(COL5A2)呈下调表达,但其与宫颈癌的关系未见报道。
本研究选择Ⅲ型胶原和Ⅴ型胶原蛋白,从基因转录水平 (mRNA)和蛋白质表达水平探讨其与宫颈癌发生发展的关系,为揭示宫颈癌侵袭转移机制提供实验依据。
1 材料与方法
1.1 临床标本组织标本收集于本课题组前期收集的宫颈癌与正常对照组标本,共计61例,其中宫颈鳞癌组织36例,非癌宫颈组织25例,新鲜组织经液氮速冻,置于-80℃冰箱保存。另选取宫颈病变患者的存档石蜡包埋组织标本60例,其中宫颈癌 30例,非癌宫颈组织30例。所有入选病例术前均未接受放疗或化疗,也未患有其他恶性肿瘤。对照组非癌宫颈组织来自子宫肌瘤、子宫下垂、子宫腺肌症等良性病变接受全子宫切除术的女性患者,患者年龄25~69岁。
1.2 主要试剂与仪器设备RNA提取的Trizol试剂(Invitrogen公司),氯仿和异丙醇(上海生工),RevertAidTM First Strand cDNA Synthesis Kit(K1622 Fermentas),Real time RT-PCR SYBR Green1试剂盒(DRR041A,TAKARA),抗体稀释液(北京中杉),Tris/EDTA修复液(pH9.0,北京中杉),Anti-Collagen III抗体[FH-7A] (ab6310),二抗(PV-6000北京中杉),DAB试剂盒(北京中杉),荧光定量PCR仪(IQ2 Bio-Rad 美国),高速低温离心机(ALLEGRA 64R,Beckmann Coulters,美国),凝胶成像系统(GelDoc XR,Biorad美国),紫外分光光度计,(Nanodrop2000,Thermo Scientific,美国)。
1.3 实时荧光定量PCR
1.3.1 组织总RNA的提取 取冷冻组织50~100 mg,在液氮冷冻状态下碾碎后,采用Trizol试剂和氯仿方法提取组织总RNA,紫外分光光度计测定RNA浓度及纯度,OD260/280=1.8~2.0,并用1.0%琼脂糖凝胶电泳和紫外成像鉴定RNA质量。
1.3.2 cDNA、引物设计与合成 提取质量合格的RNA后定量到1 μg,以Oligo-dT为引物,参照 PrimeScript RT reagent Kit 说明书进行反转录,反转录条件: 37℃ 15 min, 85℃ 5 s,所得cDNA置于-20℃储存备用。引物设计与合成见表1。

表1 PCR引物序列信息
1.3.3 荧光定量PCR扩增体系及循环 每管加TAKARA SYBR Premix Ex 12.5 μL,cDNA或标准样品2 μL,上下游引物各0.5 μL,并加ddH2O 9.4 μL以使体系总体积达到25 μL,离心混均后置于荧光定量PCR仪中,95℃预变性3 min,然后95℃ 10 s,55℃~60℃ 30 s,最后在65℃~95℃ 10 s条件下,进行循环,以建立PCR产物的熔解曲线。
1.3.4 计算相对起始量将标准品用ddH2O做5倍倍比稀释后,依次稀释成8个数量级浓度梯度后进行PCR扩增,绘制标准曲线,(每个梯度至少做3份平行实验),计算标准曲线各参数:线性范围、相关系数R2、扩增效率E。对于每种目的基因,iQ5 软件会根据每个基因的标准曲线和每个待测样品的Ct值(Threshold Cycle,阈值循环数) 为每个样品计算出 SQ 值(starting quantity,起始量),即为该候选基因在该样品中的相对转录水平。以β-actin为内参基因,对每个待测样品的候选基因进行标准化处理,得到其标准化的相对转录水平。表达水平(相对表达量)=目的基因的起始量/内参基因的起始量。
1.4 免疫组织化学染色
1.4.1 免疫组织化学(SP法)检测 宫颈癌和对照组织均4μm厚连续切片,按常规方法脱蜡水化并用微波修复抗原。采用免疫组织化学SP法检测,按试剂说明书进行操作。滴加一抗(1∶400稀释)4℃孵育过夜,生物素标记的山羊抗兔/鼠二抗工作液室温孵育15 min, DAB显色,苏木素复染。
1.4.2 结果判定 显微镜下胶原染色阳性区域为黄色至深棕黄色, 按着色强度判定结果,显色不明显或无显色为阴性(-),显色淡黄色为弱阳性(+),显色黄色为阳性(++),显色为深棕黄色为强阳性(+++)。
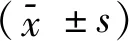
2 结果
2.1 宫颈癌组与对照组中COL3A1、COL5A1和COL5A2的mRNA表达水平与对照组相比,宫颈癌组织中COL3A1mRNA水平下调,差异有统计学意义(P<0.05),但COL5A1和COL5A2转录水平变化无统计学意义(P>0.05),见表2、图1。
表2 宫颈癌和对照组织内COL3A1、COL5A1、COL5A2的mRNA水平
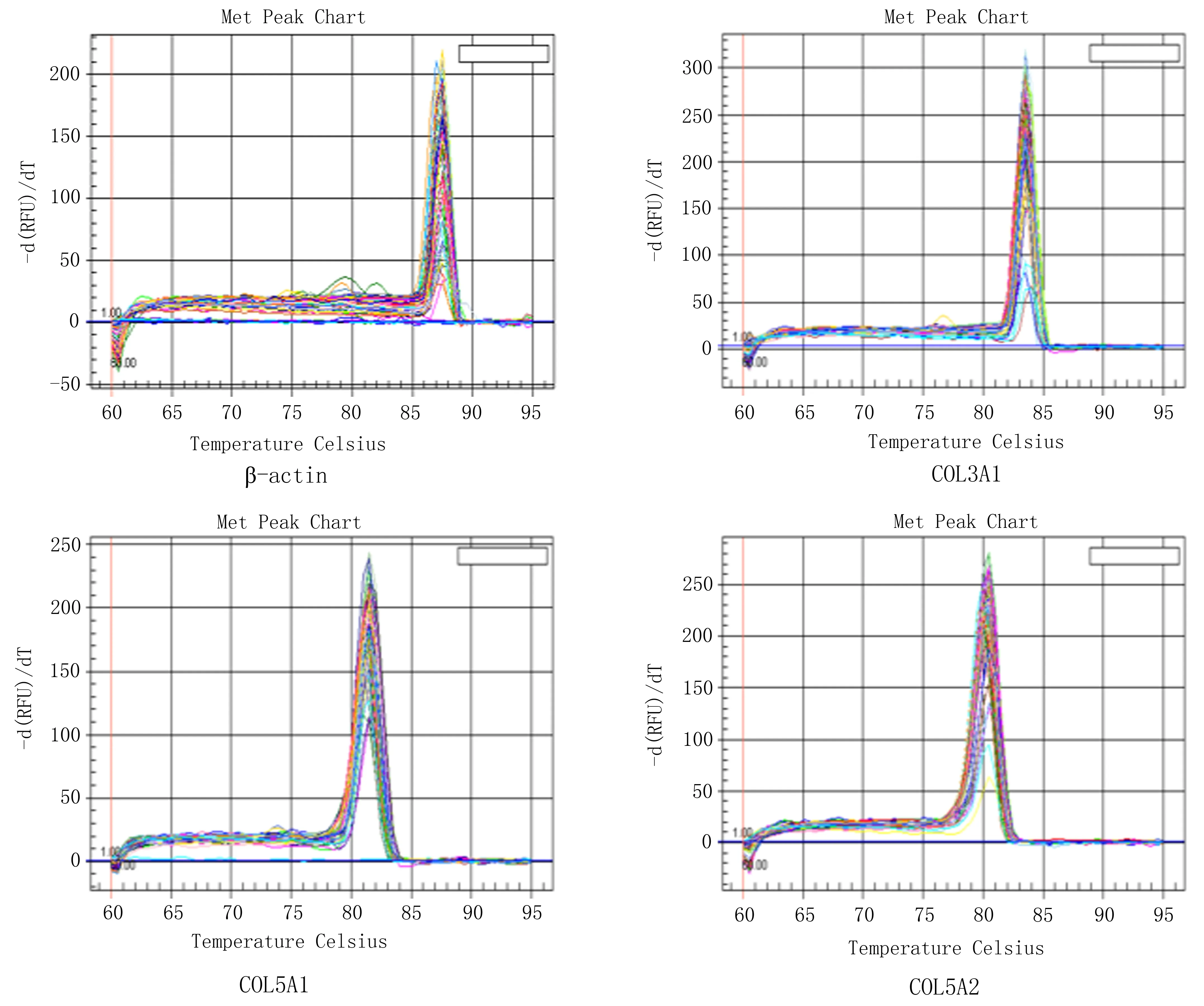
图1 PCR熔解曲线
2.2 宫颈癌组与对照组中COL3A1免疫组化染色结果COL3A1表达于细胞外基质中,呈卷曲网状或条索状(图2),在对照组织中为不同程度的阳性染色,阳性率 93.3%,在宫颈癌组织中多为阴性染色,阳性率为 23.3%(P<0.05),见表3。
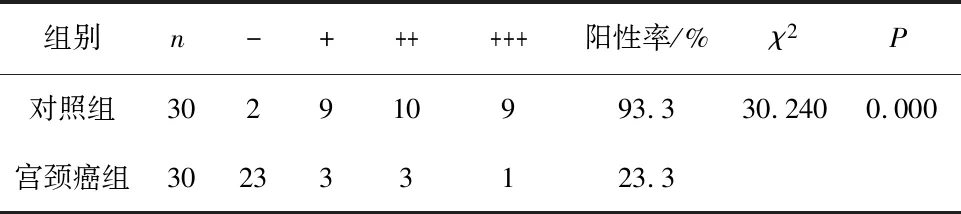
表3 COL3A1在宫颈癌组织及对照组织中的表达
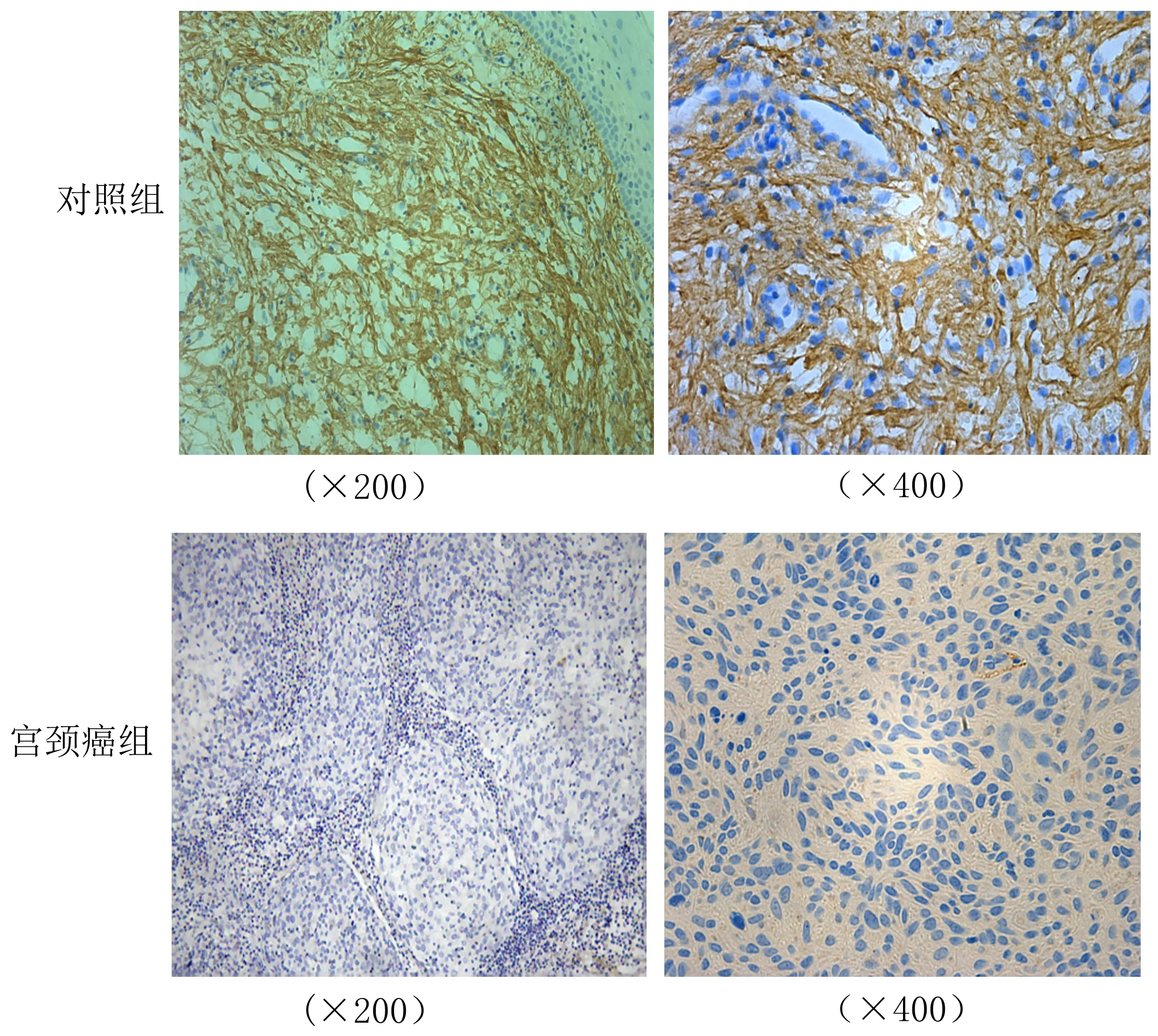
图2 COL3A1蛋白在宫颈癌和对照组织中的表达(免疫组织化学)
3 讨论
肿瘤微环境主要由肿瘤间质成分所构成,包括多种非肿瘤性的细胞成分以及细胞外基质。胶原作为细胞外基质的重要组成部分,在保持个体完整性和调节体内平衡中起到了重要作用[4]。胶原对肿瘤生长具有屏障作用,在一定程度上限制肿瘤细胞浸润和转移[5],但也有一些研究证实胶原具有促进肿瘤增殖、侵袭转移的作用[6-7]。
本研究显示宫颈癌组织内COL3A1 基因和蛋白表达明显降低。III型胶原是细胞外基质中第二丰富的胶原,通常分布在I型胶原附近。III型胶原蛋白是由3条α1(III)肽链组成的同源三聚体,在体内分布广,主要多见于皮肤,消化道,血管和子宫等弹性结缔组织中,其编码基因为COL3A1[8]。Becky等[9]在研究小鼠乳腺癌模型时,发现COL3A1缺陷型成纤维细胞来源的胶原更为密集和线性化,COL3A1缺陷型小鼠的原发肿瘤更易生长和转移,说明III型胶原可以抑制乳腺癌细胞的侵袭转移。还有研究发现在卵巢癌和乳腺癌中,血清中基质金属蛋白酶(matrix metalloproteinase, MMPs)降解III型胶原产生的胶原片段C3M水平明显升高,提示在肿瘤发展过程中,肿瘤组织中的III型胶原的降解增强[10]。但有研究发现结肠癌肿瘤组织的中心区域和正常组织相比,结肠癌肝转移的边缘组织中COL3A1 表达量显著增加,并可通过激活Akt/mTOR信号通路促进肿瘤细胞侵袭转移,COL3A1在结直肠癌上皮细胞中表达上调与不良预后相关[11-12]。然而需要注意的是,细胞外基质中的胶原蛋白处于动态变化的过程,由于细胞外基质、肿瘤细胞和间质细胞之间的动态相互作用,肿瘤间质胶原成分的演化最终可能导致COL3A1水平随着时间的推移而增加,即使最初COL3A1的表达量很低。
V型胶原是一种具有调节作用的纤维形成胶原。它有多个不同的分子亚型,它们是由三种不同的多肽α链组成的——α1 (V)、α2 (V)和α3 (V)。研究发现V型胶原蛋白的增加通过促进caspase依赖的凋亡型死亡而损害乳腺癌细胞的生存[13];而在小鼠化学性肺癌模型中发现V型胶原蛋白的减少可使癌细胞凋亡减少,并且V型胶原表达下调导致其与I型、III型胶原共聚合减少,从而促进了癌细胞侵袭性和能动性[14]。与之相反,有研究发现,COLV在胰管腺癌前体病变的基质中逐渐积累,并通过激活FAK信号通路,影响癌细胞恶性表型的相关方面,直至形成转移[15]。
本研究结果显示COL5A1和COL5A2 mRNA水平变化无统计学意义,与前期蛋白组学结果不一致,提示在宫颈癌发展过程中,胶原蛋白表达可在不同水平受到调控。在肿瘤发展过程中,肿瘤细胞可产生大量的MMPs以降解细胞外基质中的多种胶原蛋白,如COLV可被MMP-2和MMP-9降解,以至其正常结构被破坏和肿瘤组织中含量降低[16]。通过胶原降解,原本光滑和卷曲的胶原结构被破坏,胶原蛋白上的一些隐蔽的位点暴露,增加胶原蛋白交联和沉积,引起细胞外基质重塑,改变肿瘤微环境的稳定性和间质细胞极性,为肿瘤细胞的侵袭迁移提供条件。
综上所述,同一种胶原蛋白在不同的肿瘤中具有不同的功能,甚至在同一肿瘤的不同发展阶段也会产生不同的作用。本研究明确了宫颈癌的发生发展与III型胶原蛋白表达水平和其编码基因COL3A1转录水平下降存在密切关系,为后续功能和机制研究提供了实验基础。
