局部晚期宫颈鳞癌患者中BTLA的表达与近期疗效分析
2020-09-29张典刚王晓青王若峥
张典刚, 王晓青, 王若峥
(1新疆医科大学附属肿瘤医院放疗中心, 乌鲁木齐 830011; 2新疆肿瘤学重点实验室, 乌鲁木齐 830011;13中国医学科学院肿瘤免疫与放疗研究重点实验室, 乌鲁木齐 830011; 4新疆伊犁州友谊医院放疗科, 新疆 伊犁 835000)
免疫治疗(immunotherapy, IT)是目前肿瘤治疗的研究热点,在恶性肿瘤的治疗中发挥着越来越重要的作用。目前研究较多的免疫检查点(immune checkpoints, IC)有抗程序性死亡受体-1(Programmed Death-1, PD-1)、细胞毒性T淋巴细胞抗原4(Cytotoxic T Lymphocyte Antigen-4, CTLA-4)和T细胞免疫球蛋白粘蛋白分子-3(T cell immunoglobulin and mucin domain containing molecule-3, Tim-3),PD-1、CTLA-4等免疫检查点抑制剂(immune checkpoint inhibitors, ICI)已批准上市,但其疗效尚不满意,同时免疫相关不良反应如免疫相关性肾炎、肺炎、肠炎也令人担忧[1-2]。BTLA是继PD-1、CTLA-4之后发现的CD28超家族中第3个免疫检查点,也是T细胞表面的负性共刺激分子[3]。有研究发现敲除BTLA的小鼠体内T细胞的功能显著增强,从而提示BTLA过表达与T细胞功能耗竭有关[4]。本实验收集CSCC癌患者的外周血和配对的癌组织,采用流式细胞检测技术获得T细胞上BTLA的表达量,并结合临床资料及近期疗效进一步分析,为宫颈癌新的免疫治疗靶点的发现提供实验室依据。
1 资料与方法
1.1 一般资料收集新疆医科大学附属肿瘤医院2017年1-10月收治的初治宫颈鳞癌患者,根据纳入标准和排除标准共收集45例完整病例资料患者,有明确的病理明确诊断,依据2009年国际妇产科联盟(FIGO)分期标准,临床分期为IIb-IVa期),床特征见表1。
1.2 随访方式主要通过门诊或住院复查,随访内容包括妇科检查、血液学及影像学检查评估近期疗效。共随访35例患者,随访截止时间为2018年4月,主要的研究终点为近期疗效。
1.3 治疗方法
1.3.1 放疗的实施 采用外照射和内照射,其中体外照射采用调强技术,内照射采用铱192放疗。体外照射DT45-50Gy,铱192DT6Gy/f,共5~7f。遵循ICRU50及62号文件的规定进行靶区勾画。肿瘤区(general tumor volume, GTV)肉眼和影像学所见大体病灶;临床靶区(clinical target volume, CTV)宫旁组织、阴道和子宫体;预防淋巴引流区,包括下腹部淋巴引流区,闭孔及骶前,髂总及髂内、外;阴道旁和韧带前1/3(IIIa期应考虑预防照射腹股沟淋巴引流区,IIIb期应考虑预防照射腹主动脉旁淋巴引流区),计划靶区(planning target volume, PTV)在CTV基础上外放3 mm。计划及评估:TPS计划系统。要求95%PTV被处方剂量覆盖。

表1 宫颈鳞癌患者一般资料
1.3.2 同步化疗的实施 放疗中同步给予顺铂40 mg/m2静脉滴注,每周1次,共化疗4~6个周期;或者紫杉醇(TAX)135 mg/m2,d1联合顺铂20 mg/m2,d1~3,静脉滴注,3~4周为1周期。
1.4 实验方法采集治疗前肘静脉血标本15 mL,用EDTA抗凝采血管分装。活检钳夹取治疗前宫颈癌组织约0.5 cm3(注意动作轻柔,不要取到出血或炎症部位而导致结果有偏差),使用含有培养基的C管保存。采血后4 h内对血液学标本进行外周血单核细胞(Peripheral Blood Mononuclear Cells, PBMCs)的分离,在台式低温离心机中操作,将分离好的PBMCs层收集到15 mL离心管中,加入RPMI-1640培养基至15 mL洗涤细胞,采用自动细胞计数仪细胞计数,再用RPMI-1640配置细胞至所需浓度(4×106/mL)供后续实验。收集组织后12 h内分离肿瘤浸润淋巴细胞(tumor infiltrating lymphocytes, TILs)。取0.5 M PBMCs和1.0 M TILs,重悬在80 μL FACS洗涤液中,各取2 μL CD4-FITC、CD3-AF700、BTLA-APC-A、CD8-APC-H7标记的抗体加入其中,4℃避光孵育20 min,用FACS洗涤液洗涤2次,加入400 μL固定液,运用BD LSRFortessa流式细胞仪进行检测,应用Flowjo 10流式数据分析软件分析BTLA在T细胞上的表达量。 Flowjo 10 流式数据分析过程见图1、图2。
1.5 统计学处理应用SPSS 22.0软件进行统计学分析,GraphPad Prism 7.0绘制统计图。BTLA在外周血和癌组织中T细胞上的表达量呈偏态分布,用中位数(25%,75%)描述。BTLA在外周血和CSCC组织CD4+、CD8+T细胞表达量之间的比较应用配对秩和检验和Spearman秩相关分析, BTLA在外周血和CSCC组织CD4+、CD8+T细胞表达量与临床特征的比较应用两独立样本秩和检验。P<0.05为差异有统计学意义。
2 结果
2.1 BTLA在外周血和癌组织中T细胞上的表达CSCC外周血和组织中BTLA在CD4+T细胞上的表达量分别为60.60(37.75,68.20)%、0.57(0.18,1.44)%,差异有统计学意义(P<0.001),见图3。Spearman秩相关分析,相关系数r=0.250,P=0.097,二者无相关性。CSCC外周血和组织中BTLA在CD8+T细胞上的表达量分别为32.20(27.05,35.55)%、1.04(0.26,4.48)%,配对秩和检验分析,其差异有统计学意义(P<0.001),见图3。Spearman秩相关分析,相关系数r=0.253,P=0.094,二者无相关性。
2.2 BTLA在外周血中T细胞上的表达与临床特征的比较CSCC BTLACD8+T细胞的表达量在菜花型、结节型、其他类型分别为25.60(16.60,31.40)%、33.40(30.30,36.03)%、32.20(31.00,35.80)%,其不同肿瘤大体类型的差异有统计学意义(P=0.011),见表2。

图1 局部晚期宫颈鳞癌患者外周血中CD4+、CD8+T细胞上BTLA的表达分析策略
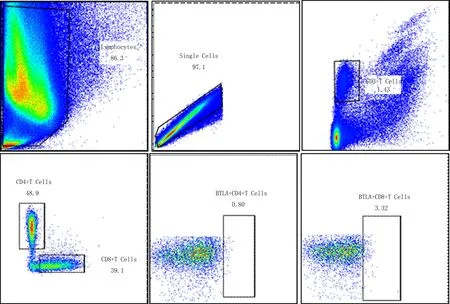
图2 局部晚期宫颈鳞癌患者癌组织中CD4+、CD8+T细胞上BTLA的表达分析策略
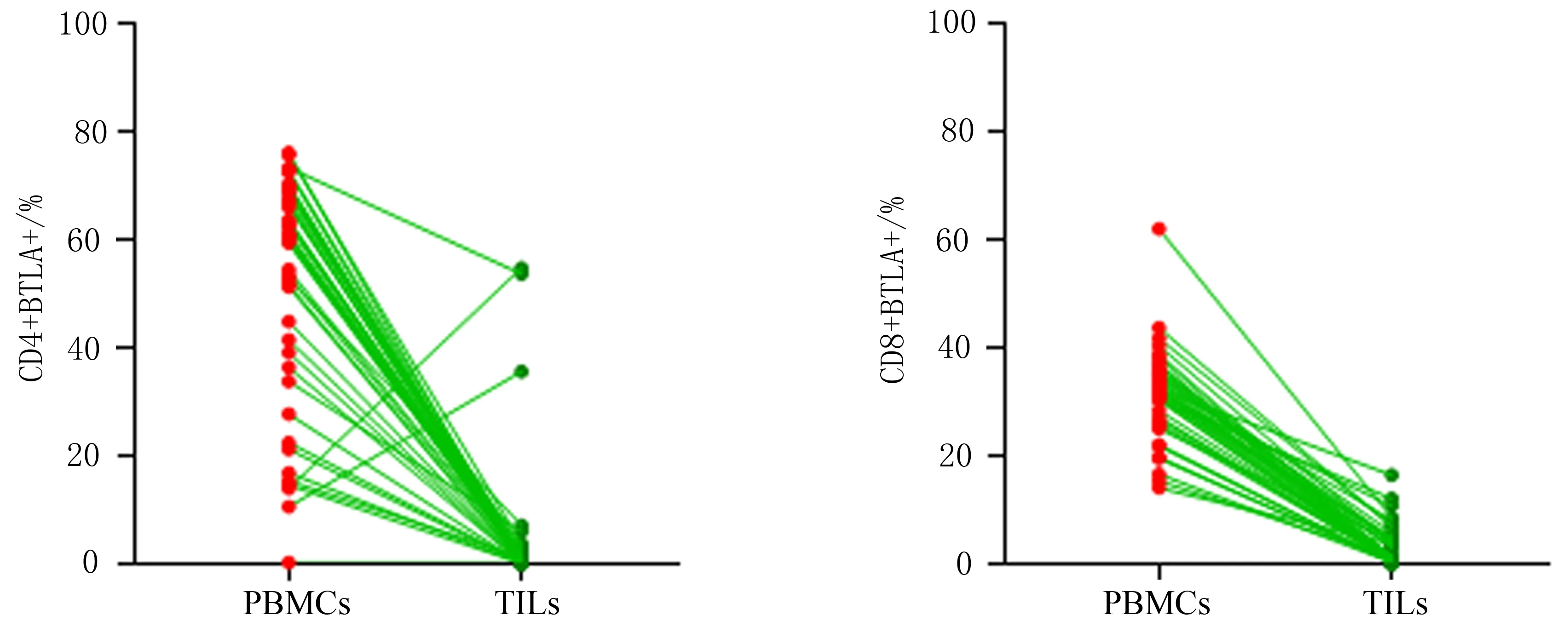
图3 局部晚期宫颈鳞癌患者外周血和癌组织中CD4+、CD8+T细胞上BTLA的表达情况
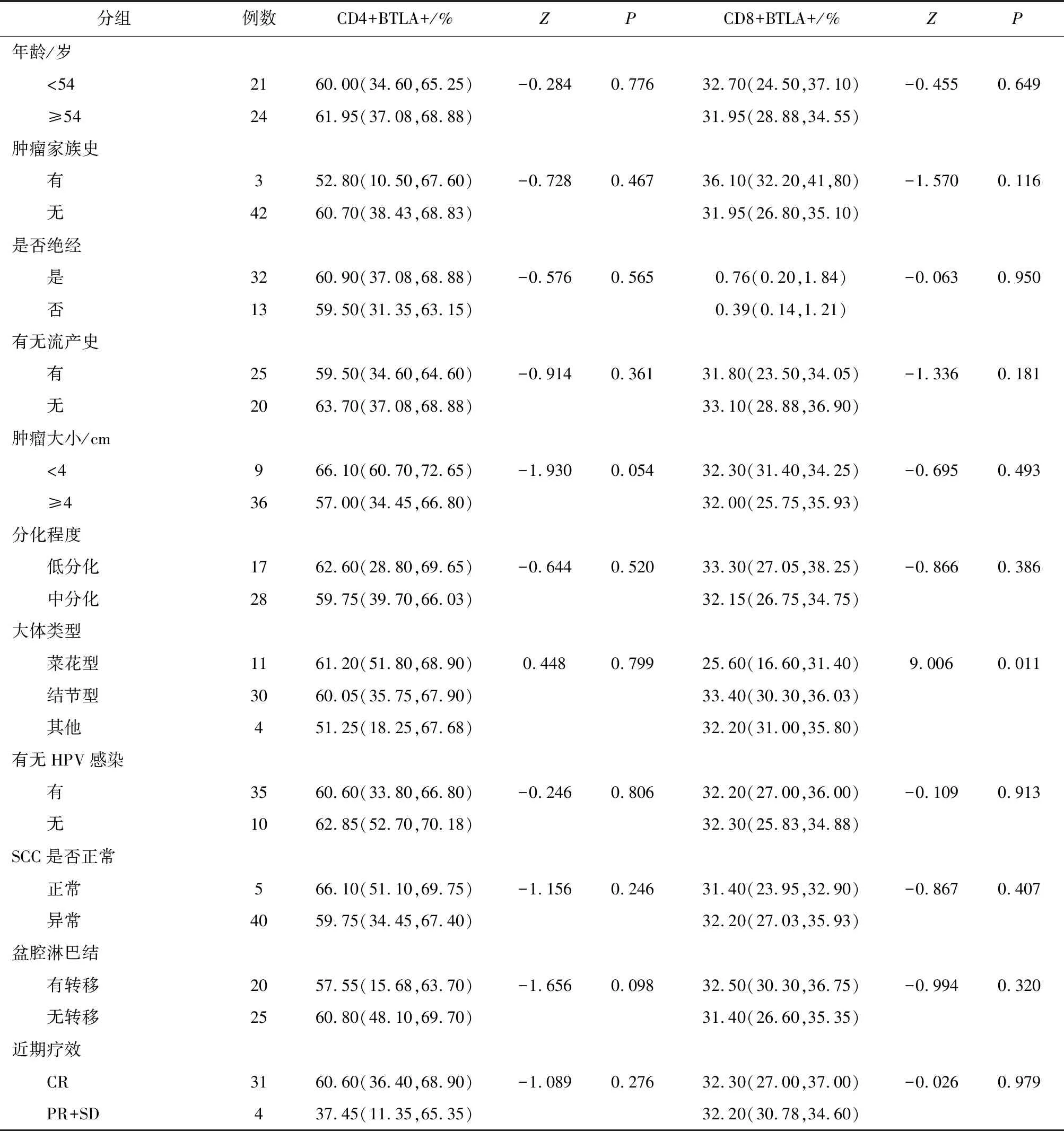
表2 宫颈癌患者外周血中T细胞上BTLA的表达与临床特征的比较
2.3 BTLA在癌组织中T细胞上的表达与临床特征的比较CSCC病理类型低分化和中分化患者癌组织中BTLACD8+T、CD4+T细胞上的表达量分别为2.99%、0.72%和7.04%、0.54,差异均有统计学意义(P=0.034)。CSCC有无恶性肿瘤家族史的患者癌组织中CD4+T、CD8+T细胞上BTLA的表达量7.04、0.54和6.96、0.99,差异均有统计学意义(P=0.045、P=0.012)。见表3。CSCC患者CR+PR为97.14%,外周血和癌组织中T细胞BTLA表达水平CR组与PR+SD差异无统计学意义。
3 讨论
免疫检查点BTLA主要表达于B、T淋巴细胞表面,BTLA在T细胞活化过程中起负性调节作用,可与PD-1、CTLA-4等协同抑制T细胞的增殖和细胞因子产生,是T细胞功能耗竭的免疫检查点之一。Ritthipicha等[5]研究发现BTLA能向激活的CD8+T细胞提供共抑制信号。Forget等[6]发现BTLA和CTLA-4在转移性黑色素瘤患者的癌组织中均表达较低,而在TIL过继细胞疗法中,从患者恶性肿瘤组织中提取出浸润淋巴细胞,在体外扩增这些免疫细胞后输回患者体内,其疗效与CTLA-4+BTLA+CD8+T细胞表达量相关,故转移性黑色素瘤患者运用TIL过继细胞疗法疗效不理想,本研究也发现BTLA在癌组织中的表达较低。Li等[7]收集了肝癌、宫颈癌、乳腺癌、宫颈癌、肾癌等8种常见恶性肿瘤的外周血与癌组织,通过流式细胞技术检测了PD-1、CTLA-4、Tim-3、BTLA等免疫检查点的表达,发现BTLA在上述恶性肿瘤患者癌组织的表达均低于外周血,并且BTLA 在CD4+T细胞中外周血表达量最高。本研究结果显示癌组织中BTLAT细胞亚群明显低于外周血,静脉使用BTLA免疫检查点抑制剂可能会导致较明显的免疫相关不良反应,提示其可能不是抗宫颈癌免疫治疗较理想的免疫检查点。

表3 癌组织中T细胞BTLA的表达与临床特征的比较
有研究表明宫颈癌的分化程度是淋巴结发生转移的独立危险因素及预后影响因素,低分化者更易发生淋巴结转移且预后差[8]。LAN等[9]检测发现胃癌根治术后癌组织中BTLA较癌旁组织呈明显高表达现象,BTLA表达水平与淋巴结是否转移显著相关。BIAN等[10]发现血浆中可溶性BTLA>1.91ng/mL与胰腺癌患者OS(overall survival time,总生存时间)低于6月有关。黄维等[11]使用免疫组化技术检测非小细胞肺癌患者肿瘤组织中BTLA的表达,结果显示BTLA的高表达与淋巴结转移相关。本研究结果显示BTLACD8+T细胞的表达在低分化癌组织中高于中分化者,提示BTLA在宫颈癌中高表达可能与预后不良相关,尚需进一步扩大样本开展深入研究。
文献报道动态监测治疗前后外周血单核细胞不同免疫检查点的表达量,有助于免疫治疗疗效的评估[12]。Chen等[13]对比局部晚期食管鳞癌患者外周血CD4+和CD8 +T细胞在同步放化疗前后占总T细胞比例的变化,发现治疗后CD4+和CD8+T细胞占总T细胞比例升高者较比例降低者预后好。恶性肿瘤家族史是宫颈癌、乳腺癌、结直肠癌等家族聚集性现象肿瘤的重要危险因素,所以有恶性肿瘤家族史者可能更注重对肿瘤的筛查,做到早发现、早诊断、早治疗[14-15]。本研究结果提示,BTLA在有无恶性肿瘤家族史CSCC患者癌组织T细胞上的表达差异有统计学意义,但由于有肿瘤家族史的病例数少,该结果可能存在偏倚,有待扩大样本量进一步研究。本研究显示CSCC患者外周血BTLACD8+T细胞上的表达与不同肿瘤大体类型的差异有统计学意义,但还需进一步扩大样本量证实这一点。
