血清可溶性内皮因子(sEng)水平与子痫前期的严重程度和临床结局的相关性研究
2020-09-29孙晓琳韩卫华纪月华冯海芹
孙晓琳, 张 平, 韩 丹, 韩卫华, 纪月华, 冯海芹
(邯郸市中心医院产科, 河北 邯郸 056001)
子痫前期是以内皮功能障碍为特征涉及多系统的妊娠特异性疾病[1]。该病在所有孕妇中占5%~8%,是孕产妇死亡和围产儿死亡的主要原因之一[2-3]。虽然子痫前期的病因尚不清楚,但越来越多的证据表明,先兆子痫是由于胎盘促血管生成因子和抗血管生成因子之间的不平衡造成的,这种不平衡破坏了母体的血管内皮的功能结构,导致了本病的发生[4-5]。
内皮素(endoglin,Eng),又名CD105,是一种同二聚体跨膜糖蛋白,它是转化生长因子( transforming growth factor,TGF) β1和β3型受体复合体的成分之一。Endoglin 主要表达在人类内皮细胞表面和胎盘合体滋养层细胞表面,在新生的内皮细胞上强表达,是内皮细胞增殖的标记之一。可溶性内皮因子(solubleendoglin,sEng)是从内皮细胞表面脱落进入循环的Eng,功能与TGF-β及其受体密切相关。sEng通过抑制细胞对TGF-β的反应,参与血管发生和重塑。妊娠期sEng的主要功能是参与TGF-βI和β3型受体复合体形成并抑制滋养层细胞向外生长和迁移[6]。这说明sEng可能参与了子痫前期的发病机制[7],对这一血管生成途径进行临床干预可能会对子痫前期的临床症状、实验室参数及其并发症的发展产生重要影响。本研究旨在探讨子痫前期女性血清sEng水平与子痫前期的严重程度和预后的相关性。
1 资料与方法
1.1 研究对象选取2017年5月-2019年10月在邯郸市中心医院诊断为子痫前期的1 002例单胎妊娠女性作为研究对象。纳入标准:孕周≥20周,伴有妊娠期高血压。排除标准:患有原发性高血压、糖尿病、肾脏疾病、结缔组织疾病或其他高危产科疾病的患者。另选择同期150例妊娠期间血压正常的健康单胎妊娠女性作为对照组。对照组受试者均于38周后产下1名足月婴儿。
1.2 分组方法依据人民卫生出版社《妇产科学》第8版教材[8],患者按病情的严重程度分组:第1组,健康单胎妊娠女性(n=150);第2组,轻度子痫前期患者(n=238);第3组,重度子痫前期患者(n=528);第4组,子痫患者 (n=236)。
1.3 概念和定义(1)妊娠期高血压、子痫前期、子痫的定义参照中华医学会妇产科学分会妊娠期高血压疾病学组发布的《妊娠期高血压疾病诊治指南(2015)》[9]。(2)HELLP综合征:是指子痫前期并发溶血(hemolysis, H)、肝酶升高(elevated liver enzymes, EL)和血小板减少(low platelets, LP)。(3)不良的产科结局包括:孕产妇死亡、肝包膜下血肿或破裂(经超声检查或剖腹手术)、肺水肿(临床诊断和影像学证实)、需要正性肌力药物支持、插管(专为剖腹产除外)、急性肾功能衰竭(肌酐>198 μmol/L)和胎盘早剥(临床或病理)。(4)不良新生儿结局包括早产、死产(胎儿死亡)和新生儿死亡(新生儿出院前死亡)和小胎龄儿(Small gestational age, SGA,定义为出生体质量低于第十百分位数的婴儿)。
1.4 样本采集和检测患者入组后即采集尿液样本。所有对象均于入院次日空腹取肘静脉血4 mL,常温下静置1 h后以3 000 r/min离心10 min分离血清后,置于-80℃冰箱保存。采用ELISA法(试剂盒购自美国R&D公司)按照制造商的说明测定血清中sEng的水平。尿蛋白和肌酐的测定依据本院常规操作规程检测。
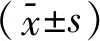
2 结果
2.1 受试者的一般特征患者的人口学、临床和产科特征见表1。4组孕妇年龄、妊娠、不生育、流产次数、子痫前期病史、体质指数(BMI)、孕期吸烟率等资料差异无统计学意义(P>0.05)。
与第2组患者相比较,第3组和第4组患者分娩时的胎龄和新生儿体质量更低,早产率、剖腹产率、SGA发生率、死胎死产发生率以及血压水平更高,差异有统计学意义(P<0.05)。
1 002例子痫前期患者中,共有118例存在1例或1例以上的不良围产期结局,均发生在第3组和第4组。其中第4组发生不良围产结局(胎盘早剥、肝血肿或破裂、急性肾功能衰竭、需要血液透析、肌力药物支持、气管插管、肺水肿、孕产妇死亡等)高于第3组,差异有统计学意义(P<0.05)。结果见表1。
表1 4组受试者的一般特征
2.2 4组受试者血清sEng水平的比较与健康孕妇(对照组)相比,子痫前期各组患者血清sEng水平均较高,差异有统计学意义(P<0.001)。各组间血清sEng水平差异均有统计学意义(P<0.001)。见表1、图1。
2.3 血清sEng水平与临床及实验室参数的关系血清sEng水平与孕龄、婴儿出生体质量和血小板计数呈显著负相关(P< 0.001)。与血压、尿蛋白/肌酐比值、肌酐水平、尿酸、谷草转氨酶(AST)、谷丙转氨酶(ALT)和低密度脂蛋白(LDH)呈显著正相关(P< 0.001)。见表2。
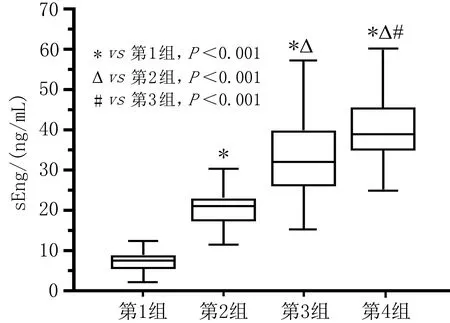
图1 4组患者血清sEng水平的比较

表2 血清sEng水平与临床及实验室参数的关系
2.4 血清sEng水平与不良围产结局关系的Logistic回归分析血清sEng四分位数P25、P50、P75分别为23.9、31.9、39.4 ng/mL。依据四分位数间距把1 002例子痫前期患者分为四组,即Quart 1组、Quart 2组、Quart 3组和Quart 4组(表2)。Quart 4组母体所有不良围产结局的风险均最高(OR值均在3.1以上)。此外,合并胎盘早剥、血小板减少、肝功能异常和34周前早产的风险随着sEng水平四分位数的增加而逐渐升高。同样,Quart 3和Quart 4组患者中,急性肾功能衰竭、需要肌力药物支持、气管插管的人数逐渐增加。Quart 4组的女性出现肺水肿、肝包膜下血肿或破裂、需要血液透析、脑出血或孕产妇死亡的风险最高。结果见表3。
4组间死胎和死产的风险无显著差异。相对于Quart 1组, Quart 2、Quart 3组和Quart 4组女性产出SGA婴儿的OR值逐渐增加。结果见表3。
2.5 血清sEng水平与早产风险的关系Quart 1组和Quart 2组、Quart 3组、Quart 4组相比,从入组到分娩持续时间更长(P<0.001)。Cox比例风险模型在对取样时的孕龄、血压以及蛋白尿进行调整后显示,Quart 2组、Quart 3组和Quart 4组分别较Quart 1组的早产风险增加了1.75、2.30、2.33倍。结果见图2。
3 讨论
本研究所涉及的子痫前期患者的疾病严重程度各不相同,结果显示子痫前期患者的血清sEng水平明显高于正常妊娠患者。且血清sEng水平随着子痫前期严重程度的增加而增加,表明sEng浓度的变化较好地反映了系统性血管内皮损伤的程度和强度。此外,血清sEng水平升高与较为严重的子痫前期表现和并发症(包括HELLP综合征和子痫等)具有高度相关性。本结果与Alfredo等[10]的报道一致,说明sEng作为一种特殊的抗血管生成因子,在子痫前期的女性机体异常升高,而且随着疾病严重程度增加,特别是当发生早产时升高更加明显。
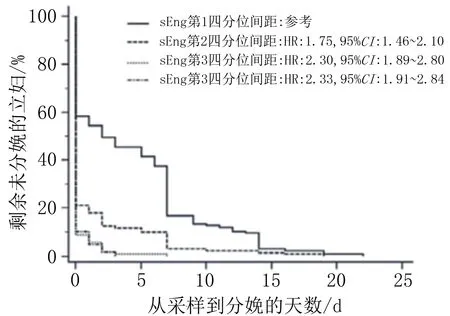
图2 血清sEng水平与早产风险关系的Kaplan-Meier曲线图
本研究还评估了血清sEng水平与发生不良围产结局风险之间的关系。子痫前期的女性血清sEng水平在最高四分位水平时不良围产结局风险最高,且各种不良结局的发生风险随着血清sEng四分位数水平的增加而逐步提高。因此,本研究证实了血清sEng水平与子痫前期女性不良结局之间的关系。在这些研究中[10-11],未发现循环中sEng升高的女性发生不良结果的风险增加。这种差异可能源于研究人群的差异和样本量较小,无法达到统计学效能所致。虽然在单变量分析中,本研究发现sEng水平与新生儿死亡风险相关,但Logistic回归分析调整分娩时的孕周时,未发现统计学差异,提示早产程度是新生儿死亡的主要决定因素。
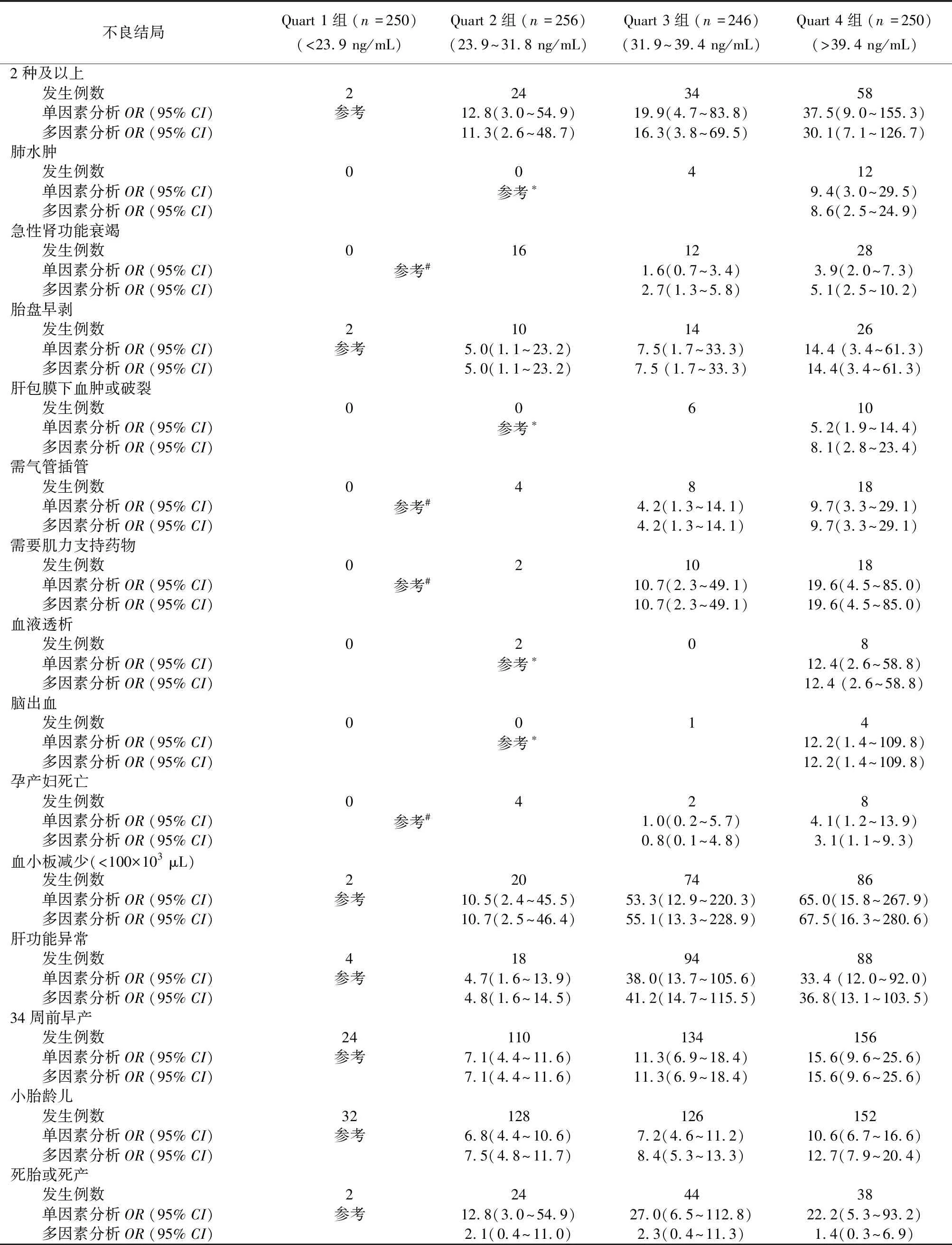
表3 sEng水平与不良围产结局的相关性
前期有研究发现,血清sEng水平与胎龄呈显著的负相关,与收缩压、血清肌酐、尿酸、AST和LDH呈正相关[12-13],这与本研究结果一致。此外,本研究还发现血清sEng水平与新生儿体质量和产妇血小板计数呈显著负相关,与产妇尿蛋白/肌酐比值呈正相关。此外,Rana等[13]研究发现,与本研究中所设置的最低四分位的患者相比,在sEng的最高四分位的患者发生早产的风险更高。
本研究存在一定的局限性。由于纳入标准的限制,本研究排除了患有慢性高血压病、孕前糖尿病、肾脏疾病和自身免疫性疾病等基础病的的孕产妇,故无法确定研究结果是否适用于该人群。本研究的优势在于样本量相对较大,所有子痫前期患者均接受相同的标准化医疗方案,所有样本均在临床怀疑或诊断确认不良孕产妇和围产期结果之前采集,避免了选择偏倚。
血清sEng水平与子痫前期的严重程度、不良结局以及临床和实验室参数高度相关。血清sEng水平对监测子痫前期女性不良结局风险具有一定的价值,特别是对早产的预测作用,有利于早期干预以便延长妊娠周期,改善妊娠结局,降低医疗成本。
