PI3K/AKT信号通路对糖尿病大鼠血糖及骨骼肌GSK-3β表达水平的影响
2020-09-29史浩楠王婷婷董惠娟张羽珊张鹏程
史浩楠, 王婷婷, 董惠娟, 张羽珊, 姚 健, 张鹏程
(1新疆医科大学公共卫生学院, 乌鲁木齐 830011; 2上海健康医学院护理与健康管理学院健康服务与健康管理教研室, 上海 201318)
2型糖尿病在全世界的发病率,正呈逐年上升趋势。在我国,于1979 年、1994 年、2007年以及2010 年分别进行了 4 次大规模的糖尿病流行病学调查,于2010年的调查结果可知,我国约有近1.139亿人患糖尿病[1]。2型糖尿病的发病与胰岛β细胞受损具有密切关系[2],其在环境以及遗传等诸多因素的影响下,常表现为胰岛素抵抗。
磷脂酰肌醇3激酶(PI3K)/丝氨酸-苏氨酸蛋白激酶(AKT)信号通路是细胞内的重要信号传导通路,其主要作用为促进细胞的生长、增殖,抑制细胞的生长阻滞与凋亡[3]。近年来,PI3K/AKT通路在肝纤维化、糖尿病与阿尔茨海默病等领域备受国内外学者的关注[4-5]。
糖原合成激酶(GSK-3β)是AKT的重要底物,其对胰岛素信号通路具有负反馈调节作用,并在血糖稳态调控中起到重要的作用[6-7]。本次实验在建立2型糖尿病大鼠模型时,同步使用PI3K/AKT信号通路抑制剂LY294002,观察血糖与骨骼肌组织中GSK-3β蛋白表达的变化,研究PI3K/AKT信号通路对血糖与GSK-3β的调节作用,探讨该通路对2型糖尿病发病的影响,为2型糖尿病的预防与治疗提供依据。
1 材料与方法
1.1 实验动物SPF级SD大鼠40只,雄性,体质量250~280 g,购买自新疆医科大学动物实验中心,饲养于新疆医科大学动物实验中心SPF级实验环境[SCXK(新)2016-0003;使用许可:SYXK(新)2016-0002]。
1.2 试剂与仪器
1.2.1 主要试剂 链脲佐菌素(STZ)、柠檬酸、柠檬酸钠、胆固醇、果糖、蔗糖、甲基硫脲嘧啶、丙二醇、吐温80、谷氨酸钠、戊巴比妥钠、SDS-PAGE凝胶制备试剂盒(以上均购买自北京索莱宝科技有限公司),LY294002(美国MCE公司),兔抗PI3K一抗(武汉华美生物工程有限公司),兔抗AKT1/2/3一抗(武汉博士德生物科技有限公司),兔抗GSK-3β一抗(武汉爱博泰克生物科技有限公司)、山羊抗兔HRP标记二抗(武汉伊莱瑞特生物科技有限公司)、GAPDH内参蛋白(武汉伊莱瑞特生物科技有限公司)、辣根过氧化酶化学发光显色剂、EDTA蛋白酶抑制剂、考马斯蓝蛋白定量试剂盒(北京全式金生物技术有限公司)、普通大鼠饲料(北京博泰宏达生物技术有限公司)。
1.2.2 主要仪器 酶标仪(Varioskan Flash)、高速冷冻离心机 (HC-3018R)、低速冷冻离心机(KDC-2046)、血糖仪及配套试纸(拜安捷2)。
1.2.3 主要溶液的配制
1.2.3.1 脂肪乳的配置 胆固醇6 g,果糖5 g,蔗糖5 g,吐温-80 6 mL,丙二醇20 mL,谷氨酸钠1 g,甲基硫脲嘧啶0.5 g,猪油20 g。将新鲜猪板油置于铁锅中加热,直至油渣呈金黄色后,将油渣捞出,待猪油冷却后,经六层纱布过滤,盛放于烧杯中待用。A液:将6 g胆固醇加入20 g猪油中,置于电热炉上加热至完全溶解后,向其中加入聚山梨酯-80 20 mL备用;B液:将果糖5 g、蔗糖5 g、甲基硫脲嘧啶0.5 g,谷氨酸钠1 g加入烧杯,并在烧杯中加入少量蒸馏水,置于电热炉上加热至完全溶解后,再向其中加入丙二醇20 mL。将B液倒入A液中,用玻璃棒快速搅拌,与此同时,向溶液中加入蒸馏水定容至100 mL,待溶液完全冷却后停止搅拌,制成脂肪乳。
1.2.3.2 STZ的配置 A液:将柠檬酸2.1 g加入双蒸水100 mL中 ;B液:柠檬酸钠2.94 g加入双蒸水100 mL。将A、B 液按1∶1比例混合,将pH调至4.2~4.5,经灭菌后置于4℃冰箱保存备用。将链脲佐菌素按照1%浓度溶解在缓冲液中,避光保存,现配现用。
1.2.3.3 LY294002溶液的配制 将二甲基亚砜按照2‰浓度溶解在生理盐水中,配置成2‰DMSO溶液,将LY294002溶解在配置好的DMSO溶液中,浓度为0.05 mg/mL。
1.3 实验方法将40只SD大鼠随机分为4组,即正常对照组(N组)、糖尿病组(G组)、DMSO组(D组)、抑制组(L组),每组10只。适应性喂养1周后,检测各组大鼠血糖(GLU)。G、D、L组每日灌胃脂肪乳剂,N组灌胃同等剂量的纯净水,剂量为10 mL/kg。同时N、G组每日腹腔注射生理盐水,D组每日腹腔注射DMSO溶液,L组每日腹腔注射LY294002溶液,剂量均为6 mL/kg。至实验第10日,禁食12 h,同时给G、D、L组腹腔注射STZ溶液,剂量为40 mg/kg,建立糖尿病模型。继续干预至第15日,禁食12 h,腹腔注射戊巴比妥钠溶液麻醉受试动物,使用组织剪剪开腹腔,腹主动脉取血检测GLU,处死受试动物,取下右侧股四头肌,使用锡箔纸包裹置于液氮中速冻,1 h后转移至-80℃冰箱保存待检。以1999年WHO推荐的随机血浆葡萄糖浓度≥11.1 mmol/L作为糖尿病的成模标准,若未达标则予以剔除。
1.4 检测指标
1.4.1 体质量 于实验前测量大鼠体质量一次,之后,每2日称重一次,直至实验结束。
1.4.2 血糖(GLU) 于实验前禁食12 h后剪尾法收集血液,使用干化学法检测血糖,实验第15日禁食12 h,麻醉后腹主动脉取血检测GLU。
1.4.3 Western-blot法检测骨骼肌中PI3K/AKT/GSK-3β表达水平 (1)取约1 g骨骼肌于锡箔纸包裹的干净研钵中,完全研磨后放入1.5 mLEP管中,加入1 mL蛋白抽提液(按蛋白酶抑制剂与强RIPA裂解液1∶100比例配置),涡旋机混匀,超声仪破细胞,14 000 r,4℃,15 min离心,取上清分装于小EP管中。(2)取5 μL蛋白上清液,用1×PBS稀释成100 μL,加入1 mL考马斯亮蓝染液,混匀,室温放置10 min,取200 μL于酶标板,在波长595 nm处检测OD值,根据标准曲线计算蛋白上清中总蛋白含量。加入1×PBS和4×Loading Buffer,将各组蛋白统一稀释成2 μg/μL,100℃水浴20 min,流水冲洗15 min降温,保存于-80低温冰箱。(3)选用10%的分离胶与5%的浓缩胶,蛋白Marker加样5 μL,煮好的蛋白样品加样20 μL,在80 V电压下跑胶30 min,100 V电压跑胶60 min,120 V电转2 h。取出PVDF膜,按照蛋白Marker切割目的蛋白条带。5%的脱脂奶粉封闭液(1×TBST配制)封闭1 h,加入兔抗鼠一抗(PI3K、AKT、GSK-3β、内参GAPDH稀释比例分别是1∶3 000、1∶200、1∶1 000、1∶3 000),4℃摇床孵育,次日回收一抗,TBST洗脱三次,每次10 min,加入山羊抗兔二抗(稀释比例为1∶3 000)进行孵育2 h。(4)回收二抗,TBST洗3次,每次10 min,ECL(A、B、C组分别按1 000∶1 000∶1配制)显色,Image Lab曝光条带。
使用Image J软件分析目标条带的光密度值,采用GAPDH作为内参,使用Image Tool软件进行定量分析。
2 结果
2.1 各组体质量水平比较各组体质量实验前至实验第10天的比较差异均无统计学意义(P均>0.05),实验第12天至第14天实验结束,各组体质量的比较差异有统计学意义(P<0.05),经两两对比,L组的体质量显著低于其余3组,其余3组间无差异,见表1。

表1 各组实验前后体质量的比较
2.2 各组GLU水平比较实验后,除L组死亡1只动物外,G、D、L组动物糖尿病均已成模。各组大鼠实验前GLU的比较差异无统计学意义(F=1.57,P>0.05),实验后各组GLU水平差异有统计学意义(F=58.96,P<0.05),经两两对比G、D、L组GLU均高于N组,G、D组GLU水平差异无统计学意义,实验后L组GLU水平高于其余3组,见表2。
2.3 各组骨骼肌PI3K/AKT/GSK-3β Western-blot法检测结果各组PI3K/AKT/GSK-3β表达差异均有统计学意义(P均<0.01)。PI3K表达水平G、D、L组均低于N组,G组与D组间差异无统计学意义,L组低于G、D组;AKT表达G、D、L组均低于N组,G组与D组间差异无统计学意义,L组低于D、G组;GSK-3β表达G、D、L组高于N组,G组与D组间差异无统计学意义,L组高于D组,见图1、表3。
表2 各组实验前后GLU水平比较
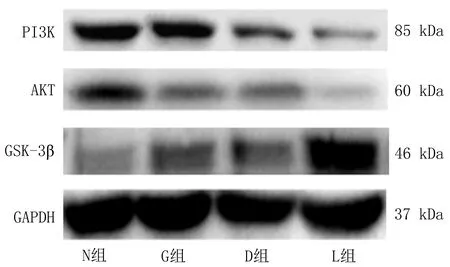
图1 各组骨骼肌PI3K/AKT/GSK-3β
3 讨论
糖尿病是一种受环境因素以及遗传因素共同影响的疾病,其主要病因是胰岛素抵抗[8]。骨骼肌是胰岛素抵抗发生的重要场所,因此本实验使用骨骼肌作为大鼠组织的研究对象。PI3K/AKT信号通路与细胞增殖及凋亡等行为密切相关,其中PI3K是一类胞内磷脂酰肌醇激酶,能够激活蛋白激酶B,抑制下游糖原合成酶的活性,促进糖原合成以及葡萄糖的转运,从而降低血糖水平[9]。AKT是PI3K的下游效应分子,有AKT1、AKT2、AKT3 3个亚型。有研究表明[10],AKT的3个亚型基因剔除的小鼠均会表现出不同程度的血糖异常,说明AKT在调节血糖方面有着重要的作用。根据本次实验结果可见,G组PI3K/AKT的表达均明显低于N组,该结果与师林等[11]和钟文等[12]研究糖尿病大鼠PI3K/AKT的表达结果是一致的。PI3K/AKT信号通路能够通过磷酸化多种底物,促进胰岛β细胞的生长、增殖并抑制胰岛β细胞凋亡[13],而患糖尿病的大鼠PI3K/AKT表达水平下降,可能是由于大鼠患糖尿病后,因胰岛素抵抗,导致胰岛素不能与胰岛素受体正常结合,胰岛素受体底物不能被正常激活,从而使其下游信号分子的级联反应受到了抑制,而PI3K/AKT正是重要的胰岛素受体底物,因此其表达受到了抑制。
GSK-3β是一种多功能的丝氨酸/苏氨酸蛋白激酶,有研究证实GSK-3β活性增强可致糖尿病动物产生不利后果[14]。本次实验中,G组GSK-3β表达水平显著高于N组,该结果与刘冬恋等[15]研究2型糖尿病大鼠骨骼肌GSK-3β表达的结果是一致的。胰岛素分泌不足是2型糖尿病的典型症状,在正常情况下,胰岛素可以通过磷酸化GSK-3β使其失活,过度表达的GSK-3β则可以通过抑制葡萄糖的生物活性,从而降低肌糖原的合成,导致GLU水平升高。通过观察L组GLU及GSK-3β表达水平进一步证实了,GLU水平可能受到GSK-3β的调节,这一结果与唐皓月等[16]通过对糖尿病的动物使用GSK-3β抑制剂,使得GLU水平降低相符合,提示GSK-3β表达水平与GLU水平呈正相关趋势。L组通过使用PI3K/AKT信号通路抑制剂使GKS-3β表达水平上升提示,PI3K/AKT信号通路对GLU水平的影响很可能与GSK-3β有关,并且二者呈负相关趋势。
综上所述,糖尿病的发生与PI3K/AKT通路受损具有密切的关系,其机制很有可能与GSK-3β有关。因此,进一步研究PI3K/AKT信号通路在糖尿病发病中的作用及机制,能够为糖尿病的治疗提供更多有价值的依据。
