MYO1D对自噬溶酶体生成机制的研究
2020-09-29冯学召伊力亚斯艾萨雷秀英古丽努尔阿不力米提
冯学召, 伊力亚斯·艾萨, 雷秀英, 陈 倩, 古丽努尔·阿不力米提, 米 娜
(新疆医科大学1基础医学院生物化学教研室, 2药学院药理学教研室, 3第一附属医院临床医学研究院, 乌鲁木齐 830011)
自噬是真核细胞中相对保守的生命过程,通过双层膜结构包裹细胞内待降解的物质形成自噬体。自噬体外膜与溶酶体膜融合形成自噬溶酶体,并降解内容物,供细胞物质循环再利用[1]。自噬溶酶体的形成机制受多种因素的影响,如促进突触融合蛋白质17 (syntaxin 17, STX17)与自噬体相关蛋白质相互作用,精确调控同型融合与蛋白分选复合体(homotypic fusion and protein sorting, HOPS)向自噬体的募集,促进与溶酶体融合,从而形成自噬溶酶体[2]。然而,在自噬体与溶酶体融合过程中,自噬体是如何运输到溶酶体的机制尚不完全清楚。肌球蛋白同细胞骨架共同维持细胞的正常生命活动,对囊泡、蛋白复合体、细胞膜等特殊物质进行分类、转运和分配过程中具有重要的作用[3-5]。肌球蛋白1D(myosin1d, MYO1D)是一类广泛表达的肌球蛋白,调控细胞内相关膜泡的运输及器官的发育[6]。在细胞内,MYO1D运输囊泡在肌动蛋白(actin)富集区[7],MYO1D与膜泡结合后,可以将膜泡从细胞膜向细胞胞质膜进行运输,或与肌动蛋白纤维丝相互作用促进膜泡运输[8]。为探究MYO1D对自噬体膜泡的运输以及自噬溶酶体的形成是否有影响,本研究拟通过分子生物等技术方法,获得实验数据并分析MYO1D在自噬溶酶体形成中的作用。
1 材料与方法
1.1 仪器与试剂CO2细胞培养箱(美国,New Brunswick GALAXY 170R);生物安全柜(美国,Thermo scientific KS 18公司);激光共聚焦显微镜(日本,尼康);垂直电泳槽垂直凝胶电泳仪及相关配套设备半干式转膜仪(美国,BIO-RAD 公司);高速低温离心机(美国,Sigma公司);anti-LC3、anti-P62、anti-Lamp-1一抗(日本,MBL 公司);β-actin一抗(美国,Sigma-Aldrich 公司);anti- Myosin 1D一抗(美国,Santa Cruze试剂公司);辣根过氧化物酶(horseradish peroxidase, HRP)标记的二抗(美国, Southern Bioteh公司);Lyso-Tracker Red荧光探针与Alexa Fluor荧光标记的二抗(美国,Thermo Fisher Scientific公司);VigoFect试剂(北京,威格拉斯生物技术有限公司);无内毒素质粒中量提取试剂盒(北京,康为世纪生物科技有限公司);DMEM培养基(美国,Gibco公司);胎牛血清、磷酸缓冲盐溶液(phosphate buffer saline,PBS)(美国,Hyclone);MYO1D-grna,PX459M质粒(上海,生物工程(上海)有限责任公司);大鼠肾上皮细胞(normal rat kidney ,NRK)、绿色荧光蛋白-红色荧光蛋白-微管相关蛋白1轻链3(green fluorescent protein-red fluorescent protein-microtubule associated protein 1 light chain 3,GFP-RFP-LC3)质粒由清华大学俞立课题组赠与。
1.2 实验方法
1.2.1 细胞培养 复苏细胞,配制含10%胎牛血清、100 U/mL青霉素/链霉素、1%谷氨酰胺的高糖完全培养基,并置于37℃,5% CO2培养箱中进行培养。当培养皿中细胞的汇合率达到95%时,细胞以1∶3~1∶4的比例进行传代培养。
1.2.2 免疫荧光实验 将大鼠肾上皮细胞(normal rat kidney,NRK)以3×105个/mL密度接种于六孔板中制作爬片,饥饿处理2、4 h,PBS冲洗1次,加入4%多聚甲醛室温固定15 min,0.1%皂素打孔10 min,山羊血清室温封闭30 min,一抗室温孵育1 h, PBS冲洗4次;二抗室温避光孵育1 h,PBS冲洗3次;封片,激光共聚焦显微镜下观察并拍照记录自噬体标志性蛋白微管相关蛋白1轻链3(microtubule associated protein 1 light Chain 3, LC3)与肌球蛋白1D(myosin1d, MYO1D)的共定位关系。
1.2.3 MYO1D敲除细胞的建立 取正常培养状态良好的NRK细胞,采用CRISPR-Cas9技术电穿孔法将MYO1D-gRNA与PX459M质粒进行共转染。转染24 h后,加入嘌呤霉素1 μg/μL进行筛选,连续用药直至长出单个细胞克隆,扩大培养。免疫印迹检测正常培养的MYO1D基因未敲除组,即NC组(non-specific control, NC)与MYO1D基因敲除组,即KO组(Myosin1d knockout, KO)中MYO1D的表达水平,以备后续实验。
1.2.4 蛋白质免疫印迹 取对数生长期NRK细胞以3×105个/mL的密度均匀接种于六孔板,培养14 h后,PBS冲洗3次,DPBS分别饥饿处理2、4 h。随后,弃掉培养基,PBS冲洗1次,加入十二烷基磺酸钠蛋白裂解液,100℃变性15 min,在12%SDS-PAGE上进行电泳,半干转法将蛋白转至醋酸纤维素膜上,5%脱脂牛奶室温封闭1 h,室温孵育抗体1 h,采用电化学发光法(electrochemiluminescence, ECL)进行X-线片显影。两组细胞经DMEM培养基中饥饿处理4 h后采用免疫荧光技术检测内源性LC3与溶酶体关联膜蛋白1 (lysosomal associated membrane protein 1, LAMP1),通过图片合并(Merge)观察两者共定位关系,荧光拟合度分析其定位程度。化学发光法检测两组细胞自噬底物蛋白P62(p62/sequestosom-1,p62)的表达水平。
1.2.5 Lyso-tracker Red检测 将NRK细胞按1×105个/mL密度均匀接种至四孔玻底培养皿中培养12 h后,PBS冲洗1次,加入含1 mg/mL Lyso-Tracker Red探针的完全培养基对两组溶酶体进行特异性染色,培养箱中避光孵育20 min,PBS冲洗3次,在激光共聚焦显微镜下观察溶酶体活性的变化并对荧光灰度值进行分析。
1.2.6 GFP-RFP-LC3转染实验 细胞汇合率达到50%~60%时,VigoFect试剂转染GFP-RFP-LC3质粒至两组细胞,置于37℃、5% CO2培养箱中培养12~18 h,DMEM培养基中饥饿处理4 h,激光共聚焦显微镜下观察自噬溶酶体比例的变化。
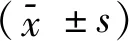
2 结果
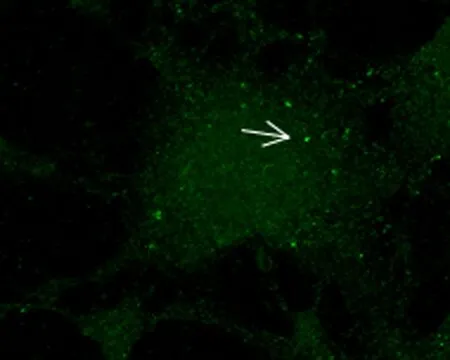
2.1 MYO1D与自噬体LC3的定位关系激光共聚焦显微镜下观察结果显示,MYO1D与LC3具有显著的共定位关系,见图1。
绿色点标记MYO1D

红色点标记LC3
黄色点标记MYO1D与LC3的共定位
2.2 MYO1D基因敲除细胞的建立采用CRISPR-Cas9技术,对NRK细胞中的MYO1D基因进行敲除。结果显示,NRK细胞中MYO1D基因被成功敲除,见图2。
2.3 MYO1D对自噬溶酶体的形成及P62蛋白质表达水平的影响与NC组比较,KO组LC3与LAMP1共定位程度显著减少,荧光拟合程度降低,见图3、4。与NC组比较,KO组P62蛋白质的表达水平显著升高,差异具有统计学意义(P<0.01),见表1。
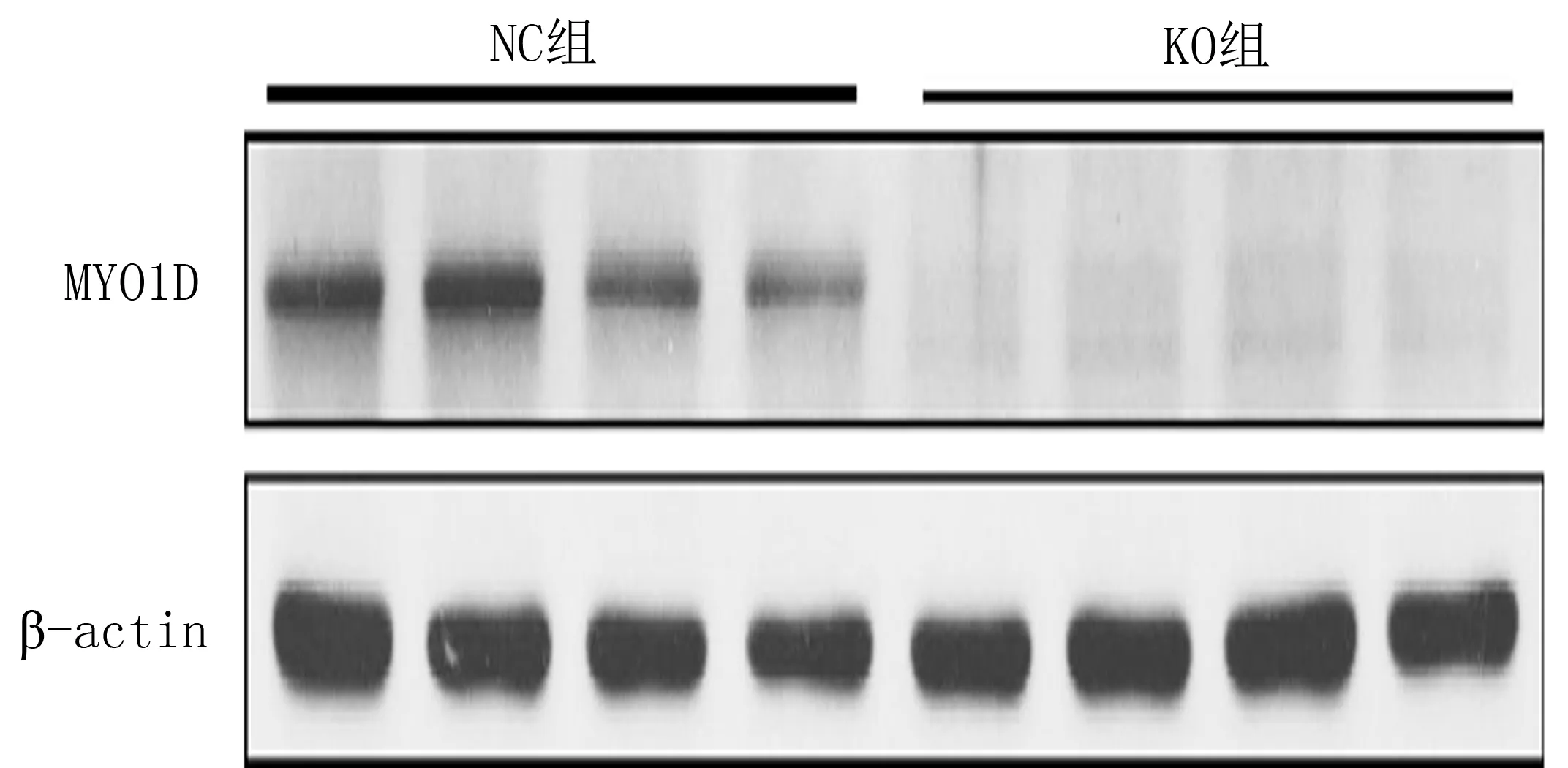
图2 MYO1D基因敲除细胞的建立
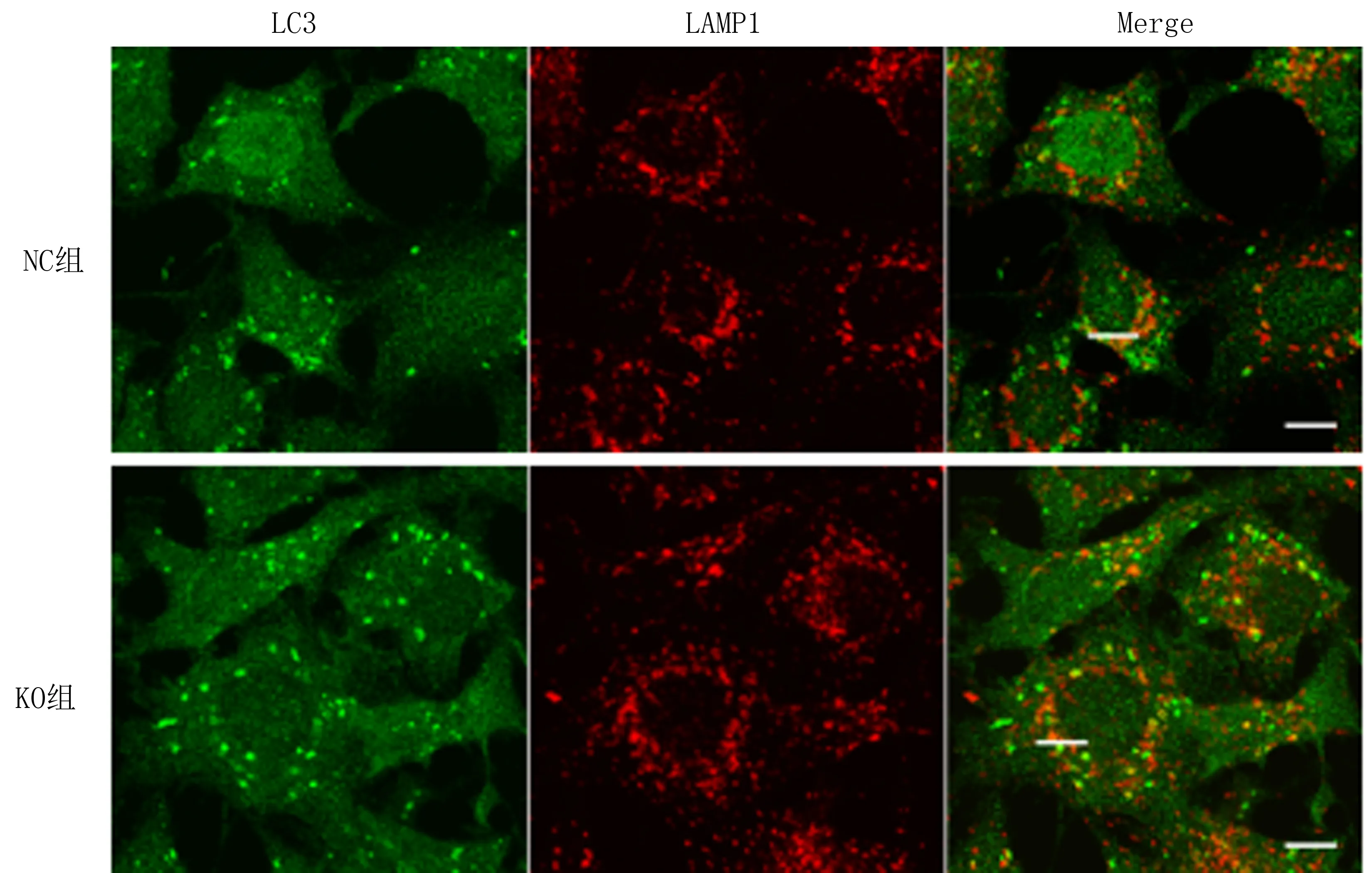
图3 两组细胞LC3与LAMP1的共定位关系(×600)
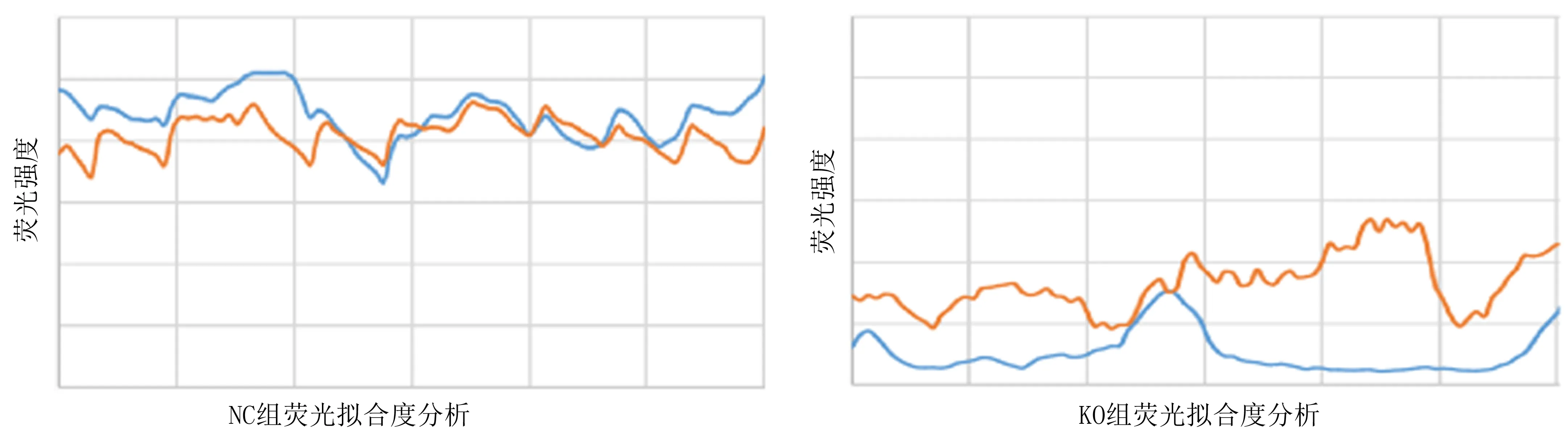
图4 两组细胞荧光拟合度分析
2.4 MYO1D对自噬溶酶体的形成及对溶酶体活性的影响两组细胞中转染GFP-RFP-LC3质粒结果显示,与NC组比较KO组内绿色荧光与红色荧光共同标记的自噬体比例升高,见图5。饥饿处理2、4 h后显示,与NC组比较KO组溶酶体活性未被抑制,反之呈增高趋势,MYO1D基因敲除未影响溶酶体活性,差异具有统计学意义(P<0.05),见表2。
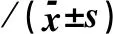
表1 两组细胞P62蛋白质表达水平的比较
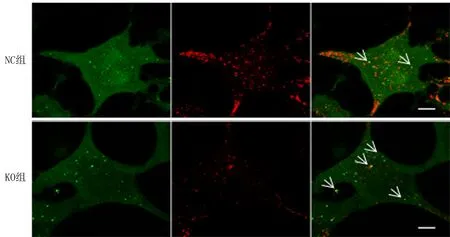
注:绿色、黄色标记点为自噬体,红色标记点为自噬溶酶体。
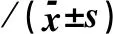
表2 两组细胞溶酶体活性荧光灰度值分析
3 讨论
自噬溶酶体的形成是细胞自噬的重要阶段,在细胞自噬中起到关键作用,若自噬溶酶体的形成受到障碍则会导致帕金森[9]、阿尔兹海默症[10]及神经退行性疾病[11]。自噬体与溶酶体的融合需要如HOPS蛋白质复合体在自噬体与溶酶体靠近后促进两膜的融合[12-13],同时自噬体与溶酶体的靠近也需要相关转运蛋白质的运输[14 ]。自噬体从形成并转运至溶酶体的过程中,参与运输的蛋白质与自噬体之间的相互作用对自噬体的转运起关键作用[15]。本研究通过免疫荧光检测观察到MYO1D与自噬相关蛋白LC3有显著的共定位关系,这提示MYO1D参与细胞自噬。在正常生理情况下,自噬体底物与P62结合后被自噬体包裹,再与溶酶体融合形成自噬溶酶体,并最终降解[16]。本研究通过观察MYO1D对自噬溶酶体形成的影响发现,与NC组比较KO组自噬溶酶体形成减少,P62表达水平显著升高,即MYO1D蛋白参与自噬并抑制自噬过程。而MYO1D敲除引起自噬溶酶体的减少,P62表达水平升高可能是由于MYO1D敲除影响了溶酶体的活性,导致自噬过程的减弱以及自噬溶酶体数量的减少。Lyso-Tracker red荧光探针观察溶酶体活性检测[17]结果显示,KO组溶酶体活并未受到影响。转染GFP-RFP-LC3质粒结果表明,MYO1D影响了自噬溶酶体的形成,这与前实验结果相一致。可以认为MYO1D可能是影响自噬体的运输以及与溶酶体融合形成自噬溶酶体的关键蛋白。而MYO1D关键的结构域参与自噬溶酶体的形成,具体的调节机制需要进一步研究。
