羊源大肠杆菌对氨基糖苷类药物耐药表型及耐药基因的检测
2020-09-25顾晓晓陶乔孝慈韩猛立吴桐忠张星星钟发刚
顾晓晓,邬 琴,陶乔孝慈,马 雪,李 劼,周 霞*,韩猛立,黄 新,吴桐忠,张星星,钟发刚
(1.石河子大学 动物科技学院,新疆 石河子 832003; 2.新疆农垦科学院 省部共建绵羊遗传改良与健康养殖国家重点实验室,新疆 石河子 832000)
大肠杆菌是一种重要的人畜共患病病原,可分为3大类群:共生型大肠杆菌、肠内致病型大肠杆菌和肠外致病型大肠杆菌[1]。大肠杆菌可引起多种动物的感染,严重的耐药性则是该病难以控制的重要原因之一。随着临床大肠杆菌感染的普遍性,分离株的耐药性也变得更加复杂。MADOSHI等[2]从坦桑尼亚健康牛及其服务人员中分离的大肠杆菌对四环素、磺胺甲唑-甲氧苄啶和氨苄西林高度耐药,且多重耐药性比较严重。HO等[3]采集了香港地区2004-2010年期间医院病人的血液,分离的188株大肠杆菌均对庆大霉素耐药,且耐药率逐年增加。FLADBERG等[4]分析结果显示,2011-2015年来自血液的1 475株大肠杆菌,6.9%对庆大霉素耐药,6.8% 对第3代头孢菌素耐药,3.1%对这2种药物具有共同耐药性。氨基糖苷类药物是一种常见的临床使用药物,其耐药机制主要是细菌细胞膜通透性改变和外排泵系统外排能力的增强,导致进入细胞内的药物浓度降低,产生耐药性,同时产生修饰酶,降低氨基糖苷类药物的活性,或者改变细菌作用靶位,不能与核糖体结合而导致耐药[5]。研究表明,来自健康动物的大肠杆菌也表现部分耐药特性[6],而健康羊群肠道是大肠杆菌的最大贮存库,大肠杆菌的这些特点可以通过食物链和直接接触进行传递,给人类带来潜在的威胁。新疆维吾尔自治区羊大肠杆菌病的日益普遍,调查和分析健康羊源大肠杆菌的耐药性及耐药基因携带情况,可为羊致病性大肠杆菌耐药机制的研究提供基础数据。
1 材料与方法
1.1 粪便来源石河子地区部分羊场阿勒泰羊、新疆细毛羊、哈萨克健康羊粪便;大肠杆菌质控菌株ATCC25922购自中国兽药监察所。
1.2 药物及主要试剂麦康凯等培养基购自北京奥博星生物技术有限责任公司;Taq酶、dNTP、10×PCR buffer、DL2000 DNA Marker均为TaKaRa公司产品;试验中所使用的16S rRNA通用引物、耐药基因引物和片段测序均由北京睿博兴科生物技术有限公司完成;5种药敏纸片购于杭州微生物试剂有限公司。
1.3 细菌的分离与鉴定将无菌收集的粪便进行碾磨稀释,分别接种LB肉汤、麦康凯培养平板和LB平板,温育24 h后观察菌落特征;挑取疑似菌落涂片,革兰染色镜检并进行生化鉴定。生化试验包括MR、VP和各种糖培养基等。应用大肠杆菌16S rRNA通用引物进行PCR扩增反应,并对扩增产物进行测序和同源性分析。
1.4 分离株氨基糖苷类抗生素耐药表型检测参照文献[7]操作和判定标准进行。药敏纸片包括链霉素(STR)、新霉素(N)、妥布霉素(TOB)、庆大霉素(GEN)、卡那霉素(KAN)。
1.5 细菌耐药基因的PCR检测根据文献[8-12]进行引物的合成,引物信息见表1。提取细菌总DNA[13]进行PCR扩增。
2 结果
2.1 细菌的分离及生化鉴定进行细菌的常规分离鉴定,结果显示分离菌在麦康凯培养基上长出红色、圆润、稍凸起、边缘光滑的菌落。在LB培养基上长出乳白色、圆润、稍凸起、边缘光滑的小菌落。革兰染色后,显微镜下观察为短小、两端钝圆的革兰阴性杆菌,与大肠杆菌的形态和染色特点一致。分离细菌生化反应特点与大肠杆菌结果也一致。
2.2 分离细菌16S rRNA序列鉴定分析结果细菌16S rRNA扩增得到了与预期一致1 500 bp左右的目的条带(图1)。测序结果与大肠杆菌相应序列相似度为99%以上(图2)。
2.3 药敏试验结果100株大肠杆菌对5种药物的敏感性试验结果显示,对链霉素的耐药率最高,为24%;其次是新霉素、丁胺卡那、庆大霉素和卡那霉素,分别为21%,14%,13%,7%(表2)。其中,抗1种药物的菌株有18株,占18%;抗2种药物的菌株有9株,占9%;抗3种药9株,占9%;抗4种药物的菌株有4株,占4%。耐药菌株占总菌株的40%。
2.4 耐药基因检测结果在检测的AadB、AadA1、Aac(3′)-Ⅱ、Aac(6′)-Ib和Aph(3′)-I等5种相关耐药基因中,98%(98/100)菌株检测到了与AadA1基因预期大小499 bp一致的片段(图3),89%(89/100)菌株检测到与Aph(3′)-Ⅰ基因预期大小612 bp一致的片段(图4),未检测到AadB、Aac(3′)-Ⅱ和Aac(6′)-Ⅰb基因片段。其中,携带1种氨基糖苷类药物耐药基因的大肠杆菌有13株,占13%;携带2种氨基糖苷类药物耐药基因的大肠杆菌有87株,占87%(表3)。
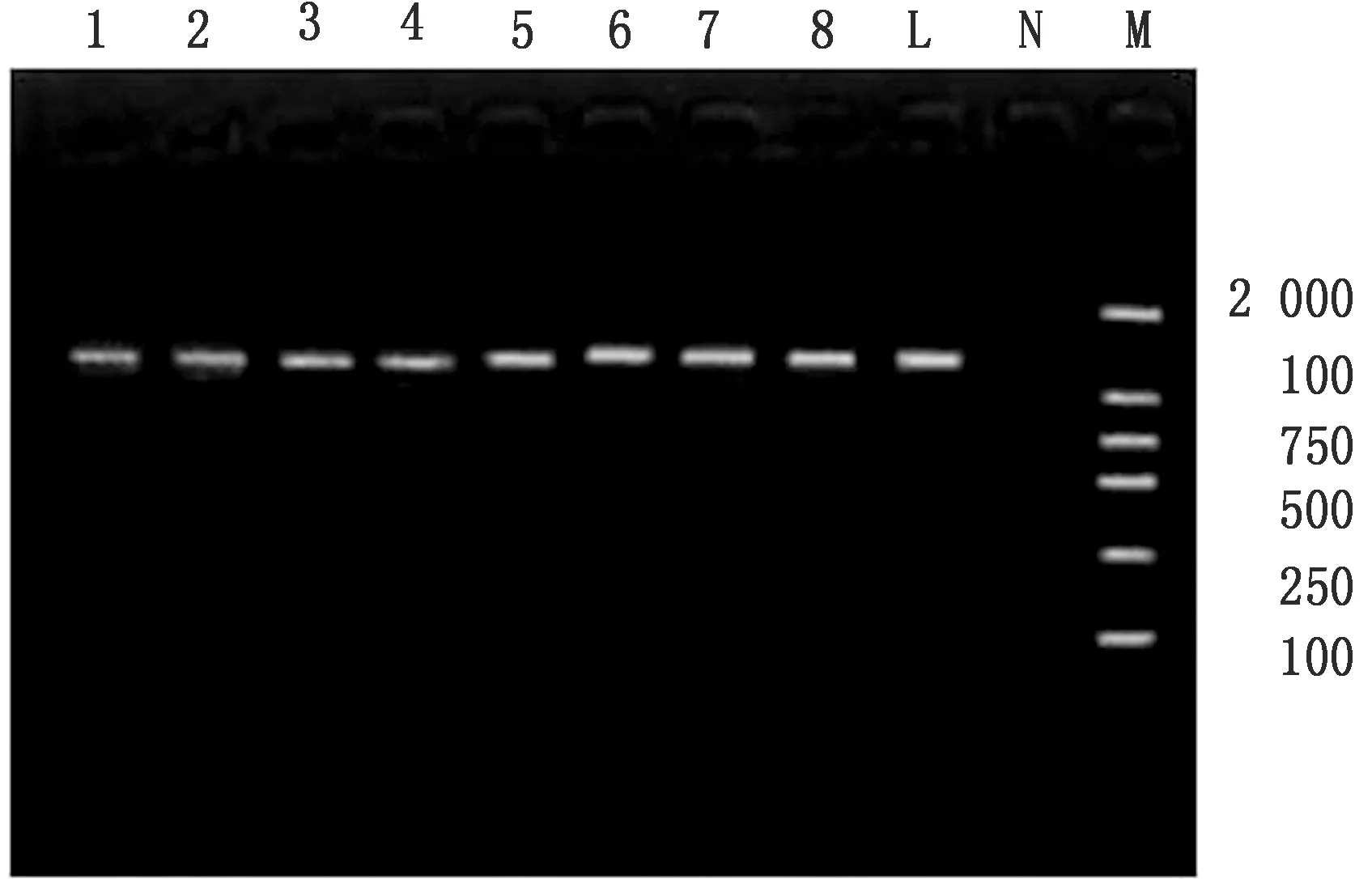
图1 细菌16S rRNA PCR扩增结果 M.DL2000 DNA Marker;N.阴性对照;L.阳性对照(1 500 bp);1~8.8株大肠杆菌
图2 同源性分析结果
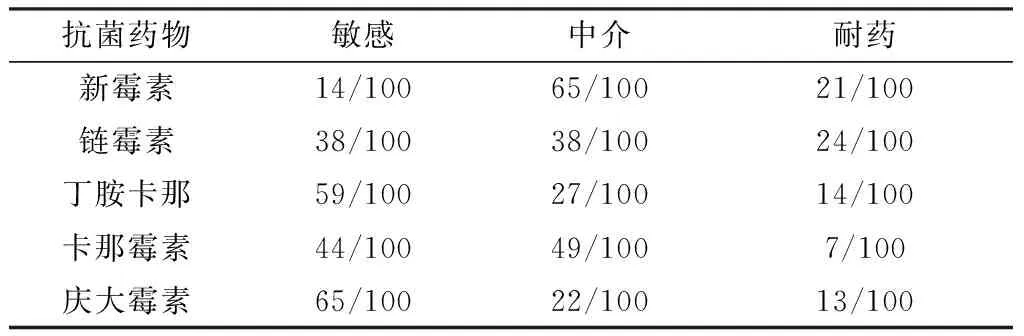
表2 100株羊源大肠杆菌对5种氨基糖苷类药物的耐药情况

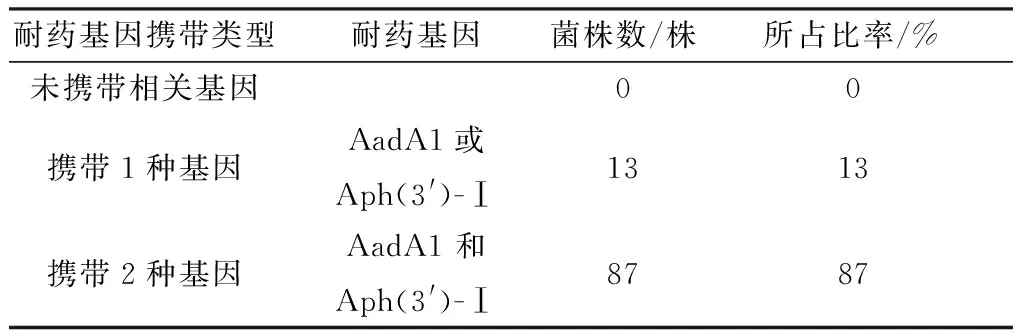
表3 100株大肠杆菌氨基糖苷类药物2种耐药基因检测结果
3 讨论
氨基糖苷药物是一类主要用于治疗多种细菌感染的抗生素[14]。然而,现代医学还发现了这些药物的其他用途,包括治疗各种遗传性疾病和梅尼埃病[15]。第一种氨基糖苷类链霉素是在抗生素时代(1944年)早期发现的,现在仍然在使用;随后发现了新霉素(1949年)、卡那霉素(1957年)和庆大霉素[16],以及具有强烈活性的其他天然氨基糖苷类如妥布霉素。此外,还发现了抗真菌和抗寄生虫的药物。例如,巴龙霉素可用于治疗隐孢子虫病、利什曼病以及由原生动物和绦虫引起的其他感染。本试验选取5种临床常用的氨基糖苷类抗菌药物新霉素、链霉素、丁胺卡那、卡那霉素和庆大霉素,其耐药率分别为24%,21%,14%,13%,7%,低于姜德相等[17]报道的吉林省羊源致病性大肠杆菌对新霉素(57.1%)、丁胺卡那霉素(50.0%)和庆大霉素(67.9%)的耐药率,同时低于ROSENGREN等[18]报道的健康猪源大肠杆菌对链霉素(33.4%)的耐药率,但高于其报道的丁胺卡那(0.0%)、卡那霉素(9.3%)以及庆大霉素(0.8%)的耐药率,可见健康动物大肠杆菌比致病性大肠杆菌对氨基糖苷类药物的耐药水平低。细菌对本类药物易产生耐药性,本试验中分离的菌株,有44%为耐药菌株,多重耐药率为11%,3耐及以下占40%,多药耐药情况较普遍,这与夏利宁等[19]报道的新疆羊源大肠杆菌的结果相似。由此可见不同地区的大肠杆菌对药物的耐药情况是存在差异的,其差异可能与地区间用药的不同、菌群的差异以及耐药基因之间的传递存在着一些联系。
氨基糖苷修饰酶催化分子的乙酰化(氨基糖苷乙酰转移酶,AAC)、磷酸化(氨基糖苷磷酸转移酶,APH)或腺嘌呤酰化(氨基糖苷核苷酸转移酶,Ant)失活,是耐药性快速增加和传播的主要原因[20]。大肠杆菌耐氨基糖苷类抗菌药物的主要机制为产生修饰酶。本试验中选取了5种编码氨基糖苷修饰酶的相关基因AadB、AadA1、Aac(3′)-Ⅱ、Aac(6′)-Ⅰb和Aph(3′)-Ⅰ,其中AadA1的检出率最高(98%),与汤景元等[21]对氨基糖苷类药物耐药基因型调查相似。可见,耐药基因不仅在致病性大肠杆菌中而且在非致病性大肠杆菌中都具有较高的携带率,并且在动物群中传播的可能性更高。Aph(3′)-Ⅰ的检出率为89%,本试验未检测到AadB、Aac(6′)-Ⅰb和Aac(3′)-Ⅱ等3种基因,结果与汪小强[22]和于学辉等[23]对致病性大肠杆菌的研究结果相似,即非致病性与致病性大肠杆菌对这3种耐药基因的携带率相对较低。本试验分离的大肠杆菌的耐药谱型主要以AadA1和Aph(3′)-Ⅰ(87%)为主,经过对试验菌株耐药谱型和耐药基因之间比对发现,携带同一耐药基因大肠杆菌的耐药表型并不相同,其中AadA1耐药基因的携带率为98%(98/100),而被检大肠杆菌菌株对氨基糖苷类药物耐药率为44%(44/100),耐药率低于AadA1基因的携带率,这可能与基因的表达状态有关。同时这些菌株携带的耐药基因只是介导低水平耐药,而高度耐药则需要与其他耐药机制如染色体介导、靶位改变及主动外排等共同发挥作用。
