捻转血矛线虫与胃癌细胞共培养系统建立
2020-09-25张红丽周静茹陈学秋杜爱芳
杨 怡,张红丽,周静茹,陈学秋,杜爱芳*
(1.浙江大学 动物科学学院 动物预防医学研究所 浙江省动物预防医学重点实验室,浙江 杭州 310058;2.浙江省动物疫病预防控制中心,浙江 杭州 311199)
捻转血矛线虫能寄生于反刍动物皱胃引起严重的捻转血矛线虫病,偶尔也见于人和鼠等非适宜宿主[1-4]。该病的高发严重威胁着国内外畜牧业的发展,目前防治主要依赖于化学驱虫药物的使用。然而耐药性的产生和有效疫苗的缺乏给防治工作带来了新的困难,发展免疫学防治方法十分迫切[5-6]。探明宿主针对捻转血矛线虫的免疫应答规律是发展免疫防治的重要研究方向。
宿主能依赖Th2型保护性免疫力将感染的捻转血矛线虫清除于体外[7]。捻转血矛线虫被吞食后进入寄生阶段,与宿主首先发生免疫关系的部位是皱胃细胞。线虫钻入胃壁吸食宿主营养,而胃组织急于通知宿主排出入侵的异物,此时宿主产生早期免疫应答。完整的早期免疫应答可以帮助宿主尽快建立保护性免疫力。线虫入侵引起胃组织局部病理反应,包括形成多核巨细胞包围坏死灶的肉芽肿、淋巴细胞和浆细胞浸润包围胃腺等。这些病理反应的发生对宿主后续的免疫应答有很重要的诱导作用。被攻击受损的胃组织会发出危险信号警报因子如IL-33,通知机体迅速产生保护性免疫力,将线虫快速清除[8]。据报道,胃组织及其附属淋巴结应对感染的保护性免疫力,如分泌IL-5等细胞因子、诱发嗜酸粒细胞等聚集、促使杯状细胞分泌更多黏液等[9-10]。
目前,针对早期免疫应答的研究多在感染动物体内进行,胃组织的状态不能实时观察记录,且需基于动物的大量牺牲,样品的采集、观察和处理都不方便[11]。现阶段的体外培养技术仅使用培养基可使捻转血矛线虫三期幼虫人工脱鞘后生长至四期幼虫或成虫产卵阶段,但产出的卵不能孵化,也不能完成整个生活史[12-13]。体外培养得到的四期幼虫早期能在特殊培养液中存活数周,即可以达到宿主体内早期免疫应答期间的线虫生长状态[14]。因此,为了使用方便的体外感染模型探明宿主对捻转血矛线虫的早期免疫反应,本试验建立了捻转血矛线虫与胃癌细胞共培养模型,并在此基础上研究了线虫与胃癌细胞的相互作用。
1 材料与方法
1.1 主要试剂及试验动物NaClO,Cell Trace Far Red DDAO-SE dye(Invitrogen);Annexin V/PI apoptosis kit(Multisciences);Apoptosis Positive Control Solution(Multisciences);SYBR Green Realtime PCR Master Mix(Toyobo);100×青-链霉素(Solarbio);两性霉素B(Solarbio);Transwell Insert六孔板(Corning);大鼠购于浙江省实验动物中心。
1.2 细胞培养MGC-803和BGC-823由浙江大学医学院周天华教授实验室惠赠,MGC-803为人胃癌细胞,BGC-823为人胃腺癌细胞,以下简称MGC和BGC;使用含10%FCS的RPMI1640培养液,于37℃、5%CO2培养箱中进行培养传代。
1.3 捻转血矛线虫三期幼虫脱鞘共培养系统中使用的三期幼虫需脱鞘,方法:将NaClO加至混有5 000条L3的1 mL水中,使其终浓度为0.2%,室温下轻轻晃动约20 min;在解剖镜下观察脱鞘效率达90%以上,立刻转移至离心管,10 000 r/min 离心1 min;吸去上清,加1 mL ddH2O重悬虫体,10 000 r/min 离心1 min;吸去上清,如此重复3次。在超净台内加 1 mL线虫-细胞共培养营养液重悬虫体,置于37℃待用。线虫-细胞共培养营养液为含10%FCS、1% 100×青-链霉素、2 mg/L两性霉素B的RPMI1640培养液。
1.4 气液界面共培养系统的建立共培养系统建立方法:在Transwell Insert六孔板的滤膜表面平铺200 μL鼠胶原,置于超净台过夜风干;每孔滤膜上加入106个细胞,滤膜外加入700 μL 线虫-细胞共培养营养液,过夜培养(图1);吸去滤膜上培养液,每孔加入200 μL虫体混悬液,开始共培养;滤膜外的线虫-细胞共培养营养液需每天更换,培养条件均为37℃、5% CO2。
鼠胶原制备方法:取大鼠尾部洗净,置于75%酒精浸泡30 min;将尾部剪开去掉皮毛,并剪成小段,抽出其中的银色尾腱;将尾腱剪碎置于0.1%的醋酸中(0.02 g/mL),4℃溶解,不时振荡;48 h后取上清,4 000 r/min离心30 min;取上清分装,-20℃ 保存。
1.5 线虫和细胞相互作用现象的观察线虫-细胞共培养时,每天使用倒置显微镜观察线虫和细胞的生理状态,并记录比较。
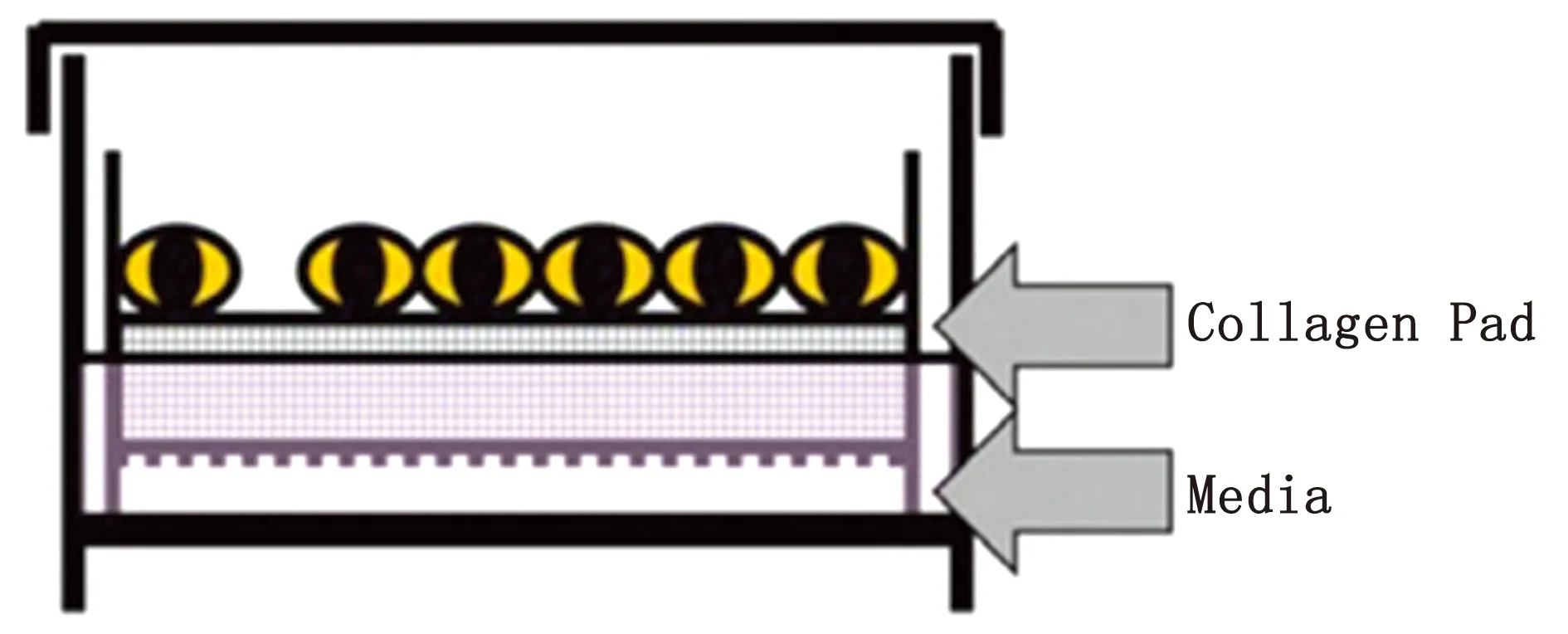
图1 线虫-细胞气液界面共培养示意图[14]
1.6 线虫食物来源试验细胞用Cell Trace Far Red DDAO-SE dye染料染色后与线虫共培养,观察线虫染色情况。方法:在Transwell Insert六孔板上加入200 μL鼠胶原,置于超净台过夜风干;12×106个细胞与染料(终浓度为24 μmol/L)在HBSS中混合于37℃、5%CO2培养箱孵育15 min,避光;200×g离心3 min,弃上清,加细胞培养液重悬;每孔滤膜上加入106个细胞,滤膜外加入700 μL 线虫-细胞共培养营养液,过夜培养;吸去滤膜上培养液,每孔加入200 μL虫体混悬液,开始共培养;滤膜外的细胞培养液需每天更换,培养条件均为37℃、5%CO2;将滤膜上的培养液吸出,400×g离心3 min,弃上清;500 μL HBSS洗涤虫体沉淀3次,400×g离心3 min;用4%多聚甲醛和2%NaN3麻醉固定虫体;400×g离心3 min,PBS重悬,吸取虫体置于2%琼脂糖平板上,在激光共聚焦显微镜590 nm LED光源下观察。
1.7 流式细胞术共培养后用Annexin V/PI apoptosis kit和流式细胞术检测线虫引起胃癌细胞凋亡或坏死的情况。操作方法:用胰酶将六孔板滤膜胶原板上的细胞消化下来,1 000 ×g离心5 min,弃上清,取105个细胞,加500 μL 1×Annexin-binding buffer洗涤重悬;加5 μL Annexin V-FITC和10 μL PI,室温下避光孵育5 min。流式细胞仪检测:激发光波长为488 nm,分别用波长为530 nm和575 nm的滤器检测荧光强度,使用软件分析。
细胞凋亡阳性对照的制备方法:取5×105个细胞,用冰PBS洗涤2次,1 000×g离心5 min;弃上清,加500 μL Positive Control Solution,于冰上孵育30 min;1 000×g离心5 min,弃上清,用冰PBS洗涤后收集细胞,使用Annexin V/PI apoptosis kit进行荧光染色。
判断方法:活细胞为FITC-/PI-,凋亡细胞为FITC+/PI-,坏死细胞为PI+。
1.8 荧光定量RT-PCR检测细胞因子表达量变化常规方法提取羊T淋巴细胞和胃癌细胞的RNA并反转录,利用荧光定量RT-PCR方法检测羊感染或线虫-细胞共培养前后IL-33的表达量。IL-33及β-actin特异性引物序列见表1。

表1 IL-33及beta-actin特异性引物序列
1.9 数据统计与分析细胞因子表达量和虫体长度的表示方法为平均值±标准差,各组间的差异比较使用单向方差分析。
2 结果
2.1 捻转血矛线虫的生活方式线虫-细胞共培养系统中,捻转血矛线虫呈现弦运动和圆运动2种生活状态(图2)。
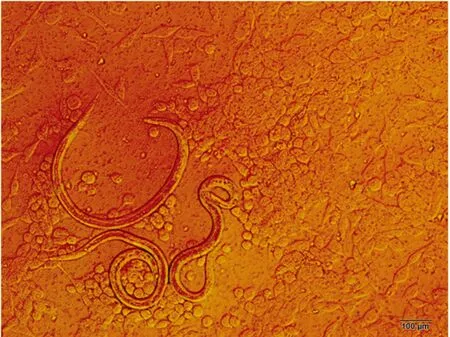
图2 捻转血矛线虫的生活方式(线虫-MGC共培养系统)
2.2 线虫的食物来源将胃癌细胞用远红外荧光染料进行染色后与线虫共培养,发现线虫肠道中布满红色荧光(图3),说明线虫在共培养系统中会进食细胞蛋白。线虫肠道与生殖道相互捻转,因此肠道中的红色荧光呈现左右交错的状态。
2.3 线虫的形态特征捻转血矛线虫与细胞共培养0,4,7 d时的虫体长度分别为(981.5±24.3),(1 113.9±24.4),(1 157.0±47.6) μm,说明捻转血矛线虫在共培养系统中能够生长,但是后期生长速度非常缓慢或是基本不生长。
2.4 线虫和细胞的生理状态以线虫-BGC共培养系统为例,随着共培养时间的增加,捻转血矛线虫活力逐渐下降,扭动频率降低,呈现蜷缩状的虫体数量增多;贴壁细胞渐渐脱落,培养后期可见部分区域细胞几乎完全脱落(图4)。线虫-MGC共培养系统中呈现相似的现象,这说明捻转血矛线虫和胃癌细胞之间互相具有伤害或是胁迫作用。
2.5 细胞状态的检测MGC和BGC的流式细胞术分析结果显示(图5),相比较于共培养0 d,共培养4 d时MGC坏死(PI+)的比例由12.91%增加到53.25%,BGC坏死的比例由2.63%增加到24.81%,而MGC和BGC都没有大量的凋亡,这说明捻转血矛线虫的存在倾向于诱发细胞的坏死而不是凋亡。
2.6 细胞中IL-33的表达量变化捻转血矛线虫感染3 d时羊T淋巴细胞中IL-33的表达量上升至感染0 d时的7.022倍;MGC与线虫共培养4,7 d 时IL-33的表达量分别上升至共培养0 d时的2.520,4.180倍;BGC与线虫共培养4,7 d时IL-33的表达量分别上升至共培养0 d时的1.732,5.150倍(图6)。IL-33的表达量在捻转血矛线虫感染羊体内和共培养细胞内均显著升高,表明其在宿主早期免疫应答过程中起重要作用。

图3 共培养4 d时捻转血矛线虫进食胃癌细胞的状态 A~C.细胞为MGC;D~F.细胞为BGC
3 讨论
捻转血矛线虫感染宿主后,在皱胃进行寄生,寄生环境为微氧的三维气液界面黏膜隐窝,因此体外共培养系统模拟体内寄生环境构造5%CO2气液界面细胞小室,以期真实地反映体内感染免疫应答状态。国内外学者对其他线虫体外细胞共培养方法的探索也较多[15-21],且共培养模型均能较好地模拟早期免疫应答。
捻转血矛线虫在共培养系统中呈现弦运动和圆运动2种运动方式,这反映了其在宿主胃组织中的生存状态。线虫在胃部的弦运动有助于爬行较远的距离,而圆运动则有助于虫体修建“隧道”钻入胃隐窝进行寄生。进行弦运动的线虫四处游走于细胞,进行圆运动的线虫在局部不断挤压细胞,可能造成细胞无法正常贴壁,出现局部的光秃现象。捻转血矛线虫与细胞共培养能导致细胞的坏死,可能是因为虫体进食或运动破坏了细胞质膜的完整性,还可能是由于线虫分泌的毒害物质对细胞造成了损伤引起坏死。
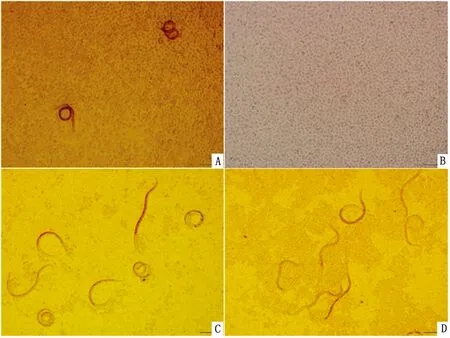
图4 捻转血矛线虫和BGC的生理状态(比例尺大小为50 μm) A.共培养0 d;B.共培养4 d;C.细胞单独培养4 d;D.共培养7 d

图6 共培养系统细胞中IL-33的表达量 *示P<0.05
Cell Trace Far Red DDAO-SE dye染料是一种超长期细胞示踪剂,用于对细胞进行荧光染色,观察线虫的食物来源。线虫与染色细胞共培养后肠道中也出现了远红外荧光,可以判断共培养过程中线虫吸食摄取了胃癌细胞组分,充足的食物来源给线虫提供了生长发育所必需的营养物质。共培养系统中的线虫能随着培养时间的增加而长大,但其生长速度比在宿主体内慢,与细胞共培养7 d时的虫体长度约与羊体内感染4 d的相似,即能发育至四期早期幼虫阶段。
随着线虫-细胞共培养时间的增加,细胞开始表达大量的IL-33。绵羊T淋巴细胞也能在捻转血矛线虫感染宿主后提高IL-33的表达量。捻转血矛线虫能在胃部建立隧道,体外共培养系统也显示线虫能进食细胞,因此胃部细胞的死亡可能诱发了IL-33的表达。IL-33是一种警报因子,能在体外与IL1RL1细胞表面受体结合,激活胞内的NF-B和MAP激酶,诱导极化T细胞中Th2细胞因子的产生;体内试验发现IL-33能诱导IL-4、IL-5和IL-13的表达[8]。具有胃肠道线虫抗性的绵羊在感染蛇形毛圆线虫14 d时,空肠中IL-33的表达量增加了近30倍[15]。BALB/c小鼠感染鞭虫后3 d开始在盲肠组织中表达IL-33[22]。鞭虫易感的AKR小鼠在接受外源IL-33蛋白后能被诱导排出感染的虫体,这可能是由于IL-33诱发的Th2细胞因子抑制了不适当的寄生虫特异Th1极化反应[22]。这样看来,宿主能在胃肠道线虫感染后提高体内的IL-33表达量抵抗寄生虫。
基于共培养系统和体内感染时捻转血矛线虫生活习性、营养来源和生长发育的高度相似性,本试验建立的线虫-细胞气液界面共培养系统可以为研究线虫与宿主的早期感染状态提供新的体外培养模型。该系统与体内感染模型相比有许多优点,如可以观察细胞与线虫的实时状态、细胞与线虫作用条件的方便操控等。共培养系统中使用了人类胃癌细胞,是基于捻转血矛线虫也可以偶见于人类的感染[2],且MGC和BGC的强贴壁能力和易培养性也能保证共培养系统中细胞的稳定性。与单纯使用培养基进行体外培养相比,共培养系统能较真实地反映线虫感染宿主后的早期发育及免疫应答,而前者仅能实现线虫发育状态的观察。目前该培养系统的其中一个不足之处是只进行到共培养7 d的观察研究,后期还将严格控制共培养系统的无菌环境,延长共培养时间,以便更完整地观察线虫发育过程,同时研究整个早期免疫应答过程。还有一个不足之处是细胞种类单一,宿主胃组织中存在多种细胞,以后的研究可以尝试多种胃细胞混养后与线虫进行共培养。
