云南省中山病毒的分离鉴定
2020-09-25孟锦昕牛保生姚萍芬朱建波李华春
朱 沛,孟锦昕,牛保生,姚萍芬,杨 恒,朱建波,肖 雷*,李华春*
(1.云南省畜牧兽医科学院 云南省热带亚热带动物病毒病重点实验室,云南 昆明650224;2.云南省师宗县动物疫病控制中心,云南 师宗 655700)
中山病毒(Chuzan virus,CHUV)[1-2]是呼肠孤病毒科环状病毒属帕利亚姆群(Palyam serogroup virus,PALV)的虫媒病毒。该病毒1985年首次从日本鹿儿岛市中山镇分离获得,故命名为CHUV[3]。CHUV是PALV的一个血清型,由于历史原因,PALV大多以首次分离地的地名来命名,所以常被误认为是不同的病毒,实际为同一病毒的不同血清型[4]。与环状病毒属的蓝舌病病毒(BTV)[5]和鹿流行性出血热病毒(EHDV)类似,CHUV基因组也分为10个节段(Segment1至Segment10),可编码7种结构蛋白(VP1~VP7)和4种非结构蛋白(NS1~NS3,NS3A)[6]。其中由Seg2编码的VP2蛋白决定了病毒的血清型,并且在不同血清型的病毒间具有高度的变异性;由Seg7编码的VP7蛋白[7]为病毒的群特异性抗原,能诱导产生群特异性抗体,其氨基酸序列在不同血清型间高度保守,但Seg7的核苷酸序列在不同地域分离到的病毒间存在一定差异,能体现出病毒的地域性。
中山病又称牛异常分娩病,是由CHUV引起的一种虫媒病毒病,易感牛,主要侵害动物的中枢神经系统,表现为积水型无脑畸形,小脑发育不全[8],妊娠期母牛感染后会导致异常生产,表现为流产、早产、死产[9],伴有新生犊牛吸乳能力丧失和神经症状。已证实中山病在日本、澳大利亚、韩国以及中国都有流行,但目前暂无中山病暴发的报道,此病一旦暴发将对养牛业造成巨大损失。我国幅员辽阔,气候多样,很多地区都适宜CHUV宿主和媒介的生长与繁衍。而此前,我国对CHUV的研究甚少。2013年,本实验室在云南省师宗县首次分离到1株CHUV(SZ/187毒株)[10];2014年张义爽等[11]从广西省马山市分离到1株CHUV(GX871毒株);2016年WANG等[12]从西藏的牦牛血液中检测出CHUV阳性;杨振兴等[13]对2016-2018年我国13个省区采集的牛羊血清调查发现,除吉林省以外的12个省区均存在中山病血清抗体阳性,表明CHUV已在我国广泛分布。
为掌握CHUV、BTV、AKV(Akabane virus)、EHDV及BEFV(bovine epizootic fever)在云南省的流行情况及遗传特征,本试验在云南省师宗、江城和芒市设立监控点,选取以上病毒血清学阴性的哨兵动物定期采血,监测其抗体转阳情况同时分离病毒。2014年,从云南省师宗监控点分离到4株PALV,经鉴定均为CHUV,研究对分离株的Seg-2及Seg-7基因进行序列分析,结果显示分离株Seg-2 基因与印度毒株的相似度最高(99.1%~99.3%),与日本及中国毒株相似度次之,而与非洲及澳洲毒株相似度最低;分离株Seg-7基因与中国大陆毒株序列相似度最高(99.7%~100%),与我国台湾地区及日本、印度毒株相似度次之,与澳洲毒株的相似度最低。本试验从云南省成功分离到4株CHUV,并报道了分离毒株Seg-2及Seg-7基因序列特征,其结果有助于掌握全国范围内CHUV的分布及流行情况,同时为进一步开展世界范围内 PALV的预防、诊断、致病性、遗传特性等研究奠定良好基础。
1 材料与方法
1.1 细胞、病毒株及主要试剂CHUV C-ELISA抗体检测试剂盒、仓鼠肾细胞(BHK-21)、蚊子细胞(C6/36)、CHUV标准株及其标准血清均由云南省畜牧兽医科学院热带亚热带动物病毒病重点实验室提供;MEM培养基购自GIBCO公司;新生牛血清购自Hyclone公司;病毒RNA抽提试剂盒、PrimeScript One Step RT-PCR试剂盒、DNA胶回收试剂盒、pMD18-T载体、E.coliDH5α感受态细胞、DNA Marker购自TaKaRa公司;琼脂糖购自Promega公司。
1.2 监控点设立与样品采集综合气候特点及海拔高度,选择24°20′N、103°42′E、海拔1 800 m的云南省师宗县五龙乡作为监控点,采取白天放养、晚上圈养的饲养方式设置CHUV血清学阴性的10头牛与5只羊作为哨兵动物,每年5-10月每周采血1次,11月至次年4月每月采血1次,每次需采集1份无抗凝剂全血及1份肝素钠抗凝血,全年共采集血液样品900份 (无抗凝剂全血450份+肝素钠抗凝血450份),用于虫媒病毒检测及病毒的分离。
1.3 血清CHUV抗体检测根据CHUV C-ELISA抗体检测试剂盒说明书检测送检的全年450份哨兵动物血清样品[13]。
1.4 血液CHUV的检测将200 μL抗凝血用 1 mL 生理盐水洗涤3遍后,加1 mL超纯水使红细胞裂解,按照RNA抽提试剂盒说明书提取病毒RNA,95℃ 5 min使病毒双链RNA解开后,以此作为模板进行RT-PCR扩增。针对CHUV VP2基因的保守序列设计特异性扩增引物,CHUV-S2-F:5′-GGATTCACGCYATTACTCGGA-3′;CHUV-S2-R:5′-ATGGATTTCTTGTTGGGATTAT-3′,目的片段为1 000 bp。RT-PCR扩增程序为50℃ 30 min,94℃ 3 min;94℃ 30 s,50℃ 30 s,72℃ 60 s,35个循环。PCR产物用1.0%的琼脂糖凝胶电泳检测。
1.5 病毒分离与电镜观察采用本实验室建立的CHUV高通量Real-time qRT-PCR方法对哨兵动物血液中的CHUV进行检测。取核酸检测结果为阳性的抗凝血200 μL加入1 mL生理盐水洗涤3遍后,加1 mL超纯水使红细胞裂解,接种在铺满BHK单层的25 cm2细胞瓶中,37℃培养箱培养7 d。每天观察细胞病变(CPE),出现CPE的细胞连续传代6次后,收获细胞上清,超速离心后取沉淀,加入PBS溶解过夜,取溶解好的病毒液,滴加于铜网上,使用磷钨酸进行负染,在电镜下观察病毒粒子的形态,并对分离到的病毒进行TCID50的测定,测定方法参照文献[14]。
1.6 病毒Seg-2及Seg-7基因的克隆及测序按照1.4中的方法提取病毒RNA,并针对CHUV的Seg-2及Seg-7基因ORF区设计特异性扩增引物,用One Step RT-PCR试剂盒一步法扩增Seg-2及Seg-7基因片段,其中Seg-2反应条件如1.4。Seg-7扩增程序:50℃ 30 min,94℃ 5 min;94℃ 30 s,58℃ 30 s,72℃ 90 s,35个循环;72℃延伸10 min,目的片段大小为1 047 bp。PCR产物用1.0%的琼脂糖凝胶电泳检测,将符合预期大小的PCR产物进行胶回收纯化,连接于pMD18-T载体,并转化E.coliDH5α感受态细胞;重组菌株经PCR鉴定后,阳性克隆菌由昆明硕擎生物科技有限公司测序;用DNASTAR软件对测序结果进行序列拼接,通过MEGA 6软件进行序列比对分析,并构建系统发生树:建树方法为Maximum Likelihood,选择Tamura-Nei模式,自举检验(bootstrap)取值1 000。
1.7 微量中和试验(microneutralization,MNT)CHUV只有1个血清型,研究中常用中和试验来诊断病毒和监测抗体。将分离到的4株CHUV与其标准血清进行微量中和试验,同时用4株CHUV对应血清与中山病毒标准病毒进行微量中和试验,从血清学进一步鉴定分离毒株。
2 结果
2.1 血清CHUV抗体检测通过C-ELISA方法检测监控动物群全年血清,结果显示2014年师宗监控点的牛5、牛17、牛19和牛20 血清CHUV抗体转阳。
2.2 血液CHUV的检测按照1.4中的方法提取转阳动物红细胞RNA,RT-PCR扩增产物凝胶电泳结果显示,2014年师宗监控点的牛5、牛17、牛19和牛20转阳当周的血液均为CHUV阳性。
2.3 病毒分离与电镜观察根据本实验室建立的CHUV高通量Real-time qRT-PCR方法,对牛5、牛17、牛19和牛20转阳当周、转阳前1周、转阳后1周的抗凝血进行qRT-PCR检测。结果显示,转阳前1周的抗凝血病毒含量最高(Ct值最小),将转阳前1周的抗凝血按照1.5中方法处理后在BHK-12上传代6次,观察到BHK细胞变圆脱落,病变细胞内有包涵体(图1)。收集病毒液上清,在电镜下观察病毒呈圆形,直径约为50 nm,中央密度高,外壳结构模糊,内衣壳清晰可见(图2),并将4株CHUV分别命名V098、V101、V102、V105(表1)。依据参考文献方法测定4株CHUV的TCID50分别为10-4.38/50 μL、10-4.50/50 μL、10-3.75/50 μL和10-3.63/50 μL。
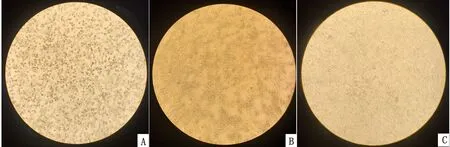
图1 分离病毒接种BHK-21细胞引起的细胞病变 A.分离病毒接种细胞(100×);B.分离病毒接种细胞(200×);C.对照细胞(100×)
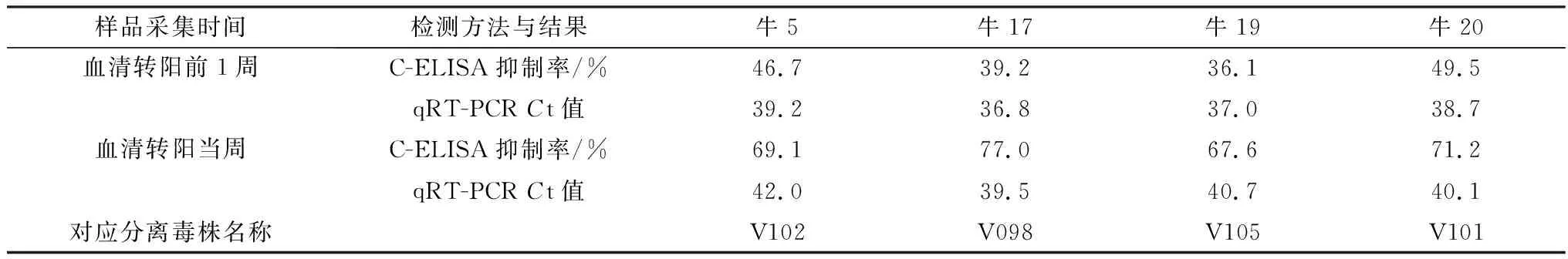
表1 监控动物CHUV C-ELISA及qRT-PCR结果
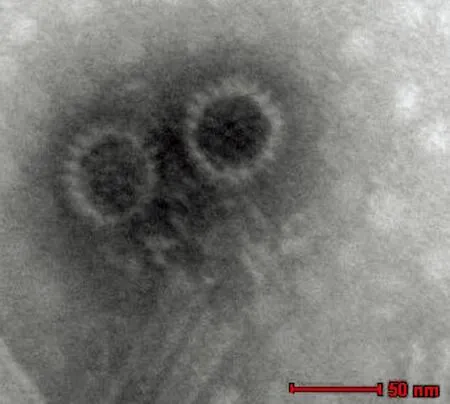
图2 CHUV分离株V102的电镜观察
2.4 分离毒株Seg-2及Seg-7基因序列分析根据1.6中方法,分别扩增分离毒株的Seg-2及Seg-7基因片段,扩增产物用1.0%的琼脂糖凝胶电泳检测,结果显示Seg-2在1 000 bp处、Seg-7在1 047 bp处有明亮条带,符合预期大小(图3)。扩增产物克隆后送测序,测序结果用MEGA 6软件进行比对分析,并构建系统发生树,结果显示V098、V101、V102、V105的Seg-2基因片段在进化发生树上独立成一簇,与印度分离株的序列相似度最高(99.1%~99.3%),与日本分离株的序列相似度次之(98.3%~98.6%),与中国分离株的序列相似度在96.5%~98.3%,与澳大利亚及津巴布韦分离株亲缘关系较远,序列相似度分别为83.3%~83.7%及86.0%~86.5%。4个毒株的Seg-7基因片段与此前分离到的中国大陆CHUV亲缘关系最近,序列相似度在99.7%~100%,而与我国台湾地区及日本、澳大利亚毒株相似度较低。4个分离株VP7基因位于进化树的同一大分支上,其中V102与2012年在云南省师宗县分离的CHUV(KT002594)序列相似度最高,形成其中一个小分支,而V098、V101和V105聚成另一簇,与2014年广西分离的CHUV(KT887186)[15]形成另一小分支(图4,5)。
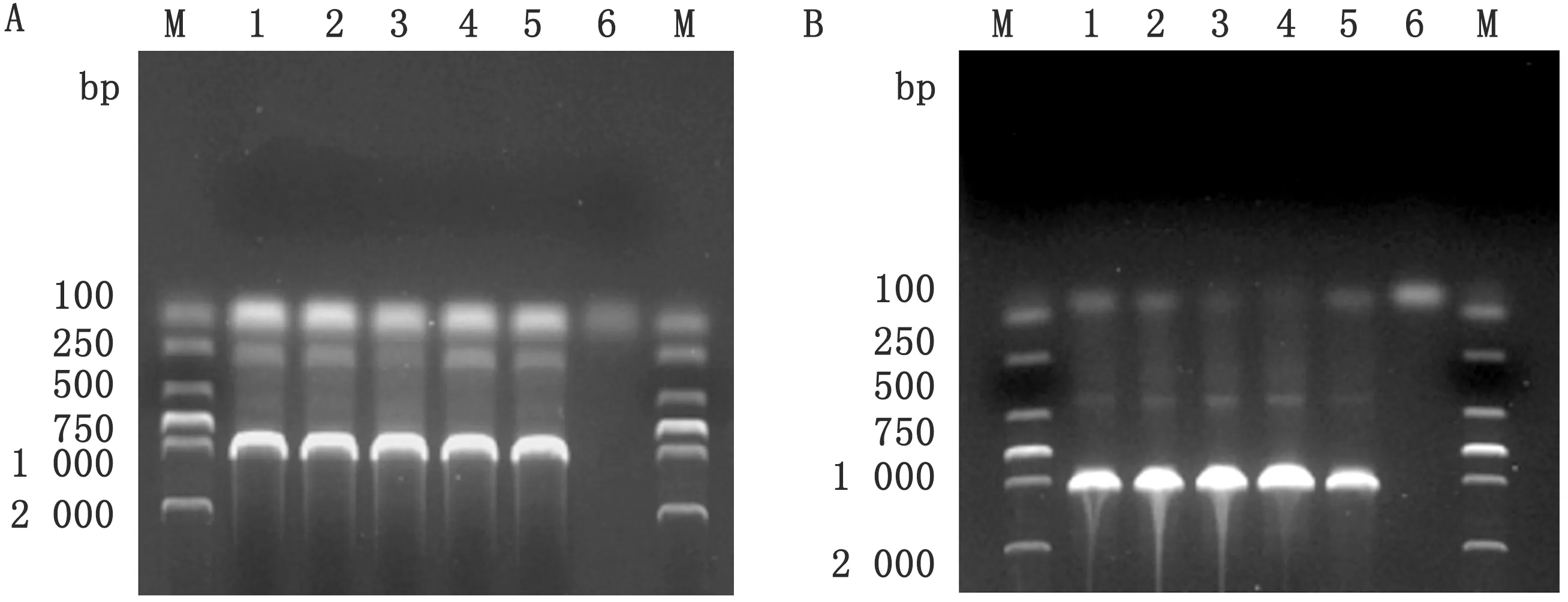
图3 CHUV分离株V098、V101、V102和V105的RT-PCR鉴定 A1~A4.V098、V101、V102、V105的Seg-2 基因片段;A5.Seg-2基因阳性对照;A6.Seg-2基因阴性对照;M.DL2000 DNA Marker.B1~B4.V098、V101、V102、V105的Seg-7 基因片段;B5.Seg-7基因阳性对照;B6.Seg-7基因阴性对照
2.5 微量中和试验(MNT)结果显示,经1∶40倍稀释后,CHUV标准血清对V098、V101、V102、V105的100TCID50存在保护;1∶80倍稀释后,CHUV标准血清对V098、V101的100TCID50仍然存在保护。同时,本试验用100TCID50的CHUV标准毒与V098、V101、V102、V105对应血清进行MNT,结果显示在1∶80倍稀释后,V098、V101、V102、V105对应血清对100TCID50的CHUV标准毒存在保护。
3 讨论
PALV广泛分布于热带及亚热带地区[16],报道分离过该病毒的国家包括非洲的津巴布韦、尼日尼亚、大洋洲的澳大利亚,以及亚洲的日本、韩国、中国。此前,我国对PALV的研究几乎为空白,直到2012年本实验室从云南省师宗县分离到1株PALV,经鉴定其为CHUV,才开始了对CHUV的深入研究。2012-2017年在国家公益行业(农业)专项的资助下,本实验室一直致力于虫媒病毒的检测、分离及鉴定工作,迄今已成功分离到多株虫媒病毒,其中包括CHUV、BTV、AKV、EHDV等;2016-2018年,本实验室对我国13个省区采集的牛羊血清调查发现,除吉林省以外的12个省区(辽宁、内蒙古、河北、新疆、西藏、湖北、重庆、四川、贵州、云南、广西和广东)均存在CHUV抗体阳性,另外我们曾几次从云南、广西分离到CHUV,表明该病毒可能已广泛流行于我国的南方地区。

图4 本试验分离获得CHUV毒株的 VP2序列系统进化分析
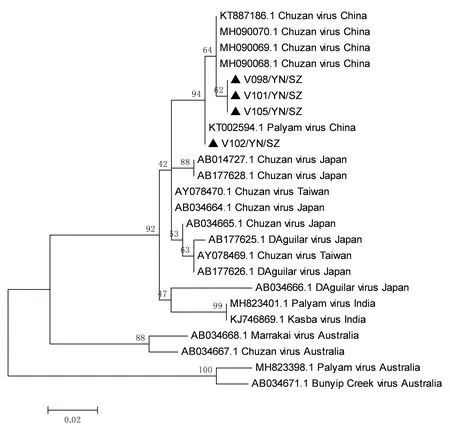
图5 本试验分离获得CHUV毒株的 VP7序列系统进化分析
CHUV是帕利亚姆群的虫媒病毒,病毒传播需要病原、媒介及宿主。虫媒病毒存在明显的季节性和地域性,因此病毒分离也具有一定偶然性和随机性,为此本试验选择气候及海拔适宜的云南省师宗县五龙乡作为监控点,通过定期采血监测哨兵动物血清学转阳情况,以提高病毒分离的几率。研究中发现,当血清CHUV抗体水平高时,血液中的CHUV含量则会相对较低,通过qRT-PCR方法对CHUV含量进行检测,最终选择CHUV血清抗体转阳前1周的血液来分离病毒;本试验通过比对CHUV在BHK、蚊子细胞(C6/36)、鸡胚(CEF)的分离效果,发现CHUV在BHK增殖良好且病变明显,因此选择通过BHK传代以分离CHUV。本试验通过分析不同采样时间病毒的相对含量、血清中抗体水平以及病毒传代方式,总结出一套高效的分离办法。本实验室运用该方法在其他地区成功分离到多株虫媒病毒,包括AKV、EHDV,此监控及分离方法对CHUV及其他虫媒病毒的研究具有指导意义。
研究选择对Seg-2、Seg-7基因序列进行克隆分析,是由于Seg2编码的VP2蛋白决定了病毒的血清型,而Seg7编码的VP7蛋白具有群特异性,且能体现出明显的地域性。序列分析结果表明,4个分离株V098、V101、V102、V105的Seg-2基因片段在进化发生树上独立成一簇,与印度分离株的序列相似度最高,为99.1%~99.3%,与日本分离株的序列相似度为98.3%~98.6%,与中国大陆分离株的序列相似度为96.5%~98.3%;而与澳大利亚及津巴布韦分离株亲缘关系较远,序列相似度分别83.3%~83.7% 及86.0%~86.5%。4个分离株的Seg-7基因片段与此前中国大陆分离到的CHUV亲缘关系最近,序列相似度在99.7%~100%,而与日本、印度及我国台湾地区毒株相似度次之,其中与我国台湾地区毒株的序列相似度为98.2%~98.6%,与日本毒株的序列相似度为96.7%~97.8%,与印度毒株的相似度为88.4%~94.1%。中国、日本、印度地区毒株在Seg-7基因进化树上聚成一簇,形成了一个独立的“Asia Group”,它提示Seg-7基因可作为不同血清型PALV地域性判定的标准,也提示这4个地区的CHUV源自同一个先祖,分离株Seg-7基因与澳大利亚毒株亲缘关系最远,相似度仅为84.4%~89.3%,另外,虽然4个分离株Seg-7基因位于进化树的同一大分支上,但V102与2012年在云南省师宗县分离的CHUV(KT002594)独立成其中一个小分支。
另外,从分离株Seg-2基因进化发生树可以发现[17],PALV并没有像同属的BTV一样,在Seg-2基因上呈现不同血清型聚在一起形成一个基因型[18-19]。由于目前对PALV的研究有限,所以很难看出PALV的Seg-2基因是否存在和BTVSeg-2基因同样的进化特征,随着世界范围内对PALVSeg-2基因的深入研究,我们将进一步认识到PALVSeg-2基因与其血清型间的关系及进化特征。
本试验从云南省成功分离到4株PALV,经鉴定分离株均为CHUV,并报道了分离株Seg-2及Seg-7基因序列特征,研究结果为进一步开展世界范围内 PALV的预防、诊断、致病性、遗传特性等研究奠定基础。Seg-2基因序列分析显示,Seg-2与PALV血清型间存在一定的对应关系,但不明确,有待进一步的研究;Seg-7基因序列分析显示,Seg-7基因序列在不同血清型的PALV间高度保守,能体现出明显的地域特征。
