生殖激素对山羊颗粒细胞孕酮合成的影响
2020-09-25李曼曼茆达干
李曼曼,于 昊,薛 洋,茆达干,2*
(1.南京农业大学 动物科技学院,江苏 南京 210095;2.南京农业大学 动物科学类国家级实验教学示范中心,江苏 南京 210095)
颗粒细胞是卵巢的主要功能细胞,其增殖与分化直接影响着卵泡的生长发育、排卵、黄体形成以及甾体激素分泌等卵巢功能活动。当颗粒细胞离开体内环境时会由于其在排卵前卵泡中的自然命运趋于自然黄素化。补充血清可诱导颗粒细胞增殖,但可影响类固醇的产生和重要功能性基因的表达[1]。采用无血清颗粒细胞培养体系,可维持颗粒细胞对促性腺激素和生长因子的敏感性[2]。
在哺乳动物体内,卵泡的发育和排卵主要受促性腺激素的调控,尤其是受FSH和LH在卵泡不同发育阶段变化规律的影响。现已普遍认为,FSH可促进有腔卵泡和排卵前卵泡的生长;少量的LH与FSH协同能促进卵泡发育成熟并分泌雌激素。KATSUSHIGE等[3]为了研究LH对小卵泡成熟的作用,应用体外双细胞系统对牛颗粒细胞和膜细胞进行共培养,结果显示添加LH会增加小卵泡对促性腺激素的敏感性,并通过抑制GC凋亡和闭锁以促进卵泡生长和存活。菅瑞珍等[4]应用血清培养体系结合生殖激素处理绵羊卵巢颗粒细胞检测到孕酮水平和标记基因的表达变化。有关FSH、LH和E2对无血清培养的山羊颗粒细胞的作用却鲜有报道。因此,本试验以无血清培养的山羊颗粒细胞为研究对象,应用生殖激素单独或联合处理,分别从孕酮合成、标记基因及蛋白层面研究生殖激素对山羊颗粒细胞孕酮合成的影响,为进一步研究生殖激素在山羊卵巢卵泡-黄体转化中的作用奠定理论基础。
1 材料与方法
1.1 试验样本采集从江苏省丹阳市山羊屠宰场采集刚屠宰的健康山羊卵巢,装入含有37℃生理盐水的保温瓶中,3 h内带回实验室。参照YAO等[5]方法从卵泡(φ 2~5 mm)中收集卵泡液,台盼蓝染料检测到细胞活力在90%以上。山羊颗粒细胞以2×105/mL的密度接种到培养瓶中,并在含有0.1% BSA、10-7mol/L雄烯二酮、100X ITS、1%血清、100 IU/mL青霉素和100 mg/L链霉素的细胞完全培养基(CCM)中培养48 h备用。
1.2 主要试剂细胞培养液DMEM/F-12、PBS、青霉素和链霉素、FBS和ITS-X均购自GIBCO;牛血清白蛋白BSA、牛胰岛素、FSH和LH均购自北京索莱宝科技有限公司;雄烯二酮购自上海源叶生物科技有限公司;E2购自SIGMA;孕酮检测试剂盒购自北京北方生物技术研究所;P450scc抗体(#DF6569)购自Affinity;HSD3B抗体(#ab75710)购自Abcam;CYP19A1抗体(#MCA2077S)购自Bio-Rad;α-Tubulin抗体(#ABM0010)购自Zoonbio Biotechnology;GAPDH(60004-1-Ig)购自Proteintech;羊抗兔、羊抗鼠二抗购自Abclonal Technology;ECL发光液购自南京诺唯赞生物科技有限公司;BCA试剂盒购自碧云天公司;PrimeScript RT reagent Kit with gDNA Eraser(RR047A/B),TB GreenTMPremix Ex TaqTM(Tli RNaseH Plus)(RR420A)购自TaKaRa;其他试剂均购自南京农业大学试剂部,为国产分析纯。
1.3 试验设计试验共分6组,每组3个重复。分离出的山羊颗粒细胞在CCM中培养48 h后,收集培养液作为添加激素组(0 h),并将75%体积的培养基换为含有0.1%BSA、1% 血清、2 mg/L牛胰岛素、100 IU/mL青霉素和100 mg/L 链霉素的分化培养基(LCM)[6]。随后分6组处理:第1组联合添加FSH、LH(终浓度2.5 IU/mL)和 E2(终质量浓度1 mg/L);第2组联合添加FSH、LH(终浓度1.25 IU/mL)和E2(终质量浓度1 mg/L);第3组单独添加FSH(终浓度2.5 IU/mL);第4组单独添加LH(终浓度2.5 IU/mL);第5组单独添加E2(终质量浓度1 mg/L);第6组不加激素作为对照。
处理24,48,72,96 h后分别收集培养液,12 000 r/min离心10 min,收集上清液,-20℃冻存备用。同时,收集细胞用于RNA和蛋白的提取。
1.4 孕酮测定采用碘(125I)孕酮放射免疫分析药盒(北京北方生物技术研究所)检测培养液孕酮(P4)浓度,批间差异系数均小于15%,批内差异均小于10%,灵敏度小于0.2 μg/L,由上海信帆生物科技有限公司测定。
1.5 Real-time PCR反应
1.5.1总RNA提取和cDNA合成及质量鉴定 利用TRIZOL试剂提取各组细胞的总RNA,通过Nanodrop ND-1000测定其浓度及D260 nm/D280 nm,按照PrimeScript RT reagent Kit with gDNA Eraser说明书对RNA进行反转录,置于-80℃超低温冰箱保存备用。
1.5.2荧光定量RT-PCR引物设计与合成 基于美国国立生物信息技术中心(NCBI)和Primer 5.0软件设计山羊PTGFR、HSD3B、StAR基因的引物,同时以GAPDH作为内参基因,引物序列大小见表1,由南京擎科生物科技有限公司合成。采用2-ΔΔCt法计算基因相对表达量。

表1 试验所用引物序列及扩增产物长度
1.6 蛋白免疫印迹法检测CYP19A1、HSD3B和P450scc蛋白的表达应用RIPA裂解法提取组织总蛋白,BCA法测定蛋白浓度。具体步骤参照ZHANG等[7]进行SDS-PAGE电泳。一抗(HSD3B和P450scc以1∶1 000稀释,CYP19A1以1∶250稀释,α-Tubulin以1∶5 000稀释)4℃孵育过夜;羊抗兔二抗和羊抗鼠二抗(1∶5 000)室温孵育1 h,ECL发光检测,应用Image J软件进行灰度分析。
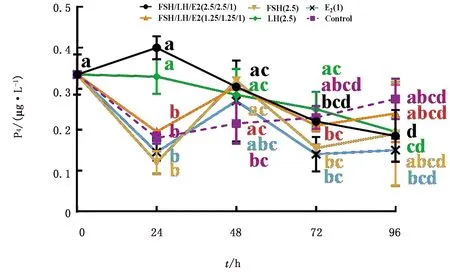
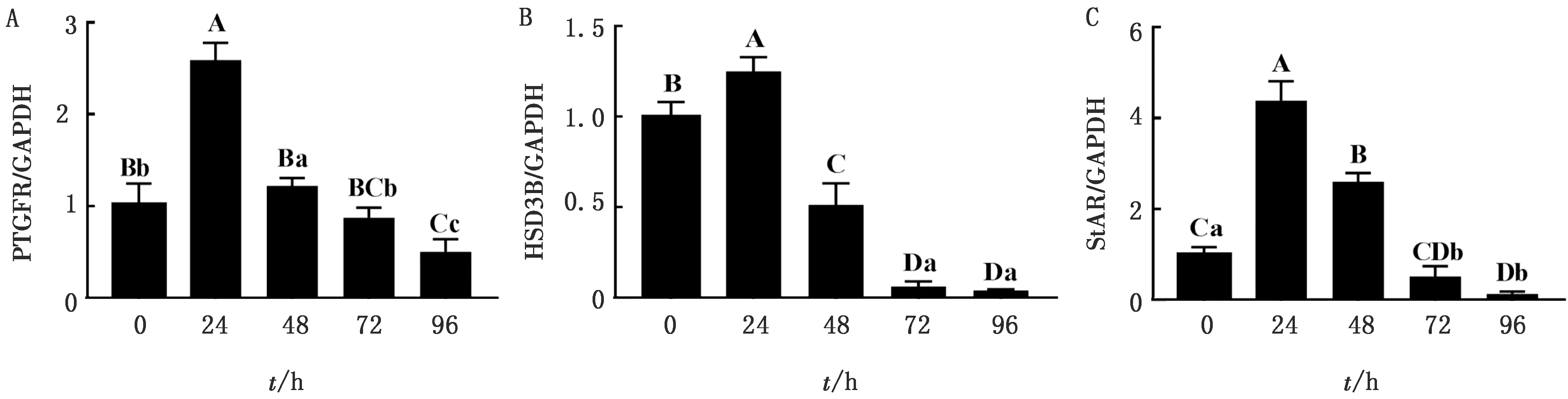
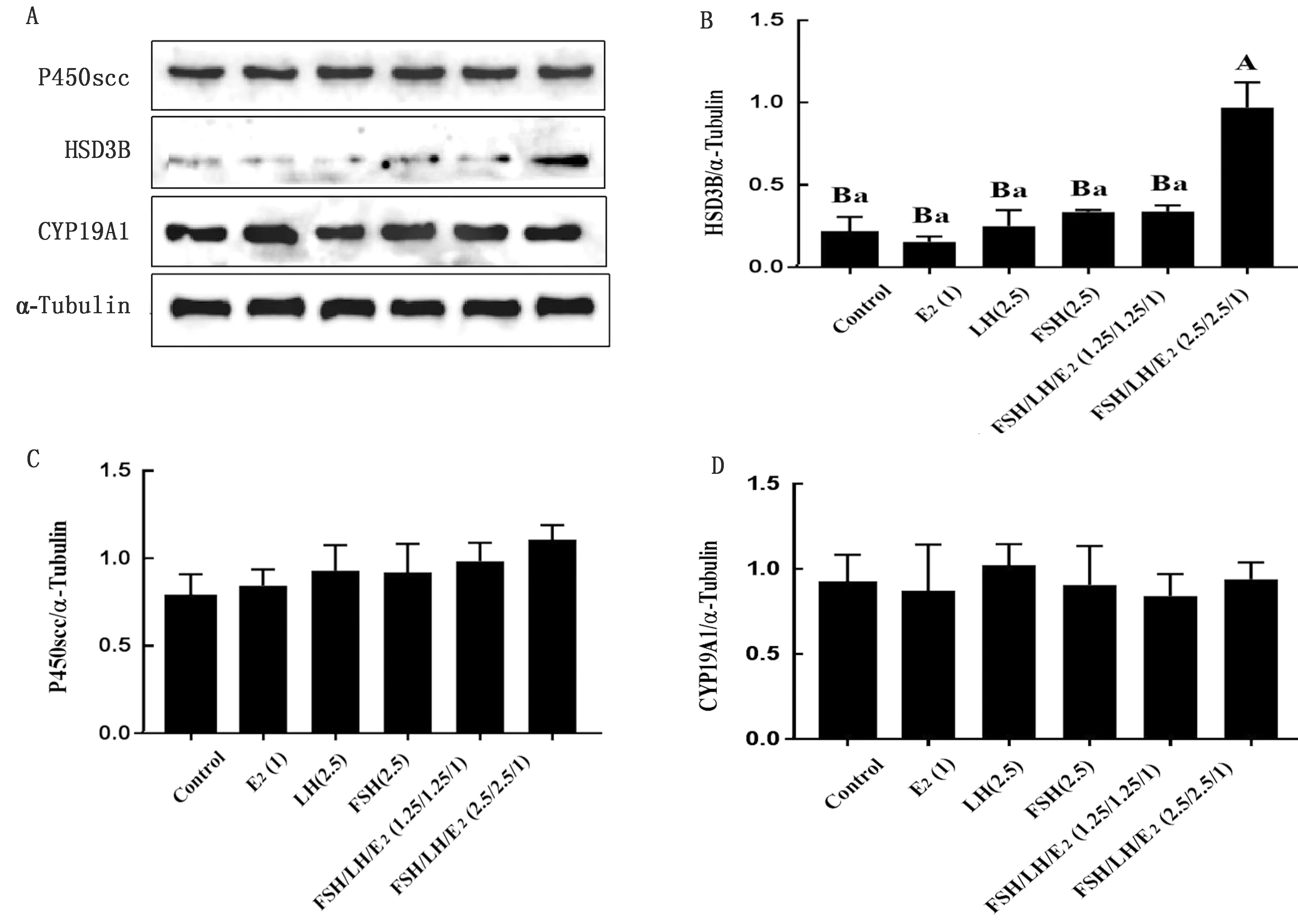
1.7 数据统计与分析试验数据用GraphPad 5.0软件进行整理,统计结果以平均数±标准误表示,差异显著性检验采用ANOVA的Bonferroni检验法进行多重比较。P<0.05表示差异显著,P<0.01表示差异极显著,0.05 2.1 山羊颗粒细胞培养液中孕酮水平应用FSH、LH和E2联合或单独处理24 h后,FSH/LH/E2(2.5/2.5/1)组的孕酮水平与LH(2.5)组水平相当,均显著高于其他4组(P<0.01);然而,在处理48,72,96 h时间点,FSH、LH和E2联合或单独处理组间均无显著性差异(P>0.05,图1)。 FSH/LH/E2(2.5/2.5/1)组的孕酮水平在处理后24 h升高不明显(P=0.151),但随着培养时间的延长逐渐下降,在72,96 h的孕酮水平极显著低于0,24 h(P<0.01);FSH/LH/E2(1.25/1.25/1)组与FSH(2.5)组的孕酮水平变化趋势一致,与0 h相比均在24 h显著下降(P<0.05),但48 h又显著高于24 h(P<0.05),72,96 h与48 h相比均无显著性差异(P>0.05);LH(2.5)组的孕酮水平随着培养时间的延长逐渐下降,在96 h显著下降(P<0.05);E2(1)组和对照组的孕酮水平均在24 h 显著下降(P<0.05),其余时间点无显著变化。 图1 生殖激素处理对山羊黄素化颗粒细胞孕酮(P4)水平的影响(字母不同代表差异显著) 2.2 山羊颗粒细胞PTGFR、HSD3B和StAR基因表达应用FSH/LH/E2(2.5/2.5/1)处理细胞0~96 h,实时荧光定量PCR技术检测颗粒细胞黄体化基因PTGFR、HSD3B和StAR的相对表达量。 2.2.1PTGFR表达量 处理24 h的PTGFR表达量极显著升高(P<0.000 1),随后逐渐下降;处理48 h时的基因表达量显著高于72 h的表达量(P<0.05),极显著高于96 h的表达量(P<0.01);处理72 h的基因表达量显著高于96 h的表达量(P=0.018);处理96 h的基因表达量极显著低于0 h的表达量(P<0.01)(图2A)。 2.2.2HSD3B表达量 处理24 h的HSD3B表达量极显著升高(P<0.01),随后逐渐下降;处理48 h时的基因表达量极显著高于72,96 h的表达量(P<0.01);处理72,96 h的基因表达量极显著低于0,24 h的表达量(P<0.01),而处理72,96 h两组间无显著性差异(P=0.723)(图2B)。 2.2.3StAR表达量 处理24 h的StAR表达量极显著升高(P<0.01),随后逐渐下降;处理48 h时的基因表达量极显著高于72,96 h时的表达量(P<0.01);处理72 h的基因表达量极显著低于48 h 的表达量(P<0.01),且显著低于0 h的表达量(P=0.033);处理96 h的基因表达量极显著低于0 h 的表达量(P<0.01)(图2C)。 图2 FSH/LH/E2(2.5/2.5/1)处理山羊颗粒细胞不同时间点的PTGFR、HSD3B和StAR基因表达量(大写字母不同代表差异极显著,小写字母不同代表差异显著。下同) A.PTGFR/GAPDH;B.HSD3B/GAPDH;C.StAR/GAPDH 2.3 山羊颗粒细胞中P450scc、HSD3B和CYP19A1蛋白的表达FSH、LH和E2联合或单独处理细胞24 h后,应用WB技术检测各组细胞P450scc、HSD3B和CYP19A1蛋白表达量(图3A)。FSH/LH/E2(2.5/2.5/1)组的P450scc蛋白表达量与对照组相比有升高的趋势(P=0.060 4),与其他各组相比无显著性差异(P>0.05,图3B);FSH/LH/E2(2.5/2.5/1)组的HSD3B蛋白表达量极显著高于其他组(P<0.01),而其他各组间无显著性差异(P>0.05,图3C);而CYP19A1蛋白表达量在6个组间均无显著性差异(P>0.05,图3D)。 图3 生殖激素处理24 h各组P450scc、HSD3B和CYP19A1蛋白的表达量 A.印迹图;B,C,D.柱状图 3.1 生殖激素处理对山羊颗粒细胞孕酮分泌水平的影响FSH能够提高卵巢颗粒细胞增殖活性,促进窦前卵泡颗粒细胞增生,抑制卵泡闭锁,诱导LHR合成及类固醇激素生成,与LH协同激发卵泡成熟排卵并使颗粒细胞转变成黄体细胞[8]。OKTEM等[9]研究发现,FSH处理人有丝分裂非黄素化颗粒细胞系(HGrC1)后,HSD3B活性增加,促进孕酮合成[10]。李赞东等[11]通过体外试验研究FSH与LH对鸡颗粒细胞孕酮分泌的影响,发现摘除垂体排除内源性FSH和LH时孕酮浓度显著下降,单独添加FSH或LH时均无促进作用,同时添加FSH与LH时孕酮浓度恢复,表明FSH、LH是颗粒细胞发生黄体化的主要因素。卵巢合成E2的能力是衡量卵泡功能和活性的主要指标[12]。WILTBANK等[13]推测雌激素可能在颗粒细胞增殖与分化中起重要作用。然而,本试验中激素联合或单独处理24 h后孕酮水平并未升高,且FSH和E2组反而下降。这可能是因为铺板后的颗粒细胞由于应激未能立刻完全恢复颗粒细胞特征。这与YENUGANTI等[14]的试验结论一致,牛颗粒细胞只有长期培养超过4 d时,才能从铺板应激中恢复并重新获得颗粒细胞的特征。 激素处理24 h后 FSH/LH/E2(2.5/2.5/1)组孕酮分泌量高于FSH/LH/E2(1.25/1.25/1)组,可能是由于生理浓度范围内FSH浓度越高刺激颗粒细胞增生的作用越强[15],而高浓度的FSH会产生异相作用,增加孕酮的产生,导致颗粒细胞黄体化[16]。在牛膜细胞和颗粒细胞的体外共培养系统中,添加FSH 24 h孕酮分泌量呈剂量依赖式增加[17]。因此,本试验选择不同浓度的生殖激素处理,结果与菅瑞珍[18]的研究结果一致,其应用FSH/LH/E2(2.5/2.5/1)处理绵羊颗粒细胞结果孕酮分泌达到了绵羊体内发情后2 d卵巢优势卵泡液中的水平。 激素处理24 h 后FSH/LH/E2(1.25/1.25/1)组、FSH(2.5)组和E2(1)组孕酮水平下降可能与培养过程中未补充孕酮合成代谢基质如血清等有关,低剂量FSH和LH短期处理还不足以使颗粒细胞充分黄素化,或者芳香化酶(CYP19A1)将合成的孕酮代谢为雄激素或雌激素。CHESHENKO等[19]发现,芳香化酶CYP19的表达可以改变雌激素产生的速率进而改变雌激素的水平。LH、FSH和PPARγ通路调控芳香化酶的转录水平[20],即LH和FSH分别通过LHR和FSHR介导芳香化酶的下调或上调。激素处理48 h 后FSH/LH/E2(1.25/1.25/1)组、FSH(2.5)组和E2(1)组孕酮水平上升,处理72,96 h孕酮分泌量整体均呈下降趋势,这可能是由于培养时间的延长,添加的激素活性耗竭,孕酮的合成代谢和活性下降。因为随着黄体退化,细胞会大量分泌20α羟类固醇脱氢酶将孕酮代谢为20α-羟孕酮[21]。 3.2 生殖激素处理对山羊颗粒细胞类固醇合成酶的影响孕酮合成过程中StAR、P450scc和HSD3B分别负责将胆固醇转运至线粒体内部,将胆固醇转化为孕烯醇酮以及将孕烯醇酮催化成孕酮[22],这一过程受到PRL、LH、FSH和E2等激素的调节[23]。FSH和LH直接参与卵泡的发育、排卵、黄体形成和类固醇激素合成[24]。在LH峰之后排卵之前,P450scc、HSD3B mRNA表达暂时性降低;排卵后和黄体化期间其mRNA表达和酶活性升高,孕酮产量增加;黄体完全功能化时P450scc、HSD3B活性进一步增加[24]。体外研究发现,在虹鳟鱼的卵泡中,FSH增加StAR和HSD3B转录水平[25]。在牛膜细胞和颗粒细胞的体外共培养系统中,FSH 可提高StAR和P450scc mRNA表达量[17]。FSH与TCS(三氯生)共处理鼠颗粒细胞,可升高HSD3B和StAR蛋白水平,而对P450scc蛋白水平无影响[26]。 本试验中山羊卵巢颗粒细胞联合添加FSH/LH/E2(2.5/2.5/1)后,随着作用时间的延长,StAR基因表达量呈先升高(至24 h)然后下降的趋势,与HSD3B基因表达模式一致。同样在激素处理24 h时,HSD3B蛋白在FSH/LH/E2(2.5/2.5/1)组显著高于其他处理组,这均表明FSH/LH/E2(2.5/2.5/1)对山羊卵巢颗粒细胞分泌孕酮起促进作用。 然而,激素处理24 h后,FSH/LH/E2(2.5/2.5/1)组的P450scc蛋白呈升高趋势,但与其他处理组无显著性差异,可能由于颗粒细胞中编码的胆固醇侧链裂解酶P450scc及其催化产物孕烯醇酮可能在短期内较为充足,不会限制后续类固醇的合成,另一方面可能由于24 h的处理时间不足以影响蛋白表达。这与前人的研究一致。LIU等[27]对小鼠和大鼠体外培养的颗粒细胞模型研究发现,StAR对FSH 的应答极快,3 h后既能检测到mRNA的上调,而P450scc应答较为缓慢,在24 h才检测到mRNA的表达变化。 CYP19A1是细胞色素P450家族成员之一,它用来催化雌激素生成的限速步骤即雄激素转化为雌激素一步,研究表明,CYP19A1在哺乳动物颗粒细胞中表达[28]。有研究发现,FSH能刺激人、大鼠和牛颗粒细胞表达CYP19A1[8]。FSH处理人有丝分裂非黄素化颗粒细胞系(HGrC1)显著提高HSD3B和 CYP19A1蛋白表达量[18]。在本试验激素联合或单独处理24 h的CYP19A1蛋白表达无组间差异,与前人研究结果不一致,可能是由于物种差异或细胞所处的阶段不同而引起的。 3.3 生殖激素处理对山羊颗粒细胞PTGFR表达的影响哺乳动物卵巢黄体形成过程中,卵泡膜细胞分化而来的小黄体细胞包含大多数LHCGR,而颗粒细胞分化而来的大黄体细胞则表达前列腺素(PGF2α)受体(PTGFR)[13]。ROMEREIM等[29]研究发现,PTGFR作为传统的黄体细胞标记物,其在大黄体细胞中大量表达,在颗粒细胞、膜细胞和小黄体细胞中极少量表达。排卵前LH峰可显著增加卵巢卵泡PGE2和PGF2α的浓度,且前列腺素主要是在颗粒细胞中合成[30]。FSH或LH处理刺激鼠颗粒细胞中内质网应激关键信号转导元件—激活转录因子6(ATF6)合成,进而促进PTGFR基因表达[31]。在体外培养的奶牛子宫内膜组织中添加10-12~10-8mol/L E2可上调奶牛子宫内膜组织中PTGFR的mRNA和蛋白表达,促进奶牛子宫内膜组织中PGs合成酶的表达,增加 PGE2和PGF2α的分泌合成[32]。这些结果表明,生殖激素可促进PTGFR基因表达,进而可能增加PGE2和PGF2α的分泌合成,调节排卵等生殖功能。 本试验中FSH/LH/E2(2.5/2.5/1)处理组在山羊颗粒细胞中PTGFR呈现先上升后下降的表达模式,在处理24 h极显著上升,这可能是因为高浓度的FSH、LH和雌激素诱发了PGF2α合成,进而使PGF2α的受体PTGFR表达量升高;在处理48,72,96 h PTGFR表达量逐渐下降,且在96 h极显著低于对照组,这可能是因为雌激素活性下降,进而PTGFR表达量下降。这与前人研究结果相似,在卵巢切除的大鼠中,所有PTGER和PTGFR基因的mRNA表达被E2下调[33]。 联合添加FSH、LH(终浓度为2.5 IU/mL)和 E2(终质量浓度1 mg/L)24 h,有利于体外无血清培养的山羊颗粒细胞合成孕酮,为进一步研究生殖激素在山羊卵巢卵泡-黄体转化中的作用奠定理论基础。2 结果
3 讨论
