猪血凝性脑脊髓炎病毒间接ELISA抗体检测试剂盒的研制与应用
2020-09-25舒婧妍张海涛兰云刚宋德光贺文琦
林 野,刘 芳,舒婧妍,李 姿,张海涛,张 竞,兰云刚,高 丰,宋德光*,贺文琦*
(1.吉林大学 动物医学学院,吉林 长春130062;2.吉林省辉南县农业农村局,吉林 辉南135100)
猪血凝性脑脊髓炎是由猪血凝性脑脊髓炎病毒(porcine hemagglutinating encephalomyelitis virus,PHEV)引起的一种急性、高接触性传染病,3周龄以下仔猪最为易感,死亡率最高可达100%[1]。2000年吉林省首次暴发该病,仔猪死亡率高达80.6%[2]。近年来,对吉林、天津、辽宁、山东、黑龙江等地区的猪场猪群进行血清学调查发现,PHEV感染率高达60%以上[1,3]。临床上,PHEV感染仔猪易发生呕吐(偶尔伴发有腹泻)和神经症状,与猪伪狂犬病、猪传染性胃肠炎、猪流行性腹泻等疫病的临床症状具有相似性,类症鉴别诊断具有一定难度。目前,针对PHEV感染诊断的相关研究仍处于初级阶段[4]。因此,研制开发可用于猪血凝性脑脊髓炎快速诊断和血清学调查的间接ELISA抗体检测试剂盒具有广阔的应用前景。
PHEV是β冠状病毒属的成员之一,具有典型的冠状病毒特征,表达5种主要结构蛋白,即核衣壳(N)蛋白、膜(M)蛋白、纤突(S)蛋白、小膜(E)蛋白及血凝素-脂酶(HE)蛋白,其中N蛋白具有高度保守、高磷酸化、高碱性的特性[5]。在PHEV感染初期,宿主可产生大量针对N蛋白的抗体,因此我们建立基于PHEV-N重组蛋白为检测抗原的间接ELISA抗体检测试剂盒,可用于检测猪群中PHEV感染现状,并为今后的临床检测及血清学调查提供有效途径。
1 材料与方法
1.1 试剂与样品pET28a-N/BL-21重组表达菌株由本实验室保存;镍离子亲和层析柱购自于GE Healthcare公司;HRP标记的羊抗猪抗体购于Proteintech公司;TMB底物购于eBioscience公司;ELISA酶标板购自Proteintech公司。
1.2 毒株及血清PHEV毒株及猪伪狂犬病病毒(PRV)、猪圆环病毒(PCV)、猪δ冠状病毒(PDCoV)、猪瘟病毒(CFSV)阳性血清均由本实验室保存。819份临床血清样本分别来源于吉林、山东、天津、辽宁和黑龙江等地区疑似PHEV感染的部分猪场(前期曾有哺乳期发病仔猪表现神经症状、呕吐等)。
1.3 PHEV-N重组抗原蛋白的制备与质量检测将pET28a-N/BL-21重组表达菌株接种到LB液体培养基中,37℃恒温摇床中培养2 h;加入1×10-4IPTG(1∶1 000)诱导6 h,超声破碎后经His GraviTrap纯化试剂盒纯化,并进行SDS-PAGE电泳检测。
1.4 ELISA方法的建立及优化用纯化后的重组N蛋白包被ELISA酶标板,对抗原包被浓度、血清稀释度、抗原包被时间、封闭时间等条件进行优化,确定阴性和阳性的判定标准并与红细胞凝集抑制试验(HI)进行符合率比较。
1.5 试剂盒的组装标准化的PHEV-N蛋白间接ELISA抗体检测试剂盒主要组分包括:已包被PHEV-N重组蛋白的可拆式96孔酶标板(2块);阴性、阳性对照血清(各1管,1 mL/管);样品稀释液(1瓶,15 mL);酶标二抗(1管,100 μL);10×浓缩洗涤液(1瓶,125 mL);TMB底物(1瓶,20 mL);终止液(1瓶,20 mL)。
1.6 批间、批内重复性试验利用标准化PHEV-N蛋白间接ELISA抗体检测试剂盒检测不同背景的4份血清,每份血清做7次重复,根据P/N值,分析批内重复性。用不同批次该试剂盒检测4份不同背景的血清,根据P/N值,分析批间重复性。
1.7 检菌试验将3批PHEV-N蛋白间接ELISA抗体检测试剂盒,分别置于4℃及-20℃保存。分别于1,2,3,4,5,6个月后取出适量液体在无抗性LB平板上划线,37℃ 温箱内培养过夜,检测其有无细菌生长。
1.8 特异性、敏感性和抗原保存期试验将标准阳性血清按1∶100~1∶12 800倍比稀释,利用标准化试剂盒进行检测,测试其敏感性。用此试剂盒检测PRV、PCV、PDCoV、CFSV和PHEV这5种病原阳性血清,测试其特异性及有无交叉反应。取同一批次试剂盒,将其分别放入4℃及-20℃中保存,逐月进行检测,根据P/N值确定其保存期与保存条件。
1.9 ELISA试剂盒与HI检测结果符合率比较用PHEV-N蛋白间接ELISA抗体检测试剂盒及HI方法分别检测40份不同抗体效价的血清,并对其符合率进行比较。
1.10 PHEV-N蛋白间接ELISA抗体检测试剂盒的初步应用利用组装好的ELISA检测试剂盒检测来自吉林、山东、天津、辽宁和黑龙江等地疑似PHEV感染的部分猪场的819份血清,计算各地区PHEV感染阳性血清率。
2 结果
2.1 重组蛋白N的诱导表达与纯化将pET28a-N重组蛋白进行诱导表达,对表达产物进行SDS-PAGE电泳检测。结果显示,在约为 50 000 处出现特异性条带,与预期大小一致(图1A)。经纯化得到3批较高纯度重组N蛋白,质量浓度分别为122.497,189.888,155.442 g/L(图1B)。
2.2 间接ELISA体系优化及临界值确定
2.2.1间接ELISA体系的优化 根据控制变量法,优化PHEV-N蛋白间接ELISA抗体检测方法反应体系如下:最佳抗原包被浓度为0.062 5 mg/L,包被时间为37℃ 2 h后4℃过夜,封闭剂为3%脱脂奶粉,封闭时间为37℃ 2 h,血清稀释度为1∶200,血清反应时间为37℃ 90 min,酶标二抗稀释度为1∶10 000,酶标二抗作用时间为37℃ 90 min,显色时间为室温20 min。
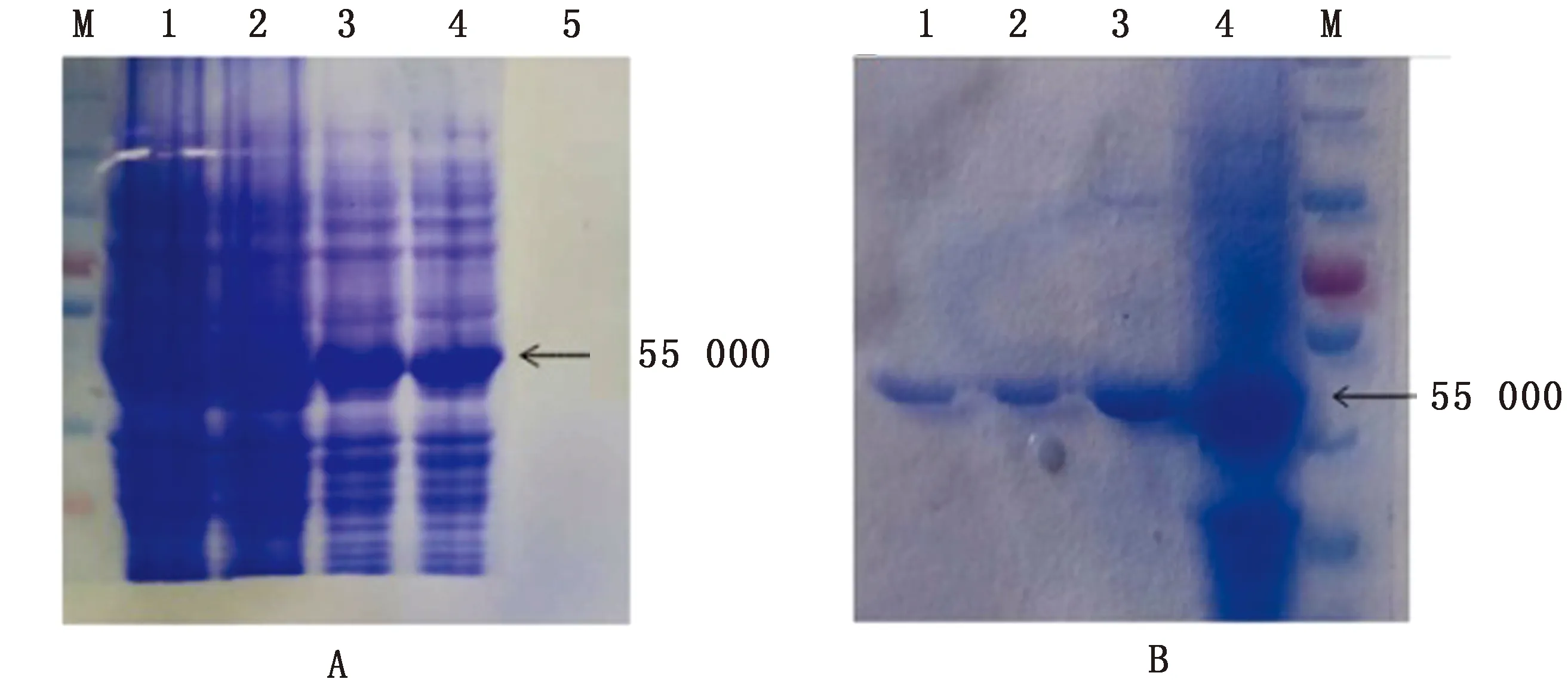
图1 重组N蛋白的诱导表达及纯化 M.蛋白Marker;A.重组N蛋白诱导表达;A1,A2.未诱导p-ET28a-N;A3,A4.诱导6 h的p-ET28a-N;A5.阳性对照;B.重组N蛋白纯化;B1~B3.纯化的N蛋白;B4.表达菌的沉淀
2.3 批间、批内重复性检测结果利用不同批次标准化的PHEV-N蛋白间接ELISA抗体检测试剂盒检测已知背景PHEV阳性血清,重复检测7次。结果见表1,组间变异系数(CV)为1.21%~7.56%,均小于10%,表明不同批次试剂盒的检测结果稳定。同时,用标准化的同一批次试剂盒检测4份不同背景的血清,重复检测3次。结果见表2,组内变异系数为1.09%~2.60%,均小于3%,表明同一批次的试剂盒检测结果稳定,重复性好。
2.4 检菌试验试剂盒内主要试剂检菌试验结果显示,试剂盒各组分均无细菌生长。
2.5 特异性与敏感性试验用标准化试剂盒检测PRV、PCV、PDCoV、CSFV和PHEV这5种病原阳性血清,D450值分别为0.273,0.192,0.237,0.208,0.641,即仅PHEV感染血清检测结果为阳性,表明该试剂盒具有良好的特异性并且无交叉反应。按照1∶100~1∶12 800倍比稀释已知背景PHEV阳性血清并进行检测,结果显示血清稀释度为1∶6 400时,判定结果仍为阳性(表3),表明该试剂盒敏感性良好。
2.6 抗原保存期试验取同一批次试剂盒,将其分别置于4℃或-20℃条件下保存,逐月进行检测。结果显示,在4℃条件下试剂盒至多保存3个月,在-20℃ 条件下至多保存6个月(表4)。
2.7 ELISA试剂盒与HI结果的符合率以PHEV二免后猪血清为阳性对照,以SPF猪血清为阴性对照,分别利用ELISA试剂盒、HI方法检测40份不同抗体效价的血清。结果如表5所示,ELISA试剂盒检测到阳性血清数量为23份、阴性为17份;而HI检测到阳性血清数量为18份、阴性血清数量为22份;由二者检测均呈阳性的血清数量为17份,二者检测均呈阴性的血清数量为14份,计算得出二者符合率为75%。
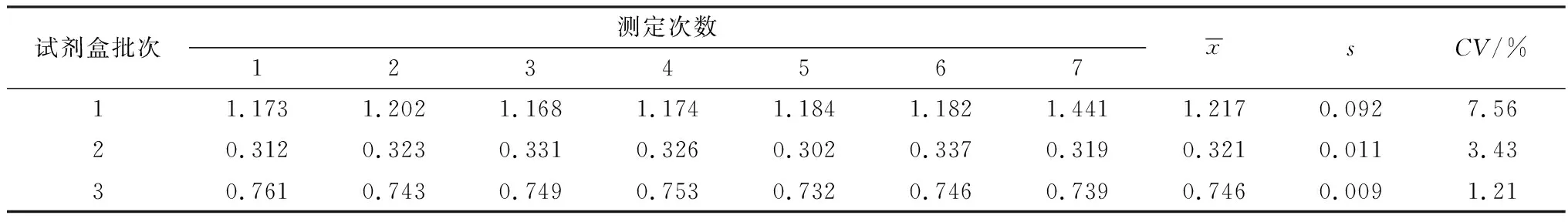
表1 批间重复性检测结果 D450值
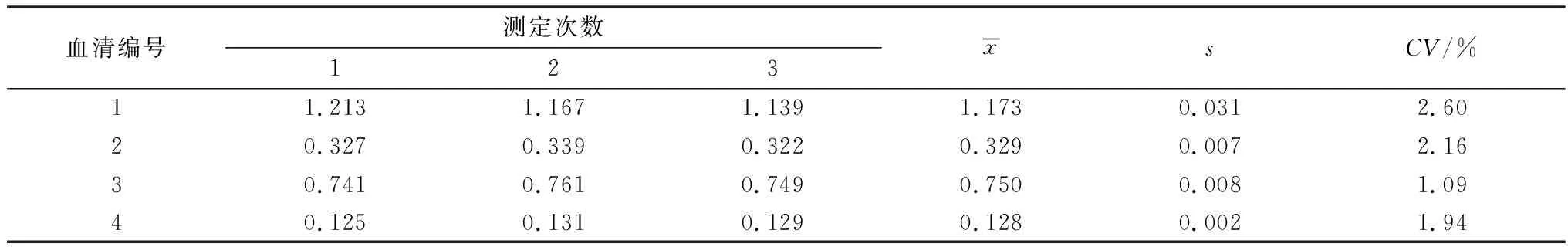
表2 批内重复性检测结果 D450值

表3 试剂盒敏感性检测结果

表4 试剂盒保存期检测

表5 ELISA试剂盒与HI结果的符合率
2.8 间接ELISA抗体检测试剂盒的初步应用用标准化PHEV间接ELISA抗体检测试剂盒检测来自吉林、山东、天津、辽宁、黑龙江等地区部分猪场的819份血清,结果如表6所示,上述地区猪群中PHEV抗体阳性率分别为62.56%,85.96%,71.11%,53.74%,60.75%;表明目前上述地区猪群中PHEV隐性感染率较高,且该检测试剂盒能够有效应用于临床PHEV抗体水平检测。
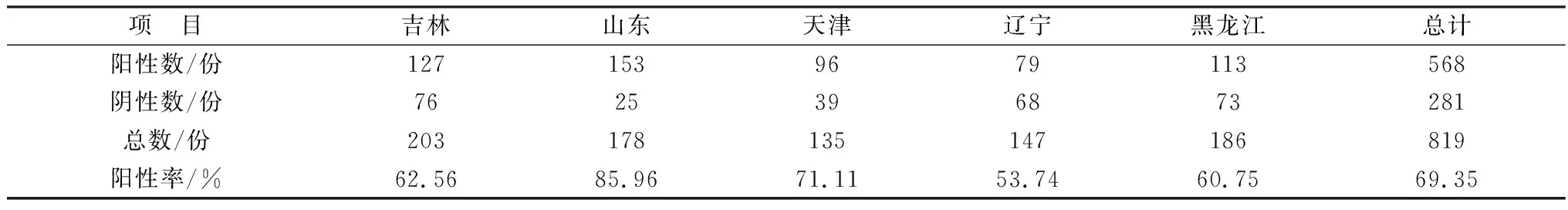
表6 819份血清样本的检测结果
3 讨论
猪血凝性脑脊髓炎于1958年在加拿大安大略省被首次发现,随后欧洲等国均有此病暴发的报道[2-4]。1962年,首次从患病仔猪脑组织中分离得到PHEV。近年来,有学者对该病进行血清学调查,发现该病的发病地域非常广泛,呈世界性分布[6]。目前,多种检测方法可诊断该病,如HI、中和试验以及ELISA方法等,其中ELISA方法具有操作上更加简单、快捷、方便、结果准确等特点[7-10],可用于大规模样本的检测,因此在临床应用上更多选用ELISA方法作为标准检测方法。
据报道,血清样品稀释度和作用时间与试验结果准确性和重复性密切相关[9-11]。在本试验中,通过控制变量法确定血清以1∶200稀释、作用时间为90 min时检测效果最佳。结合统计学原则,本试验确定当血清D450值>0.386判断为阳性,D450值<0.320 时判断为阴性,介于两者之间为可疑,则需要重检[10-12]。敏感性、特异性和重复性是判定ELISA试剂盒研制成功与否的关键[10-13]。本试验发现吉林、山东、天津、辽宁和黑龙江的部分猪场猪群中PHEV抗体阳性率较高,初步判定由于这几个省份为PHEV多发地区所致。由于本试验做了特异性试验,因此可以排除其他病原的交叉感染,故试验结果显示这5个地区的样品阳性率较高的另一原因可能为受检猪群在哺乳期疑似感染PHEV所致,经试验前期问诊得知许多受检猪场仔猪哺乳期都曾出现呕吐、腹泻以及轻微神经症状等疑似PHEV的临床症状。因此本研究对于我们今后对猪场猪血凝性脑脊髓炎的检测和监管,以及PHEV的防制都有着深远的指导意义。本试验中PHEV阳性血清稀释6 400 倍时,ELISA试剂盒判定结果仍为阳性,表明该试剂盒敏感性良好,可用于PHEV的临床监测。此外,本试验组装的试剂盒特异性良好,不同批次试剂盒检测结果稳定、重复性好,可放心应用于生产实践检测之中。
试剂盒的“保存期”为投入市场必须克服的瓶颈问题。本试验组装的试剂盒在4℃保存期为3个月,在我们后续研究工作中拟通过更换包被液、加入适量防腐剂等来延长试剂盒的保存期,已达到商品化试剂盒保存需求。HI试验的优点是操作简单、结果快速准确、结果容易观察辨别、可同时进行大量样本分析等。但是同样该方法缺点明显,对于样品、器材、操作、环境等因素影响较大,会导致敏感性和准确性降低,结果偏差大甚至误判。而ELISA检测具有速度快、敏感性高、特异性强等优点,得到的结果较为客观和准确。此外,ELISA检测结果易受时间、地点、环境温度、操作人员技术手法等影响[14-15],因此,在使用检测试剂盒时应严格按照试剂盒说明书和注意事项来操作。
综上所述,本试验研制的PHEV间接ELISA抗体检测试剂盒既可以作为HI检验的补充方法,也可以作为PHEV流行病学调查的有力工具,具有非常良好的应用前景。
