PRV变异株gB和gC基因分子特征及抗原差异性分析
2020-09-25万曾培王征帆庞旋飞王凤求王贵平李中圣白挨泉
万曾培,王征帆,庞旋飞,王凤求,王贵平,李中圣*,白挨泉*
(1.佛山科学技术学院,广东 佛山 528231;2.广东海大畜牧兽医研究院,广东 广州 511400)
猪伪狂犬病(pesudorabies,PR) 是由伪狂犬病病毒(pesudorabies virus,PRV)引起猪神经系统紊乱、呼吸系统疾病、生殖衰竭和发烧的急性传染病[1]。PRV属于疱疹病毒科(Herpesviridae)、甲型疱疹病毒亚科、猪疱疹病毒属。病毒粒子呈圆形或椭圆形,呈二十面体对称,直径150~180 nm[2]。PR主要损害母猪和哺乳仔猪,主要症状是母猪繁殖障碍,哺乳仔猪神经症状、呕吐及腹泻死亡,该病的流行没有特征的季节性,多发生在冬、春两季。病猪、带毒猪及带毒鼠是其主要传染源,除可通过猪群的相互接触发生传染外,还可经配种和空气等方式传播[3]。2011年底首先在我国天津发现生长育肥猪表现神经症状而死亡的变异PRV;2012年华北、华中、华东等地区也出现疫情;2013年扩散到广东、广西等;2014年福建、云南等地也出现疫情。到目前为止,变异PRV已成为危害我国养猪业的重要传染病病毒之一[4]。目前,我国关于PRV变异的主流观点有:LUO等[5]通过绵羊攻毒保护试验模型得出Bartha-K61不能提供完全保护而报道的毒力增强说;彭金美等[6]采用中和试验得出Bartha- K61疫苗株免疫原性没有发生变化但流行株存在一定抗原变异而报道的抗原变异说;GU等[7]和杨文萍等[8]分离的超强毒力抗原变异株PRV-ZJ01而报道的毒力增强兼抗原变异说。为探究变异PRV流行毒株遗传突变规律及其与经典毒株抗原性差异,对本团队近4年来分离的3株(GD1406、FS2015、FJFZ株)变异PRV的gB和gC全基因进行扩增、测序及生物信息学分析,并应用微量交叉中和试验进行PRV-GD1406与PRV-Bartha K61之间抗原差异性分析。
1 材料与方法
1.1 试验动物及细胞12头4周龄断奶仔猪购自四川某健康猪场,未免疫猪伪狂犬病疫苗及未感染PRV野毒株。Vero细胞,由广东海大畜牧兽医研究院保存。
1.2 疫苗和病毒PRV-GD1406株、PRV-FS2015株、PRV-FZFJ株由广东海大畜牧兽医研究院保存;PRV-GD1406株活疫苗由本室制备;PRV-Bartha K61毒株及其疫苗由四川海林格生物制药有限公司惠赠。
1.3 主要试剂AXYGEN病毒提取试剂盒,LA Taq聚合酶、DNA Marker、2×GC BufferⅠ、dNTP mixture (2.5 mmol/L)皆购于宝生物工程(大连)有限公司;DMEM培养液、胰酶和胎牛血清均购自Gibco公司。
1.4 病毒繁殖分别将PRV-GD1406、FS2015、FJFZ和Bartha K61株病毒按1%维持液的量接种于Vero细胞瓶,置5%二氧化碳培养箱37℃培养,每天观察细胞病变(CPE),当病变达80%时收集并冷冻于-20℃,反复冻融3次后,收取细胞毒,-80℃保存备用。
1.5 病毒DNA提取及引物设计与合成取细胞毒12 000 r/min离心5 min后取上清液,严格按照DNA提取试剂盒说明书进行提取。根据GenBank中已发表PRV的gB、gC基因序列(登录号:KU315430.1),使用Primer Premier 6.0软件设计2对特异性引物用于扩增gB、gC全基因序列,引物由生工生物工程(上海)股份有限公司合成(表1)。
1.6 PCR扩增及测序以提取的DNA为模板,分别进行gB、gC基因的PCR扩增。PCR反应体系为50 μL:LA Taq酶0.5 μL,核酸DNA模板2 μL,上、下游引物各2 μL,dNTP 6 μL,2×GC BufferⅠ25 μL、ddH2O 补足体系。PCR反应条件:94℃ 4 min;94℃ 45 s,58℃ 45 s,72℃ 60 s,36个循环;72℃ 10 min,12℃保存。取PCR扩增产物8 μL于1%琼脂糖凝胶电泳30 min,凝胶成像系统观察结果。纯化回收片段,送往上海立菲生物技术有限公司测序。
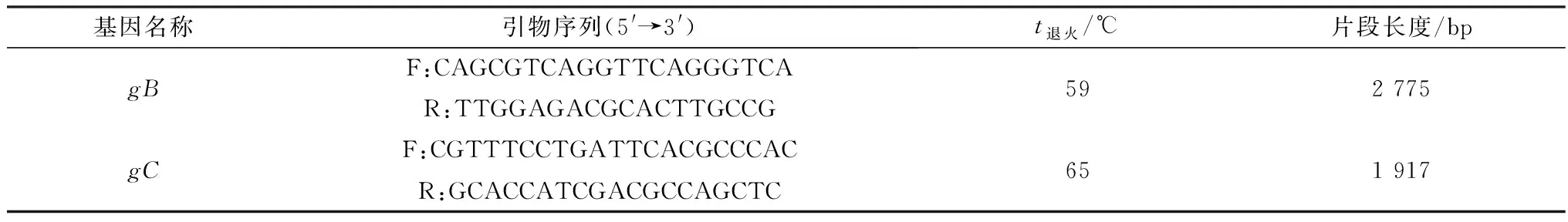
表1 引物序列、退火温度及扩增片段长度
1.7gB、gC基因分子特征分析利用DNAStar和 MEGA7.0软件将获得的gB、gC基因主要抗原表位区的核苷酸序列和推导出的氨基酸序列与PRV参考株的gB、gC基因序列进行遗传演变分析,突变位点分析,并绘制遗传进化树。
1.8 病毒TCID50测定及高免血清制备将PRV-GD1406、PRV-Bartha K61病毒用维持液做10倍系列稀释后,接种于已长成单层Vero 96孔细胞培养板,每一个稀释度接种8孔,接种量100 μL/孔,并设对照组,置于37℃、5.5%CO2培养箱培养,每天观察并记录病变情况,一直观察至第7 天,判定出现CPE孔数,按Reed-Muench法测定TCID50。高免血清制备:将12头4周龄PRV阴性断奶仔猪随机分为3组,其中第1组5头肌注1 mL含107.0TCID50的PRV-GD1406株;第2组5头肌注1 mL的PRV-Bartha K61株疫苗;第3组空白对照2头肌注生理盐水代替疫苗做相同处理。2周后进行二免,每周采血并分离血清,置于-20℃备用。
1.9 微量交叉中和试验及抗原差异性分析标准采用固定病毒稀释血清法测定猪抗Bartha K61高免血清和猪抗GD1406高免血清对2株病毒株(Bartha K61和GD1406)的中和抗体效价。先将二免后2周的高免血清56℃水浴30 min灭活后进行2倍比系列稀释,分别取不同稀释度血清与100个TCID50等量混合,37℃作用1 h后接种到长满单层Vero细胞的 96 孔板,每个稀释度接种 4孔,每孔接种 0.1 mL,同时设正常细胞、不同毒株的对照组。置37℃、5.5%CO2培养箱培养,每天观察并记录细胞病变情况,连续观察7 d,计算高免血清的中和抗体效价(PD50)及其与不同毒株交叉反应程度相关系数(R)。严格按照杜念兴[9]在《兽医免疫学》中提出的抗原相关性判定标准进行抗原差异性分析。
2 结果
2.1gB、gC基因扩增结果经PCR扩增后,凝胶电泳结果显示,GD1406、FS2015、PRV-FJFZ株的gB和gC基因长约为2 775 bp和1 917 bp,符合预期片段大小。
2.2gB基因序列分析gB基因核苷酸及氨基酸序列与参考毒株比对分析显示:3株变异毒株gB基因核苷酸序列58位由C→T的替换,593位与594位由TC→CG的替换,2 320位由C→G的替换,2 340位与2 341位由AC→CG的替换,2 344位与2 345之间插入CCG。相应的氨基酸序列220位由P→S的替换,198位由P→L的替换,762位由P→A的替换,780位由E→D的替换,782位插入PV。gB基因核苷酸及氨基酸同源性分析:3株PRV变异株之间gB基因核苷酸和氨基酸同源性分别为99.7%~100.0%和99.6%~100.0%。它们与国内ZJ01株、TJ株、BJYT株、JS2012株、HeN1株同源性最高,核苷酸和氨基酸同源性分别为99.6%~100.0%和99.4%~100.0%;与LA株同源性次之,核苷酸和氨基酸的同源性分别为99.4%和99.2%(图1)。基于gB基因系统进化树遗传进化分析显示,系统进化树分为两大支,其中一大支为国内经典毒株群、2011年后分离的变异毒株群2个小分支所占据的中国毒株群,其中PRV-FS2015株、PRV-FJFZ株、PRV-GD1406株与Ea株、SC株亲缘关系最近;另一大支为欧洲分离株和美洲分离株组成的欧美毒株群(图2)。
2.3gC基因序列分析gC基因核苷酸及氨基酸序列与参考毒株比对分析显示:3株PRV变异株gC基因核苷酸序列46位由A→G的替换,128位由A→G的替换,154位由C→T的替换,164位由C→A的替换,199位与200位由GA→AC的替换,202位至204位由GCG→CCC的替换,206位与207位由GC→CC的替换,210位由G→C的替换,260位由C→A的替换,268位由A→C的替换,304位由G→T的替换,728位由G→A的替换,1 345位由G→A的替换,1 381位与1 382位由GT→AC的替换,1 451位与1 452位由AG→GT的替换,1 457 位由G→C的替换,1 460位由C→T的替换。相对应的氨基酸16位由A→T的替换,43位由A→E的替换,52位由P→S的替换,55位由A→E的替换,67~69位由EAG→TPA的替换,87位由P→Q的替换,90位由N→G的替换,102位由A→S的替换,243位由S→H的替换,449位由A→T的替换,461位由V→T的替换,467位由T→A的替换,465位至487位由AGP→SAL的替换。gC基因核苷酸及氨基酸同源性分析:3株变异PRV之间gC基因核苷酸和氨基酸同源性分别为100.0%和99.0%~100.0%。它们与国内ZJ01株、JS2012株、GDHZ株、HN1201株同源性最高,核苷酸和氨基酸同源性分别为99.9%~100.0%和99.9%~100.0%;与SC株、TJ株、Ea株同源性次之,核苷酸和氨基酸的同源性分别为96.7%~99.7%和99.3%~99.7%(图3)。基于gC基因系统进化树遗传进化分析显示,系统进化树分为两大支,其中一大支由国内经典毒株SL株、SN株及国外PRV毒株形成的毒株进化群。另一大支由国内经典毒株及2011年后分离的变异毒株群所形成的毒株进化群,其中马来西亚分离株P-PRV株与LA株、FA株、SA215株形成一个小亚群,2011年后分离的变异流行株形成一个小亚群,Ea株、SC株、TJ株形成一个小亚群;其中PRV-FS2015株、PRV-FJFZ株、PRV-GD1406株与Ea株、SC株、TJ株亲缘关系最近(图4)。
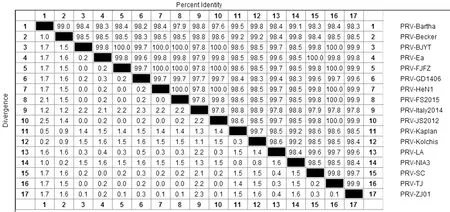
图1 PRV-GD1406、FS2015、FJFZ株与其他参考毒株gB基因的核苷酸同源性分析
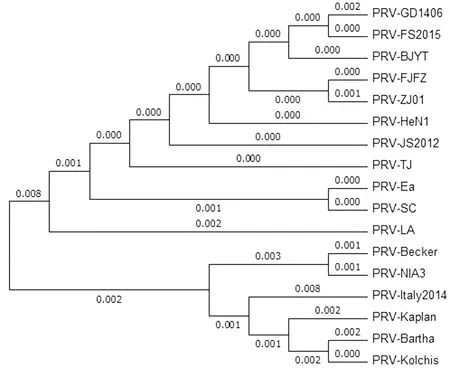
图2 PRV-GD1406、FS2015、FJFZ株gB基因系统进化树
2.4 病毒繁殖与病毒TCID50测定结果PRV-GD1406株和PRV-Bartha K61株分别接种Vero细胞后12~18 h均出现细胞病变,表现为细胞圆缩并发亮、聚集、拉网;折光性增强,形成不同形态的合胞体(图5)。PRV-GD1406株和PRV-Bartha株TCID50分别为10-5.52/0.1 mL和10-6.67/0.1 mL。
2.5 血清交叉中和试验猪抗PRV-Bartha K61高免血清中和PRV-GD1406、PRV-Bartha K61结果见表2,猪抗PRV-GD1406高免血清中和PRV-GD1406、PRV-Bartha K61结果见表3。按Reed-Muench法计算中和抗体效价(PD50),猪抗PRV-Bartha K61高免血清中和PRV-GD1406、PRV-Bartha K61的中和抗体效价分别为22和53;猪抗PRV-GD1406高免血清中和PRV-GD1406、PRV-Bartha K61的中和抗体效价分别为37和44。


图3 PRV-GD1406、FS2015、FJFZ株与其他参考毒株gC基因的核苷酸同源性分析
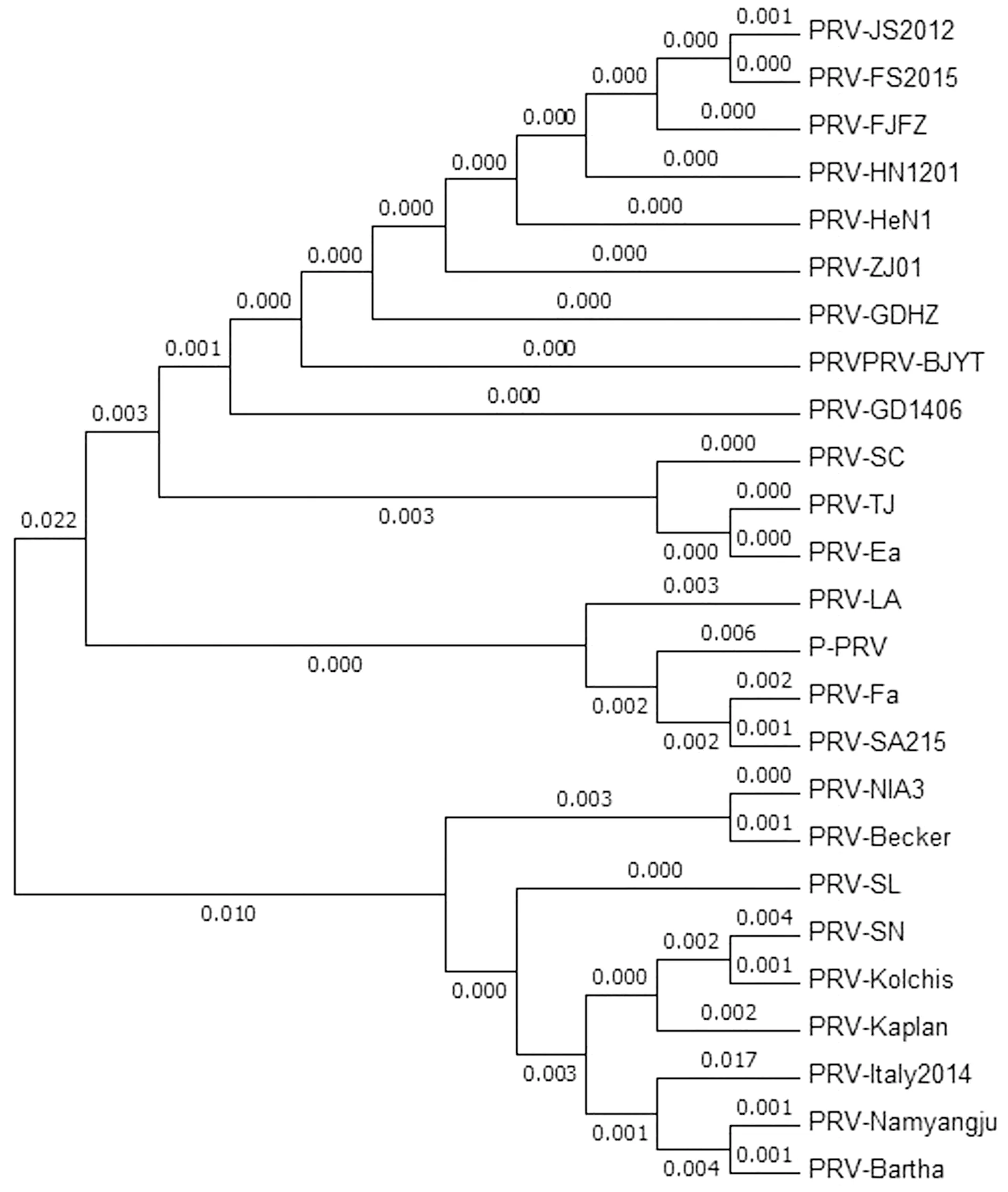
图4 PRV-GD1406、FS2015、FJFZ株gC基因系统进化树
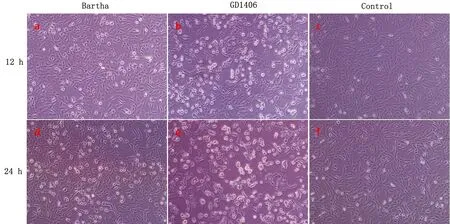
图5 PRV-GD1406株、PRV-Bartha K61株感染Vero细胞不同时间段细胞病变情况

表2 猪抗PRV-Bartha K61高免血清中和PRV-GD1406、PRV-Bartha K61结果
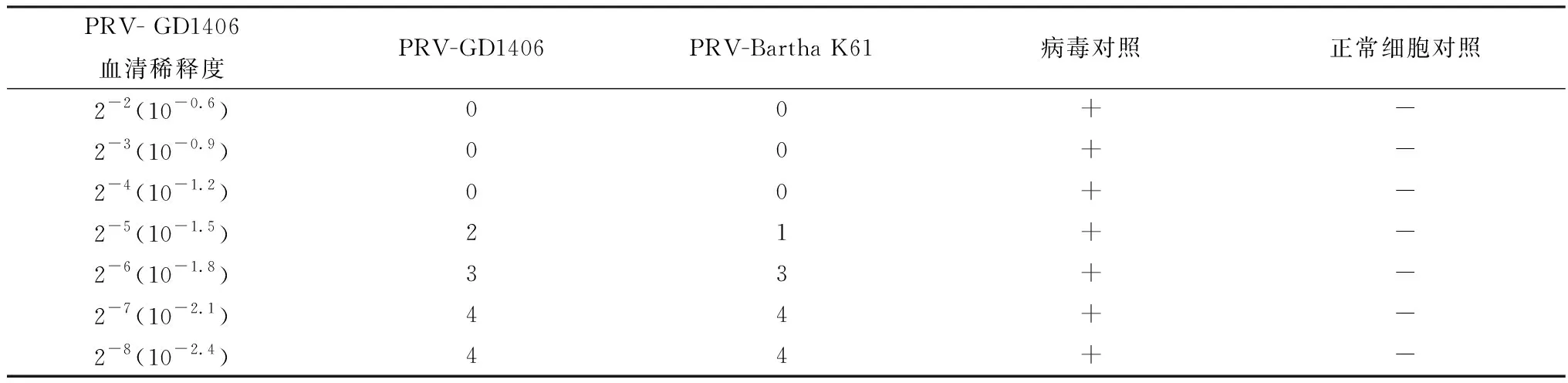
表3 猪抗PRV- GD1406高免血清中和PRV-GD1406、PRV-Bartha K61结果
3 讨论
2011年底从华北地区的天津暴发变异伪狂犬病以来,猪伪狂犬病呈日趋严重的形势[10-12]。据报道,变异伪狂犬病症状为哺乳仔猪呕吐腹泻(黄绿色水样)、神经症状(转圈)、拒食、呼吸衰竭;断奶仔猪咳嗽、流涕、呼吸困难、呕吐腹泻、神经症状等;育肥猪呕吐腹泻、咳嗽甚至死亡;配种母猪繁殖障碍、返情率高;怀孕母猪大量流产,产死胎或木乃伊胎[13]。gC蛋白是病毒附着靶细胞及传播的主导蛋白,也是PRV主要免疫原性蛋白之一;PRV抗体的主要靶蛋白是gB蛋白,gB基因是病毒复制过程中必不可少的主要基因之一;因此对PRV变异毒株gB、gC基因进行比对及遗传演变分析在一定程度上能反映病毒变异情况[14-18]。本试验通对近4年从广东、福建等省份分离鉴定并保存的3株变异PRV进行gB、gC全基因扩增测序和分析发现,3株PRV变异株之间gB、gC基因核苷酸和氨基酸同源性极高,与2011年后分离的流行毒株ZJ01、JS2012等同源性较高,与国内外经典毒株同源性次之。3株变异PRV与2011年之后的变异株亲缘关系较近,与国内经典毒株Ea、SC、TJ亲缘关系次之,与国外经典毒株Bartha、Becker、Kaplan亲缘关系较远。3株变异PRV核苷酸及氨基酸多序列比对发现,gB、gC基因的核苷酸及氨基酸序列有多个位点的突变。
利用微量交叉中和试验进行抗原差异性分析进一步验证变异PRV抗原表位是否发生变化,结果表明变异PRV的抗原表位存在一定程度变异。但PRV-GD1406和PRV-Bartha K61这2个毒株间交叉反应程度相关系数R>70%,表明变异毒株与经典毒株处于同一个血清型没有发生变异。PRV-Bartha K61对变异PRV仍有一定的保护,但中和抗体水平较低,对变异毒株中和能力差。而PRV-GD1406株接种后产生的抗体水平高,对Bartha K61株具有较高的交叉中和能力且为单向交叉,提示PRV-GD1406株有望成为预防变异PRV的疫苗候选株,扩大应用范围。本研究结果与程晓霞等[19]、彭金美等[20]、ZHOU等[21]的相似,支持抗原变异学说。变异PRV不仅给未开展净化工作的猪场、地区造成了严重危害,还严重威胁已净化伪狂犬病的猪场和地区。因此,本试验结果为猪伪狂犬病的防控起到一定的指导性作用,猪场在选用PRV-Bartha K61株疫苗制定免疫程序防控新型伪狂犬病时,应考虑抗原量高低、作用时间和免疫次数等因素,以达到较高的中和抗体水平。本试验可为防控净化PRV工作和疫苗毒株的筛选提供理论依据,但经典毒株与变异毒株间的交叉免疫保护效果还有待动物试验进一步验证。
