血浆蛋白对调理猪排品质特性的影响
2020-09-23张万刚徐宝才
张 洁,吴 香,张万刚,李 聪,徐宝才,3,*
(1.南京农业大学食品科技学院,江苏南京 210095;2.肉品加工与质量控制国家重点实验室,江苏雨润肉食品有限公司,江苏南京 211806;3.合肥工业大学食品与生物工程学院,安徽合肥 230601)
调理猪排是以生鲜肉为原料,经过修整、注射、滚揉、灌装、切片等工序,以包装或散装的形式在-18 ℃下冻藏,经简单的烹调处理即可直接食用的肉制品[1]。但在冻藏过程中,调理猪排存在着色泽变暗、汁液损失率高、保水能力差、质构特性下降等缺陷[2-3],限制了其发展。为解决品质下降的问题,通常在生产加工过程添加蛋白或多糖等辅料,以此改善产品质构特性,提高保水性。
大豆分离蛋白(Soy protein isolate,SPI)、鸡蛋白(Egg white protein,EWP)是提高肉制品品质的两大类动植物蛋白,研究表明,大豆分离蛋白中的7S、11S蛋白可赋予其优良的保水性、凝胶性和乳化性[4-6]。鸡蛋白最重要的功能特性之一是通过形成热诱导凝胶来提高产品的硬度,并提供一种传递营养和风味的物质,赋予食品独特的质地[7]。但是大豆分离蛋白添加量过多会产生严重的豆腥味,使产品变软,影响产品口感。鸡蛋白经济效益低,并且存在过敏性问题,因此开发在肉制品中应用的新型蛋白至关重要。
血浆蛋白(Blood plasma,BP)为猪血副产物,营养成分丰富,富含人体所必需的氨基酸。血浆蛋白中含有丰富的球蛋白,其中α、β和γ三种组分能赋予蛋白一些功能特性,如乳化性、起泡性、凝胶性、吸水性等[8],可作为肉类固化剂、结合剂、脂肪代替物,增加产品营养成分等[9]。欧美一些国家已在乳化香肠、牛肉饼和猪肉糜中添加血浆蛋白,用来提高产品产量并延长货架期[10]。血浆蛋白还可被用作法兰克福香肠中磷酸盐的替代品,提高了香肠的硬度和咀嚼性[11]。美国已实现猪血的深加工产业化生产,而目前我国生猪血液除应用于血肠、血豆腐、动物饲料外,大部分被遗弃。所以猪血副产物仍处于研究阶段,存在利用率不高、环境污染、资源浪费等问题[12],因此开发利用血浆蛋白等猪血副产物成为当前的研究热点。
本文通过将血浆蛋白添加到调理猪排中(大豆分离蛋白、鸡蛋白为对照),通过对保水性、质构、凝胶强度、微观结构和色泽的分析,评价血浆蛋白的功能特性,为血浆蛋白在调理肉制品中的应用提供一定的理论依据。同时,为血浆蛋白在肉制品中深加工应用标准化提供理论指导。
1 材料与方法
1.1 材料与仪器
猪肉3号肉,食盐、白砂糖、味精、白胡椒、姜粉、三聚磷酸钠、大豆分离蛋白、鸡蛋白 江苏雨润肉食品有限公司配料间提供;谷氨酰胺转氨酶(TG酶) 泰兴市东圣生物科技有限公司;血浆蛋白 南京创冠食品有限公司;碳酸氢钠 南京甘汁园糖业有限公司;NaCl、MgCl2、KH2PO4、乙二胺四乙酸(EDTA) 上海阿拉丁有限公司;以上试剂均为分析纯。
VT-20真空滚揉机 瑞士Suhner AG公司;CR-400色彩色差计 日本柯尼卡美能达有限公司;HH-6数显恒温水浴锅 国华电器有限公司;TAXT plus质构仪 英国 Stable Micro System公司;PQ 001 Micro低场核磁共振仪 上海纽迈科技有限公司;Phenom台式扫描电镜 飞纳科学仪器(上海)有限公司;MCR302流变仪 奥地利安东帕有限公司。
1.2 实验方法
1.2.1 调理猪排的制作工艺流程
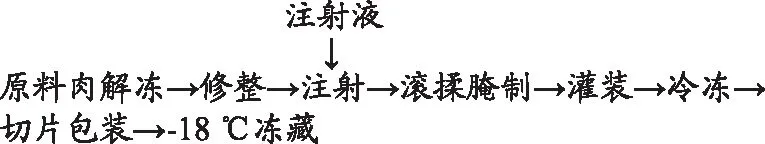
操作要点:
原料肉切块:将猪肉原料中的脂肪、筋膜剔除后切割成体积约为10 cm×10 cm×2.5 cm,质量约为250 g大小的肉块备用。
注射液配方:以原料肉质量比计:盐1.5%、味精0.3%、糖0.5%、白胡椒0.1%、三聚磷酸钠0.5%、碳酸氢钠0.1%、姜粉0.2%、冰水30%。在上述配方中分别加入不同浓度的血浆蛋白、大豆分离蛋白、鸡蛋白。
滚揉腌制:将70%注射液进行注射,剩余30%放入滚揉机中。滚揉条件参照汪小帆等[13]的方法并适当改动:腌制温度0~4 ℃,真空度<70 kPa,转速20 r/min,滚揉时间20 min,间歇时间10 min,滚揉总时长2 h。
灌装及冷冻:将腌制好的肉块灌入纤维肠衣中,放入-18 ℃冰柜冷冻2 d定型后切片,猪排大小为直径8.5 cm,厚度2 cm,封口后于-18 ℃冰柜冷冻5 d后测定各指标。
1.2.2 适宜蛋白添加量的选择 分别将血浆蛋白(0、1.5%、2.0%、2.5%、3.0%)、大豆分离蛋白(0、2.5%、3.0%、3.5%)、鸡蛋白(0、2.0%、2.5%、3.0%)与注射液混合后,添加到调理猪排中,以解冻损失、水分分布变化两种指标确定调理猪排中适宜蛋白添加量。确定适宜蛋白添加量后,以3.0%大豆分离蛋白、2.5%鸡蛋白为对照,测定2.5%血浆蛋白对冷冻调理猪排品质的影响。
1.2.3 解冻损失的测定 取解冻后调理猪排(25.0±0.2 g),用滤纸吸去表面残留水分,解冻损失率按下列公式进行计算[14]。
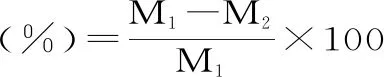
式(1)
式中:M1为样品解冻前质量,g;M2为样品解冻后质量,g。
1.2.4 压榨损失的测定 检测方法参考贾小翠等[15]的测定方法,将猪排切成2 cm×2 cm×2 cm,用质构仪进行测定。采用探头P/50,参数如下:测前速度1.00 mm/s,测试速度0.50 mm/s,测后速度10.00 mm/s,压力2000 g,压缩时间180 s,触发类型为自动,触发力5.0 g。压榨损失率计算公式如下:
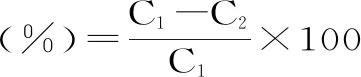
式(2)
式中:C1为样品压榨前质量,g;C2为样品压榨后质量,g。
1.2.5 低场核磁水分分布的测定 将解冻后猪排切成2 cm×2 cm×2 cm(2.0±0.2 g)的肉样,放入直径为13 mm核磁管中,选用CPMG序列进行测定[16],质子共振频率为21 MHz。测试参数为:回波时间为0.25 ms,重复扫描32次,间隔时间3500 ms,得到3200个回波数。测得数据用仪器自带的Multi Exp Inv Analysis软件进行反演,得到对应的峰面积所占比例。
1.2.6 质构特性的测定 将猪排切成2 cm×2 cm×2 cm大小,进行TPA模式测定。采用探头P/50,参数如下[17]:测前速度1.00 mm/s,测试速度5.00 mm/s,测后速度5.00 mm/s,压缩距离7.00 mm,压缩间隔为5.00 s,触发力5.0 g。
1.2.7 肌原纤维蛋白的提取及凝胶强度与流变特性的测定 肌原纤维蛋白的提取:肌原纤维蛋白提取方法参照Han等[18]的提取方法并作修改,将猪肉切块,在肉中加4倍体积提取液(0.1 mol/L NaCl,20 mmol/L K2HPO4,2 mmol/L MgCl2,1 mmol/L EDTA,pH7.0),高速匀浆机匀浆(14000 r/min,1 min,冰浴),将制得的悬浮液于离心机中离心(3500×g,15 min,4 ℃),弃上清液,上述步骤重复三次得到粗提肌原纤维蛋白。
在粗提的肌原纤维蛋白中加入4倍体积0.1 mol/L NaCl溶液,高速匀浆(14000 r/min,1 min,冰浴)后取离心(3500×g,15 min,4 ℃),取沉淀加入四倍体积NaCl溶液,匀浆后过40目筛,取滤液重复提取2次,得到的沉淀即为纯化的肌原纤维蛋白,采用双缩脲法测定其蛋白质浓度,最终绘制标准曲线为y=0.1048x-0.0965,R2=0.9986,蛋白浓度为80 mg/mL,提取的蛋白于4 ℃冰箱保存。
凝胶强度的测定:将肌原纤维蛋白溶于0.6 mol/L KCl缓冲溶液,蛋白浓度稀释到70 mg/mL。取20 g肌原纤维蛋白于25 mL烧杯中,以2 ℃/min从20 ℃升温到80 ℃,保温30 min后取出冷却到室温,4 ℃冰箱存放12 h后使用。采用质构仪进行测定,参数设定如下[19]:测前速度1 mm/s,测试速度5 mm/s,测后速度5 mm/s,压缩比为50%,探头P0.5R,负载类型为Auto-5 g。
流变特性的测定:将蛋白样品用KCl缓冲溶液(0.6 mol/L)稀释至30 mg/mL,分别加入0、2.5%BP,3.0%SPI和2.5%EWP,混合均匀测定其流变性,采用50 mm平板,狭缝为1 mm,应变力为2%,频率为0.1 Hz,温度从20~80 ℃,按0.05 ℃/s升温,为防止水分蒸发,在平板上加上盖子[20-21]。每个处理测定三次平行。
1.2.8 扫描电镜微观结构观察 将解冻后猪排切成1.5 mm3左右大小[22],用电镜专用导电胶将样品固定在操作台上,冷凝温度为-13 ℃,待样品冻结后放入扫描电镜显微镜下观察并拍照,放大倍数为1000倍,电压5 kV。
1.2.9 色差值的测定 按照Rendón等[23]测定方法适当改动,将冷冻过的调理猪排解冻到样品中心温度达2 ℃左右时,取出样品,用滤纸吸去表面多余的水分,再用色差仪测定表面颜色。测定前用白板进行仪器校准,测量区域为8 mm,选用D65光源(10 °),结果用L*(亮度)、a*(红/绿),b*(黄/蓝)表示。
1.3 数据处理
本研究实验数据全部采用Origin 8.0进行绘图,SPSS 17.0进行结果分析,数据的差异显著性评定采用邓肯多重比较,P<0.05表示显著性差异。每个水平设置3个平行,重复测定5次。
2 结果与分析
2.1 蛋白添加量的确定
2.1.1 血浆蛋白添加量对调理猪排解冻损失和水分分布的影响 由图1可知,随着血浆蛋白添加量增加,调理猪排的解冻损失明显下降,空白组解冻损失率为2.08%,添加1.5%、2.0%、2.5%、3.0%血浆蛋白后解冻损失下降至1.14%、1.12%、0.67%、0.70%,其中2.5%血浆蛋白损失率最低。图1出现3个特征峰,分别为T21(结合水)、T22(不易流动水)和T23(自由水),表1中P21、P22、P23分别代表T21、T22、T23三个峰峰面积值,添加2.0%、2.5%、3.0%血浆蛋白能显著增大P22(P<0.05),说明血浆蛋白能增加猪排中不易流动水含量,当添加量为2.5%时,P22值最大,为95.27%。可见,血浆蛋白能提高猪排的持水性,在冷冻过程中,降低肌原纤维和肌浆蛋白结构破坏程度,防止机械损伤造成的细胞膜破裂,细胞液渗出,但添加量过高时,持水性不再增强。
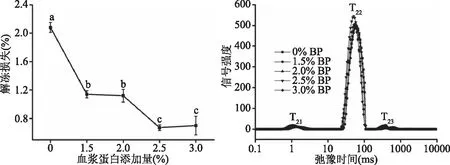
图1 血浆蛋白添加量对调理猪排解冻损失、水分迁移的影响
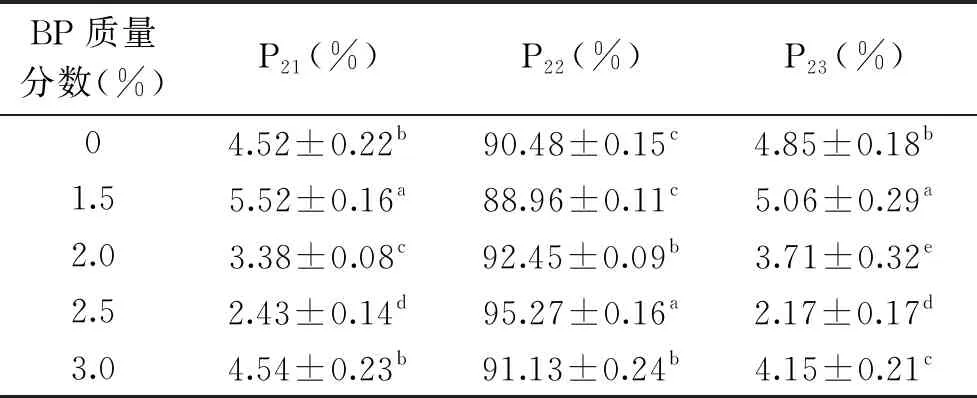
表1 血浆蛋白添加量对调理猪排弛豫峰峰面积比例的影响
2.1.2 大豆分离蛋白添加量对调理猪排解冻损失和水分分布的影响 由图2可知,随着大豆分离蛋白添加量增加调理猪排的解冻损失先下降后上升,与空白组相比,解冻损失显著下降(P<0.05)。空白组解冻损失率为2.26%,添加2.5%、3.0%、3.5%大豆分离蛋白后解冻损失下降至0.77%、0.64%、1.66%,其中3.0%大豆分离蛋白损失率最小,添加量超过3.0%解冻损失反而升高。表2中可以看出,添加2.5%、3.0%、3.5%大豆分离蛋白均能显著增大P22(P<0.05),猪排中不易流动水含量增加,当添加量为3.0%时,P22值最大,为97.89%。大豆分离蛋白中的7S、11S蛋白能与水发生水化作用,抑制冰晶生长和重结晶现象,防止肌纤维变性,提高猪排保水性。
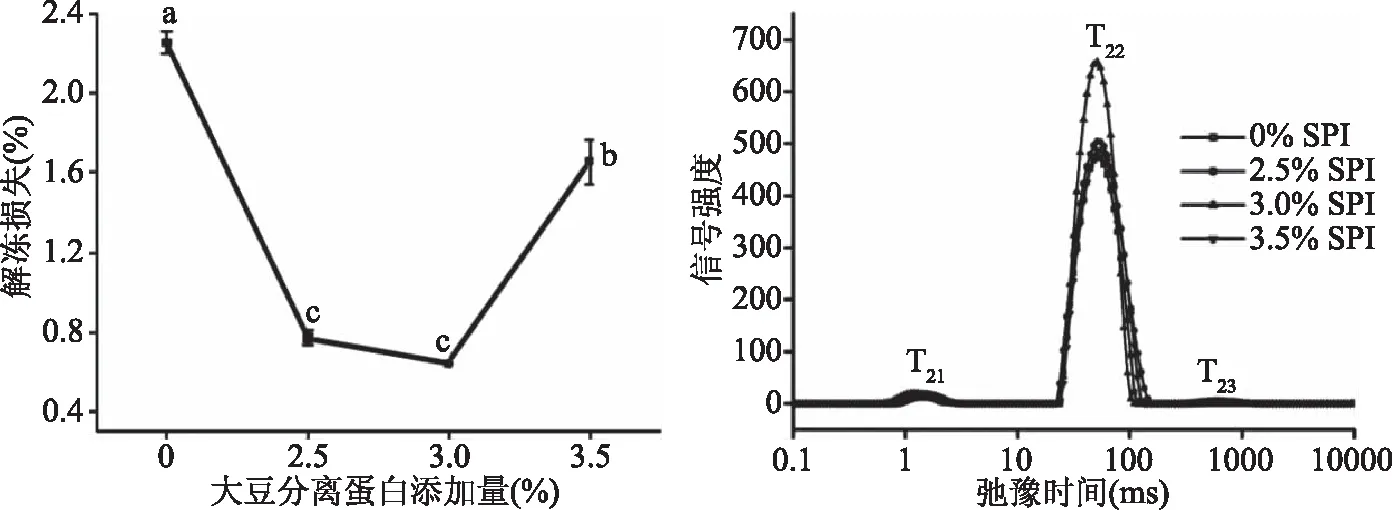
图2 大豆分离蛋白添加量对调理猪排解冻损失、水分迁移的影响
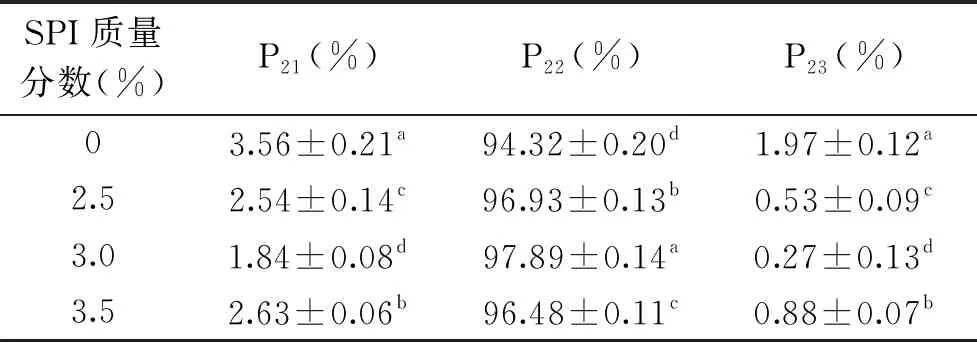
表2 大豆分离蛋白添加量对调理猪排弛豫峰峰面积比例的影响
2.1.3 鸡蛋白添加量对调理猪排解冻损失和水分分布的影响 由图3可知,鸡蛋白能显著降低调理猪排的解冻损失(P<0.05),空白组解冻损失率为2.55%,添加2.0%、2.5%、3.0%鸡蛋白后解冻损失下降至1.38%、1.01%、2.15%,其中2.5%鸡蛋白损失率最小。这是因为适量的鸡蛋白通过氢键改进水的吸收,增加产品粘着性,从而束缚更多水分,增强保水性。表3中可以看出,添加2.0%~3.0%鸡蛋白均能显著增大P22(P<0.05),不易流动水含量增加,当添加量为2.5%时,P22值最大,为97.37%。
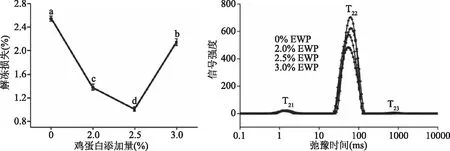
图3 鸡蛋白添加量对调理猪排解冻损失、水分迁移的影响
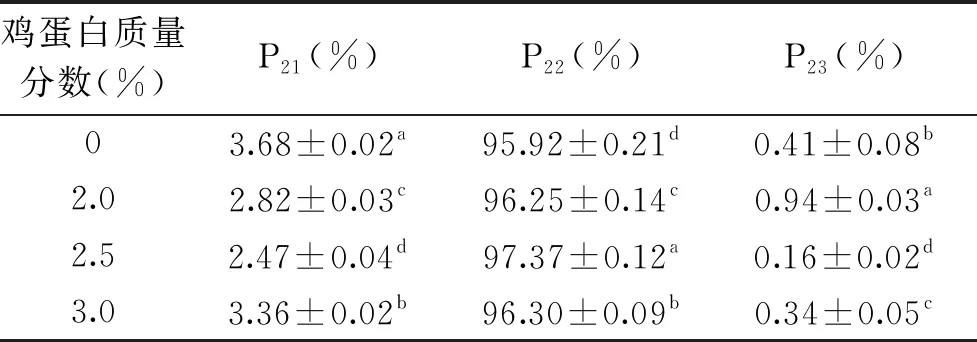
表3 鸡蛋白添加量对调理猪排弛豫峰峰面积比例的影响
综上,确定血浆蛋白、大豆分离蛋白、鸡蛋白最佳添加量分别为2.5%、3.0%、2.5%,为控制猪肉批次等变量,将上述三种蛋白最佳浓度重新添加到猪排中,进行后续指标的检测。
2.2 血浆蛋白对调理猪排解冻损失、压榨损失的影响
肉制品经冷冻贮藏后需要解冻后才可加工使用,在解冻过程中会伴随着汁液损失,解冻损失、压榨损失是评价肉制品保水性的重要指标[24]。由图4可知,血浆蛋白能显著降低调理猪排的解冻损失、压榨损失(P<0.05),且在三种蛋白组中降低效果最好。解冻损失率由2.26%降低至0.48%,压榨损失比空白组下降了2.1倍,由9.92%降低至4.67%。
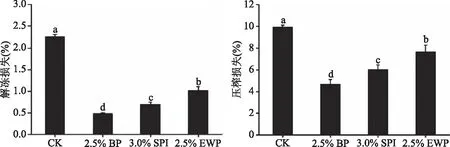
图4 血浆蛋白对调理猪排解冻损失、压榨损失的影响
肌原纤维中含有大量不易流动水,其体积变化决定猪排中水分的得失,水分含量的变化取决于肌原纤维原始结构的变化[25]。冻结过程中,肌纤维内部的水分外移形成冰晶,冰晶聚集损坏肌纤维和肌浆蛋白分子之间的空间结构,造成解冻损失率增大。添加血浆蛋白后解冻损失率降低,说明血浆蛋白在冷冻条件下会抑制冰晶生长,同时降低冰点,防止重结晶现象,降低肌原纤维和肌浆蛋白结构破坏程度。Stangierski等[26]也表明,在冷冻期间添加牛血浆蛋白后,肌原纤维蛋白的破坏性变化最小。在解冻过程中,肌肉氧化引起肌原纤维的横向收缩,肌肉细胞体积减小,细胞间隙增大,增加了水在肌肉组织中的扩散[27]。当进行压榨时,肌肉中的水分流失增加,肌肉的保水性下降。血浆蛋白能降低猪排压榨损失率,说明它有利于维持猪排的组织结构。
2.3 血浆蛋白对调理猪排水分分布的影响
LF-NMR[19]是一种新型安全的光谱检测技术,用来测量自旋-自旋弛豫时间(T2),可以快速分析出样品中的水分分布状态和移动性。图5表示血浆蛋白对调理猪排解冻后水分分布情况,图中共出现3个特征峰,分别为T21、T22和T23,分别表示猪肉组织中与蛋白质等大分子结合的结合水、存在于肌原纤维和细胞中的不易流动水和存在于细胞外的自由水。在肌肉组织中,不易流动水占肌肉所有水分的80%,存在于肌原纤维蛋白基质内部,是决定肉制品保水性的关键部分[27],T22峰面积越大,P22值越大,表明存在于猪排中的不易流动水含量越高,猪排的保水性越好。从表4中可以看出,血浆蛋白对调理猪排水分迁移影响显著(P<0.05),P22显著增大(P<0.05),调理猪排中不易流动水最多,P22为94.30%,比空白组、大豆分离蛋白组、鸡蛋白组分别提高了17.65%、5.62%、12.01%。血浆蛋白具有良好的溶解性是使不易流动水增多的原因,溶解度是蛋白质在溶液中溶解并形成均匀溶液的能力,它是蛋白质功能性的一个重要前提和指标,研究表明,在pH>4时,血浆蛋白的总溶解度在80%~100%之间[28]。溶解度极好,吸水能力强,在猪排冻藏过程中保留大部分细胞内水分,将水分束缚于细胞中,防止水分流失,使得其持水能力增强,大部分自由水向不易流动水迁移,因此P22峰面积增大。
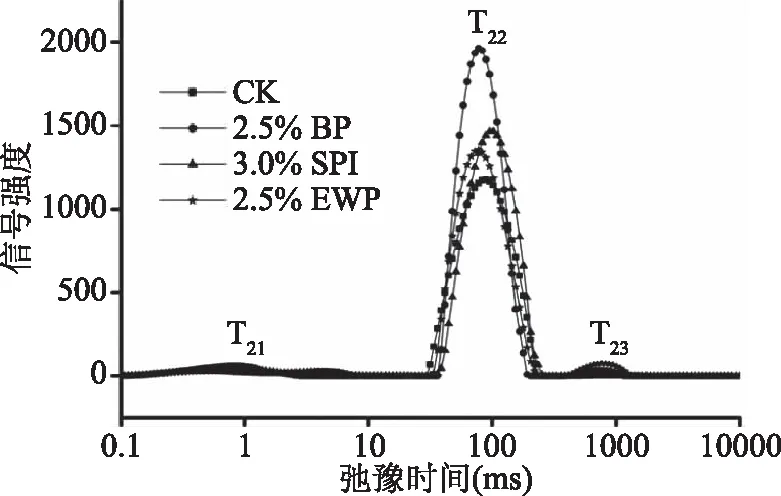
图5 血浆蛋白对调理猪排水分迁移的影响

表4 血浆蛋白对调理猪排弛豫峰峰面积比例的影响
2.4 血浆蛋白对调理猪排质构特性的影响
由表5可知,血浆蛋白能明显提高调理猪排的硬度、弹性、咀嚼性,硬度值由2953.34 g提高到6025.39 g,弹性值由0.62升高到0.73,咀嚼性是空白组的1.5倍左右,且硬度、弹性、咀嚼性均高于大豆分离蛋白组,因为血浆蛋白中含有较大比例的亲水性氨基酸,能与水发生水化作用形成氢键,减少冰晶的形成,防止肌纤维发生氧化羰基化,阻碍纤维蛋白构象改变而暴露巯基,抑制二硫键的形成,保持完整性[25]。因此猪排解冻后硬度、弹性、咀嚼性相对于空白组有一定程度的提高,质构特性得到改善。蔡克周等[29]将血浆蛋白添加到乳化肠中同样也提高了产品的硬度、弹性、咀嚼性,这与本实验研究结果类似。添加血浆蛋白的调理猪排硬度值、弹性值、咀嚼性均低于鸡蛋白组,是因为鸡蛋白粉中的蛋白质类型为盐溶性蛋白,在加工过程中形成凝胶,赋予产品良好的弹性。另外鸡蛋白粉中含有较高摩尔质量分数的疏水氨基,可在加工过程中形成稳定的网状结构[30],有效提升猪排的硬度和咀嚼性。
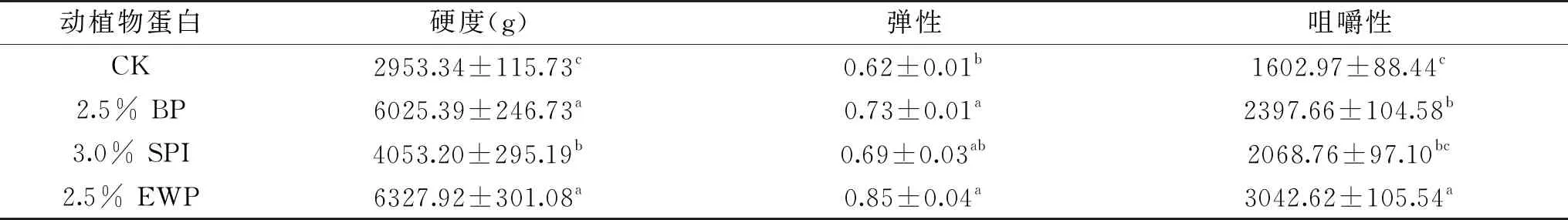
表5 血浆蛋白对调理猪排质构特性的影响
2.5 血浆蛋白对肌原纤维蛋白凝胶强度的影响
从图6可以看出,相比空白组,血浆蛋白能显著提高肌原纤维蛋白的凝胶强度(P<0.05),在加热过程中形成热诱导凝胶,促进蛋白形成更加致密的三维网状结构。添加血浆蛋白后凝胶强度增大到534.95 g,比空白组提高了约0.6倍,显著高于大豆分离蛋白组(493.89 g)、鸡蛋白组(463.81 g)(P<0.05)。这种添加血浆蛋白能增强肌原纤维蛋白凝胶强度的现象,与Rawdkuen等[31]利用0.5%鸡血浆蛋白改善鱼糜的结果类似,可认为血浆蛋白主要通过非二硫共价键、疏水键、氢键等促进肌原纤维蛋白形成更加致密的三维网状结构[32]。在加热过程中,血浆蛋白中含有的纤维蛋白、白蛋白、血清蛋白相互作用,使肌原纤维蛋白混合体系之间的静电荷增加,蛋白质变性程度增强,β-折叠含量增加,分子间的构型充分舒展并重新排列,这时分子间主要以斥力为主,使蛋白凝胶强度增大[21]。也有研究表明随着血浆蛋白浓度的增加,肌原纤维蛋白内肌球蛋白重链的完整性越好,凝胶强度就越大[33]。但在加热过程中,肌球蛋白重链容易发生蛋白质水解,因此血浆蛋白可以有效抑制水解作用,提高肌原纤维蛋白凝胶强度。
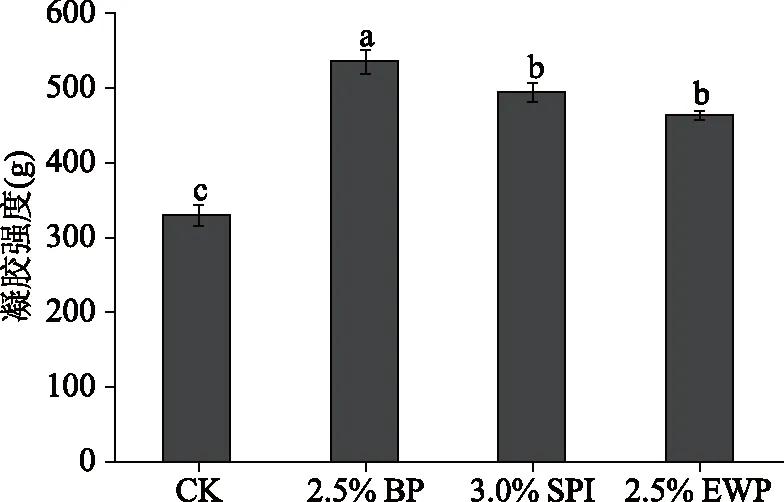
图6 血浆蛋白对肌原纤维蛋白凝胶强度的影响
2.6 血浆蛋白对肌原纤维蛋白流变特性的影响
贮能模量(G′)是反映流体因弹性形变而产生变形能量的能力,代表蛋白在形成凝胶过程中的状态变化,损耗模量(G″)代表流体黏性大小。图7是添加血浆蛋白后肌原纤维蛋白溶液在20~80 ℃加热过程中储能模量与损耗模量的变化情况。CK组在50~55 ℃之间出现热变性峰,添加BP后延迟热变性峰出现的温度,热变性峰温度范围为50~65 ℃,比SPI组、EWP组高2 ℃,这与添加的蛋白本身的性质有关。有研究表明[34],血浆蛋白与肌原纤维蛋白的混合体系超过60 ℃时G′才会出现明显变化。这与本实验结果类似,可能是由于血浆蛋白是内源蛋白的原因有关。可以看出,经过BP处理后的蛋白储能模量在升温区间增长速度高于空白组,且在此区间内G′、G″值增大,说明在形成比较疏松的凝胶结构时,添加蛋白后促进了蛋白头部受热聚集,导致G′、G″的上升。在65~71 ℃之间,BP组G″明显下降,肌球蛋白凝胶减弱阶段出现,主要是由于肌球蛋白尾部变性与解析折叠的程度较高,原本形成的凝胶结构被破坏。第三阶段空白组G′值上升幅度小,变化值不大,处理组G′继续上升。80 ℃时,BP组的最终G′、G″值高于EWP、CK组,说明BP促进了蛋白尾部的交联能力,形成的凝胶网络结构储存弹性形变能量的能力也最大。综上,添加血浆蛋白可提高凝胶粘弹性。
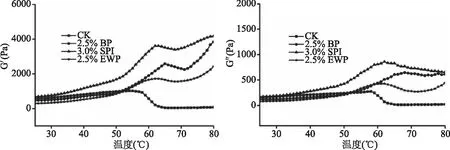
图7 血浆蛋白对肌原纤维蛋白流变特性的影响
2.7 血浆蛋白对调理猪排微观结构的影响
血浆蛋白对冷冻调理猪排微观结构的影响见图8,血浆蛋白组和空白组的微观结构存在明显的差异,和空白组相比,血浆蛋白组肌肉纤维紧密排列,基质中没有较大的空洞,大部分孔隙消失,表面较为平整;而空白组的猪排内部孔隙较大,结构疏松,肌束间界限分明,孔隙较多;大豆分离蛋白组、鸡蛋白组仍存在大部分孔隙。可见三种蛋白均能使调理猪排的组织结构更加致密,与大豆分离蛋白、鸡蛋白相比,血浆蛋白对产品内部组织结构的填充作用更好。在冻藏过程中,猪排内部会出现冰晶生长和重结晶现象,从而使肌纤维蛋白变性,微观结构变差。研究表明大豆分离蛋白中存在的极性基团与水分子发生水化作用,能提高饺子馅中水分的约束能力,抑制冰晶生长和重结晶现象,改善饺子馅的结构组织[35]。本实验中添加血浆蛋白的调理猪排微观结构最好,可以推测血浆蛋白抑制冰晶生长和重结晶作用优于大豆分离蛋白。

图8 血浆蛋白对调理猪排微观结构的影响
2.8 血浆蛋白对调理猪排色泽的影响
表6表明,添加血浆蛋白后亮度值显著升高(P<0.05),BP组与SPI组亮度值无显著性差异(P>0.05)。亮度值升高是因为血浆蛋白粉自身亮度,较好的保水性使光散射强度增大所导致。加入血浆蛋白后的猪排红度值显著下降、黄度值显著上升(P<0.05)。由于蛋白粉的颜色为淡黄色,在滚揉过程中进入猪肉内部包裹在肌红蛋白、血红蛋白表面,阻碍肌红蛋白与氧气接触形成氧合肌红蛋白,这与Jarmoluk等[36]将血浆蛋白添加到猪肉糜中增大亮度、降低红度值的研究结果相似。研究表明[37]将大豆分离蛋白添加到调理重组牛肉中,会显著提高产品黄度值。鸡蛋白对产品红度值、黄度值无明显影响(P>0.05)。

表6 血浆蛋白对调理猪排色泽的影响
3 结论
血浆蛋白对调理猪排品质特性具有明显影响,2.5%血浆蛋白使调理猪排的解冻损失、压榨损失显著降低(P<0.05),蛋白凝胶强度显著增大(P<0.05)。结合LF-NMR分析发现,添加2.5%血浆蛋白的调理猪排P22峰面积比空白组、3.0%大豆分离蛋白组、2.5%鸡蛋白组分别提高了17.65%、5.62%、12.01%,部分自由水转化为不易流动水,保水性增强。与3.0%大豆分离蛋白相比,血浆蛋白能有效提高猪排的硬度、弹性、咀嚼性。流变结果表明血浆蛋白能延长肌原纤维蛋白的变性温度,使G′、G″高于2.5%鸡蛋白组。扫描电镜结果发现,添加血浆蛋白后促使微观结构更加紧密。因此,血浆蛋白可作为一种新型蛋白在肉制品中加工使用。
