术前颈动脉斑块动态增强磁共振成像对支架置入后再狭窄发生的预测价值
2020-09-23葛晓乾赵辉林孙贝贝许建荣刘晓晟
葛晓乾,李 晓,赵辉林,孙贝贝,许建荣,刘晓晟
1. 山东省立医院西院影像科,济南 250022;2.上海交通大学医学院附属仁济医院放射科,上海 200127
近年来介入技术得到了快速的发展,颈动脉支架置入术(arotid artery stenting,CAS)已成为治疗颈动脉狭窄的重要方法。但是CAS 不能一劳永逸地解决颈动脉狭窄的问题,仍有可能发生支架内再狭窄(in-stent restenosis,ISR),并且ISR 临床治疗相对困难,已成为限制CAS 临床应用的主要原因[1]。近期研究发现,ISR 与斑块局部的炎症反应有密切关系,多种炎症细胞和炎症因子参与了内膜过度增生的病理过程,并最终导致ISR 形成。然而目前ISR 研究仅停留于血清学的相关性分析,缺乏直接病理学证据。应用于颈动脉斑块的动态增强磁共振成像(dynamic contrast-enhanced MRI,DCE-MRI)为斑块炎症评估提供了新的影像手段,突破了既往局限于对斑块形态学的评估。研究表明,DCE-MRI 成像技术可从微循环层面无创、可视化、定量化地评估斑块的炎症活动[2]。DCEMRI 技术是在静脉团注对比剂前、中、后多个期相,连续、快速、动态地扫描,示踪对比剂在目标组织中流入、扩布和廓清的情况,并通过所得药代动力学参数进行定量化。容积转移常数Ktrans,指对比剂从血管内向血管外细胞外间隙(extravascular-extracellular space,EES)流入的转移常数;速率常数kep,是指对比剂从EES 向血管内回流的转移常数;EES 容积分数ve,指EES 占单位体积的比例;血浆容积分数vp,指每单位体积血浆容积[3-4]。本研究目的是通过应用DCE-MRI 技术,前瞻性研究CAS 术前斑块内炎症与术后再狭窄的相关性,评估DCE-MRI 预测ISR 的能力。
1 对象与方法
1.1 研究对象
以2016 年6 月至2018 年12 月上海交通大学医学院附属仁济医院神经外科诊治的单侧颈动脉狭窄并拟行CAS治疗的患者为研究对象。入组患者需同时满足以下标准:①符合CAS 手术适应证。②同意参与本研究并签署知情同意书。③无MRI 检查禁忌证。排除标准:① 非粥样硬化性疾病引起的颈动脉狭窄,如夹层、血管炎、放射性损伤等。②手术侧颈动脉管腔闭塞。③非粥样硬化原因引起的相似临床症状,如颅内肿瘤、出血、烟雾病等。收集并记录患者一般资料、相关临床危险因素及临床症状(缺血性脑卒中或短暂性脑缺血发作)。
1.2 CAS
1.2.1 围手术期用药 入组的所有患者术前至少3 d 口服双重抗血小板聚集药物(阿司匹林100 mg/d 和氯吡格雷75 mg/d);术中全身肝素化;术后至少6 个月口服双重抗血小板聚集药物(阿司匹林100 mg/d 和氯吡格雷75 mg/d)。 入组的高血脂、高血压和高血糖患者均按治疗原发病的方案用药。
1.2.2 手术操作过程 局部麻醉下经股动脉穿刺,放置8F 导引导管至颈动脉近端狭窄处,所有患者均于狭窄远端置入An-gioguard 保护滤过伞(Cordis 公司,美国);使用合适的Maverick 球囊(波科公司,美国)预扩,撤出球囊,行颈动脉造影评估预扩效果;置入合适规格的Precise 支架(Cordis 公司,美国),球囊后扩,再次造影评估支架及后扩效果,顺序退出保护装置、导管及导丝系统,缝合股动脉,压迫器加压包扎。
1.2.3 术后随访 随访时间为术后6 个月,行颈动脉造影检查判断患者是否发生ISR;当造影检查示管腔直径较支架置入术后减小30%时,则判断为发生ISR[5]。记录患者术后事件。
1.3 MRI 扫描
1.3.1 MRI 扫描设备 采用3.0T 磁共振扫描仪(Philips Intera Archieva 3.0T TX)和专用表面颈动脉线圈检测。所有入组患者在CAS 术前1 周内完成颈动脉MRI 检查。
1.3.2 颈动脉VW-MRI 扫描 受检者仰卧于检查床上,抬高下颌,使颈部充分暴露;通过定位线光标调整颈部位置,横断面光标置于颈动脉分叉处,矢状位光标置于颈部中线位置。将颈动脉表面线圈包绕于颈部并固定,嘱患者平稳呼吸,扫描过程中尽量减少活动以减轻运动伪影。先行双侧颈动脉三维时间飞跃法(3D-TOF)MRA 扫描,根据MRA 图像判断颈动脉分叉处位置、斑块大致位置、范围,再行VW-MRI 序列扫描。VW-MRI 扫描序列:T1 加权序列(T1WI),共16 层;T2 加权序列(T2WI),共16层;3D 磁化准备快速梯度回波序列(3D MP-RAGE),共32 层图像(表1)。
1.3.3 颈动脉DCE-MRI 扫描 DCE-MRI 扫描紧接于VWMRI 扫描后,第1 期动态扫描结束后,使用高压注射器经前臂静脉注入马根维显(拜耳公司,德国)0.1 mmol/kg, 速率1.5 mL/s,而后连续19 期动态扫描。扫描参数见表1。为确保药代动力学参数计算的准确性,应用上海联影公司设计的软件对DCE-MRI 多期图像进行严格配准以校正扫描过程中由于呼吸或血管搏动引起的运动伪影。
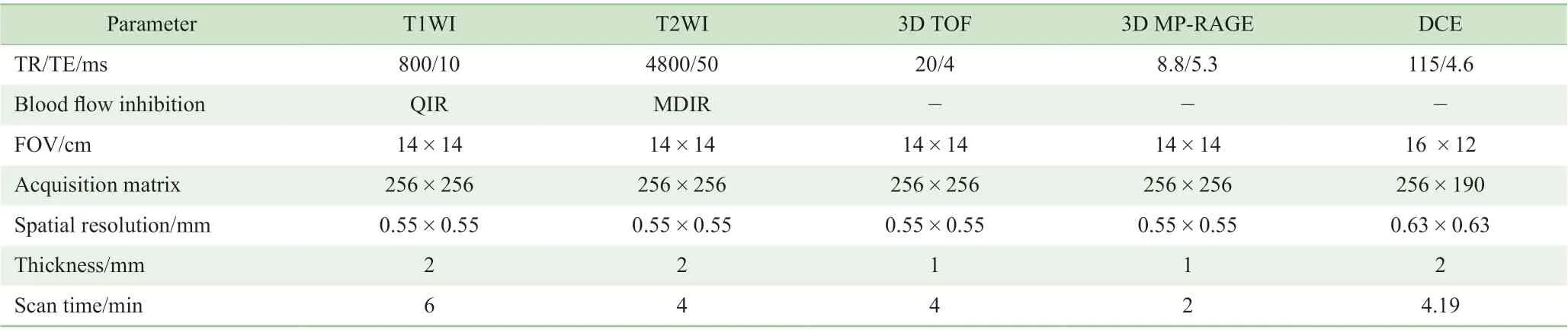
表1 颈动脉VW-MRI 和DCE-MRI 序列的成像参数Tab 1 Imaging parameters of carotid artery VW-MRI and DCE-MRI sequence
1.4 图像分析
1.4.1 图像质量评分 在图像分析前,由2 名神经影像诊断专业高年资医师评估MRI 图像质量。参考既往研究[6],依据图像信号噪声比将图像质量分为1 ~5 级(1 级最差,5 级最佳),评分≤2 级的图像将不纳入统计分析。当2 位医师评分不一致时协商解决。
1.4.2 颈动脉VW-MRI 图像分析 对获取的MRI 图像采用VesselMass 斑块分析软件进行处理,通过勾画血管壁内侧缘、外侧缘及斑块内各成分获得颈动脉斑块定性及定量指标,斑块成分定性(脂质核心、斑块内出血、钙化、斑块溃疡)和斑块负荷指标(最大和平均管壁标准化指数、狭窄度)[7-8]。
1.4.3 颈动脉DCE-MRI 图像后处理 所有图像分析和后处理均由2 位具有10 年以上神经影像诊断经验的医师分别独立完成,测量前隐去入组者临床信息且测量顺序随机。采用MIStar visualization 软件中Extended Tofts 线性模型,计算出Ktrans、kep、ve和vp。选择手术侧斑块进行测量,手动勾画斑块最大截面,避开管腔及周围组织。2 位医师的测量结果取平均值纳入后续统计分析。
1.5 统计分析
定量资料以x—±s表示,连续定量资料采用单因素方差分析或秩和检验分析;定性变量以频数和百分比表示,采用χ2检验。应用组内相关系数(intraclass correlation coefficient,ICC)评价DCE-MRI 参数测量的一致性。采用单因素和多因素Logistic 回归分析DCE-MRI 与ISR的相关性。采用受试者工作特征(receiver characteristic operator,ROC)曲线计算DCE-MRI 参数预测ISR 的敏感度、特异度及最佳阈值。采用 SPSS 22.0 软件进行统计分析,P<0.05 表示差异具有统计学意义。
2 结果
2.1 入组情况
本研究共招募47 例患者满足入组与排除标准,其中7 例患者数据未纳入分析(2 例患者图像质量欠佳,5 例患者未能完成术后第6 个月随访),最终共40 例患者数据[(女性9 例,男性31 例,平均年龄(60.75±6.03)岁]纳入分析。
2.2 再狭窄组与无再狭窄组比较
依据第6 个月复查结果,将入组患者分为再狭窄组与无再狭窄组,其中再狭窄组共8 例(20%),无再狭窄组32 例(80%)。DCE-MRI 参数中,Ktrans和vP在2 组中的差异有统计学意义(P=0.000,P=0.037)(图1)。表2 示2 组患者的临床信息、斑块MRI 形态特征和DCE-MRI 参数的对比。
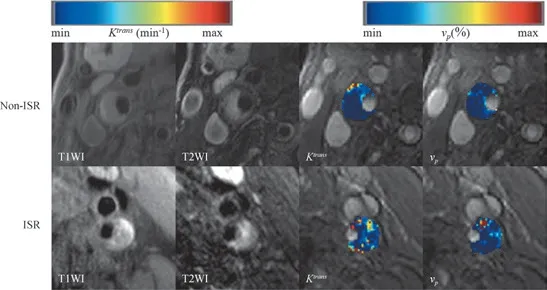
图1 无狭窄组及再狭窄组Ktrans 和vP 伪彩图Fig 1 Pseudo color maps of Ktrans and vP of non-ISR group and ISR group
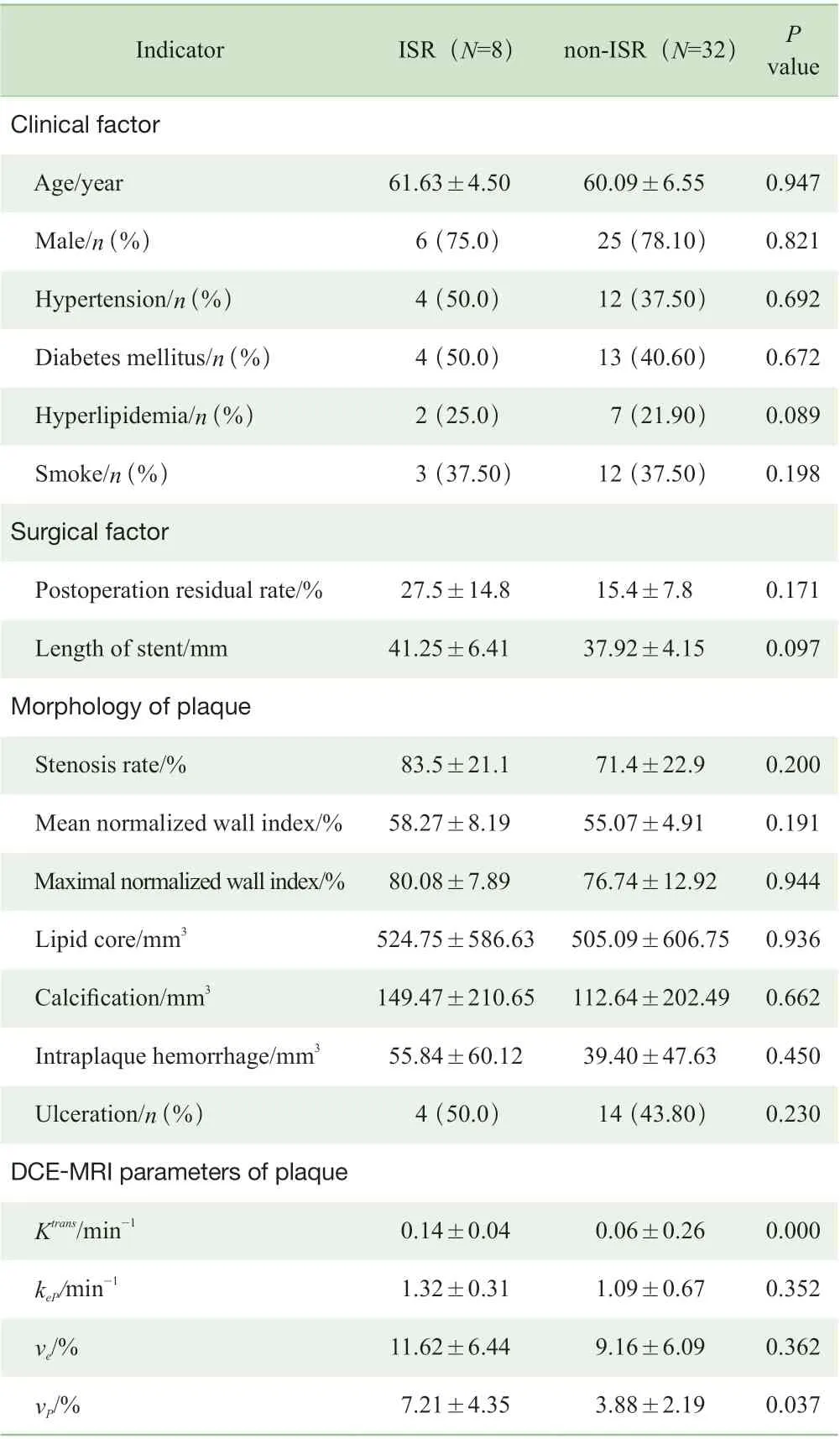
表2 入组患者基本临床信息和斑块特征Tab 2 Baseline clinical data and plaque features of patients
2.3 DCE-MRI 与ISR 的相关性
校正单因素分析中P< 0.1 的ISR 危险因素,包括Ktrans(P=0.000)、vP(P=0.043)、高 血 脂(P=0.084)和支架长度(P=0.092),逐步多因素线性回归示Ktrans与ISR 独立相关(OR=1.43,95%CI1.17 ~1.56,P=0.012) (表3)。
2.4 ROC 曲线分析
Ktrans0.09 min-1为预测ISR 的最佳阈值,敏感度为100%(95%CI0.63 ~1.00), 特 异 度 为87.5%(95%CI0.68 ~0.97),ROC 曲线下面积为0.91(图2)。
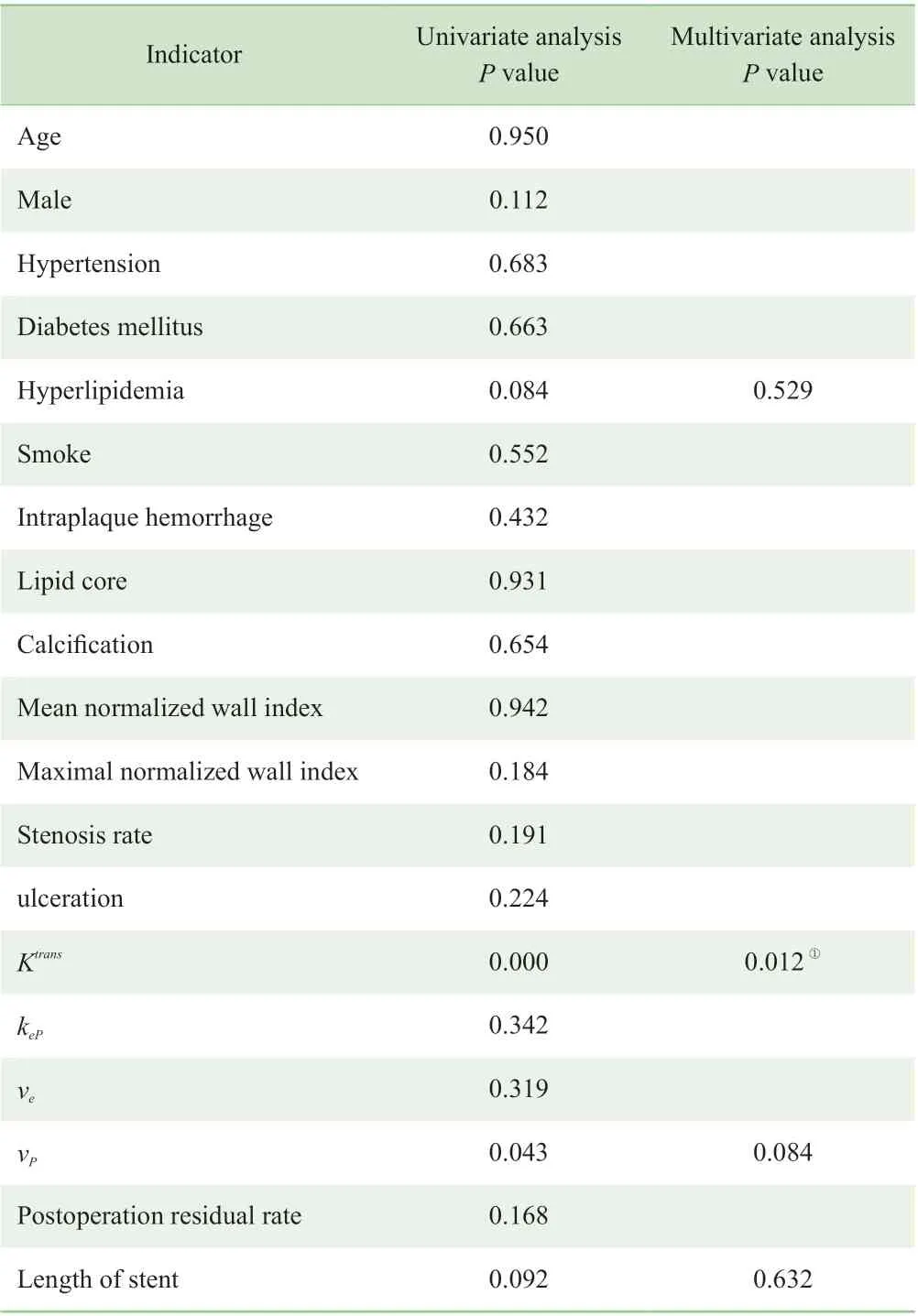
表3 ISR 单因素和多因素回归分析Table 3 Univariate and multivariate regression analysis of ISR

图2 Ktrans 预测ISR 的ROC 曲线Fig 2 ROC curve of Ktrans to predict ISR
2.5 Ktrans、keP、ve 和vP 观察者间的一致性分析
2 名医师测量所得的Ktrans、keP、ve和vP结果均具有很好的组间一致性,ICC 值分别为0.85(95%CI0.84 ~ 0.87)、0.87(95%CI0.85 ~0.89)、0.82(95%CI0.81 ~ 0.84)和0.89(95%CI0.86 ~0.91)。
3 讨论
本研究应用DCE-MRI 定量评估颈动脉斑块内炎症反应,结果显示颈动脉斑块内的Ktrans和vP与ISR 显著相关,反映了术前斑块内炎症可能导致支架置入后的内膜过度增生;校正相关变量后发现Ktrans是ISR 的独立预测变量,Ktrans>0.09min-1表示有ISR 的风险,具有较高敏感度和特异度,提示术前颈动脉斑块DCE-MRI 检查有望成为预测CAS 后ISR 发生的有效手段。
近年来随着 CAS 安全性及有效性的不断提升,现已成为临床治疗颈动脉狭窄的重要方法。研究[1]表明其主要适应者是年龄>18 岁、症状性狭窄≥50%或非症状性狭窄≥70%的患者。既往的多中心研究[9]发现,CAS 与颈动脉内膜剥脱术治疗效果相仿,且均优于传统药物治疗。然而,CAS 最常见的中远期并发症ISR 则成为影响其临床应用的最大问题。ISR 的发生可导致相应供血脑组织低灌注,甚至发生急性脑梗死。ISR 的发生率在不同研究中有差距,发生率与随访时间有关。本研究CAS术后6 个月ISR 发生率为20%。短期随访研究报道ISR发生率小于4%[10],另一长期随访研究中ISR 发生率高 达40%[11]。
研究[12]显示有多个危险因素可诱发ISR,如高血压、糖尿病、支架选择等。在本研究中尽可能多地纳入危险因素,且所有患者均采用同一支架材料和围手术期用药;但我们发现,纳入的一般危险因素和MRI 检查所得的斑块形态学、成分特征并不能独立预测ISR 的发生,该结论与Wasser 等的研究[13]相一致。也有部分学者发现斑块的易损性与CAS 后ISR 发生密切相关。这些学者[14-15]认为T1WI 或TOF 序列上高信号的不稳定斑块、超声探测到强化的不稳定斑块及CT值低于0 HU 的不稳定斑块块在CAS 术后易产生ISR。这与我们的研究结果不一致,可能与不同研究间的斑块构成、随访时间不同及本研究病例数较少有关。
明确ISR 的发生机制对预测ISR 的发生至关重要。ISR 的主要发生机制是CAS 术后血管发生一系列的防御与自我修复过程[16],内膜增生和负性重构是发生ISR 的主要阶段。内膜增生表现为在多种细胞因子的诱导下,血管平滑肌细胞由中膜向内膜迁移,逐渐覆盖支架,形成内膜样结构。有研究[16]表明病变局部的炎症反应参与内膜增生阶段,巨噬细胞在病变处浸润并活化,产生并释放多种炎症因子及生长因子,诱导内膜增生及平滑肌细胞迁移,造成支架内再狭窄。Liu 等[17]发现CAS 前后6 个月炎症标志物之一——E-选择素水平的变化可独立预测ISR 的进展情况;Miura 等[18]通过光学频域成像发现颈动脉斑块内的新生血管与CAS 后ISR 相关。这2 项研究进一步验证了上述的机制,因此分析病变局部的炎症反应可能是预测ISR 的关键。DCE-MRI 目前被认为是一种能够无创、定量化、可视化评估管壁外膜滋养血管、斑块内新生血管和炎症的影像学检查方法。DCE-MRI 可示踪在斑块微环境中对比剂流入、扩布和廓清的情况,并通过所得药代动力学参数进行量化。其中Ktrans反映外膜滋养血管、斑块内新生血管和炎症细胞的数量;vP与新生血管数量显著相关。可见Ktrans和vP可用于反映斑块内的炎症活动,而斑块内的炎症活动和支架置入后的内膜过度增生并产生ISR之间存在内在关联。这也解释了本研究发现的再狭窄患者组Ktrans和vP显著高于无再狭窄组,Ktrans可独立预测颈动脉支架术后6 个月再狭窄的发生。
本研究存在以下局限性:①入组样本量较少,随访时间偏短。DCE-MRI 与ISR 的相关性还需要通过更大样本量、更长随访时间的前瞻性研究进行证明。②无斑块组织病理对照,仅利用影像学诊断斑块特征,缺乏组织病理学金标准对照。③Ktrans预测值会因MRI 设备及后处理软件选择的不同而有所差距,本研究所得Ktrans预测值仅基于本研究中的设备及软件。
总之,DCE-MRI 参数Ktrans可独立预测颈动脉ISR 的发生,并具有较高的敏感度和特异度,提示术前颈动脉斑块DCE-MRI 检查有望成为预测颈动脉ISR 发生的有效 手段。
参·考·文·献
[1] 中华医学会神经病学分会, 中华医学会神经病学分会脑血管病学组, 中华医学会神经病学分会神经血管介入协作组.中国缺血性脑血管病血管内介入诊疗指南2015[J].中华神经科杂志, 2015, 48(10): 830-837
[2] Ge XQ, Zhou ZE, Zhao HL, et al. Evaluation of carotid plaque vulnerabilityin vivo: correlation between dynamic contrast-enhanced MRI and MRI-modified AHA classification[J]. J Magn Reson Imaging, 2017, 46(3): 870-876.
[3] Kerwin WS, Obrien KD, Ferguson MS, et al. Inflammation in carotid atherosclerotic plaque: a dynamic contrast-enhanced MR imaging study[J]. Radiology, 2006, 241(2): 459-468.
[4] Calcagno C, Lobatto ME, Dyvorne H, et al. Three-dimensional dynamic contrast-enhanced MRI for the accurate, extensive quantification of microvascular permeability in atherosclerotic plaques[J]. NMR Biomed, 2015, 28(10): 1304-1314.
[5] Gioia GD, Campanale CM, Mega S, et al. Percutaneous treatment of recurrent in-stent restenosis of carotid artery stenting: a case report and state-of-the-art review[J]. Am J Case Rep, 2015, 16: 558-562.
[6] Yuan C, Mitsumori LM, Ferguson MS, et al.In vivoaccuracy of multispectral magnetic resonance imaging for identifying lipid-rich necrotic cores and intraplaque hemorrhage in advanced human carotid plaques[J]. Circulation, 2001, 104(17): 2051-2056.
[7] Cai JM, Hatsukami TS, Ferguson MS, et al. Classification of human carotid atherosclerotic lesions within vivomulticontrast magnetic resonance imaging[J]. Circulation, 2002, 106(11): 1368-1373.
[8] Zhao HL, Zhao XH, Liu XS, et al. Association of carotid atherosclerotic plaque features with acute ischemic stroke: a magnetic resonance imaging study[J]. Eur J Radiol, 2013, 82(9): e465-e470.
[9] Xin WQ, Li MQ, Li K, et al. Systematic and comprehensive comparison of incidence of restenosis between carotid endarterectomy and carotid artery stenting in patients with atherosclerotic carotid Stenosis[J]. World Neurosurg, 2019, 125: 74-86.
[10] Wholey MH, Wholey M, Mathias K, et al. Global experience in cervical carotid artery stent placement[J]. Catheter Cardiovasc Interv, 2000, 50(2): 160-167.
[11] Ohki T, Marin ML, Lyon RT, et al.Ex vivohuman carotid artery bifurcation stenting: correlation of lesion characteristics with embolic potential[J]. J Vasc Surg, 1998, 27(3): 463-471.
[12] Reiff T, Amiri H, Rohde S, et al. Statins reduce peri-procedural complications in carotid stenting[J]. Eur J Vasc Endovascular Surg, 2014, 48(6): 626-632.
[13] Wasser K, Karch A, Gröschel S, et al. Plaque morphology detected with Duplex ultrasound before carotid angioplasty and stenting (CAS) is not a predictor of carotid artery in-stent restenosis, a case control study[J]. BMC Neurol, 2013, 13(1): 1-6.
[14] Kim CH, Kang J, Ryu WS, et al. Effects of carotid calcification on restenosis after carotid artery stenting: a follow-up study with computed tomography angiography[J]. World Neurosurg, 2018, 117: e514-e521.
[15] Hagiwara Y, Takao N, Takada T, et al. Contrast-enhanced carotid ultrasonography and MRI plaque imaging to identify patients developing instent intimal hyperplasia after carotid artery stenting[J]. Med Ultrason, 2019, 21(2): 170-174.
[16] Giordano S, Zhao XM, Xing D, et al. Targeted delivery of human iPS-ECs overexpressing IL-8 receptors inhibits neointimal and inflammatory responses to vascular injury in the rat[J]. Am J Physiol Heart Circ Physiol, 2016, 310(6): H705-H715.
[17] Liu CH, Lee TH, Chang PY, et al. Changes in E-selectin levels predict carotidStenosisprogression after carotid artery stenting[J]. Curr Neurovascular Res, 2018, 15(1): 18-25.
[18] Miura M, Yamada K, Shindo S, et al. Optical frequency domain imaging evaluation of progressive carotid plaque and in-stent restenosis lesion with multiple neovascularizations[J]. World Neurosurg, 2018, 119: 54-57.
