巨噬细胞极化在骨关节炎中的作用
2020-09-23徐以明薛松桑伟林马金忠
徐以明 薛松 桑伟林 马金忠
骨关节炎 ( osteoarthritis,OA ) 是一种临床上常见的慢性退行性关节病变,是引起关节疼痛的主要原因。OA 典型特征表现为关节软骨丢失、软骨下骨改变、骨赘形成和关节滑膜炎症[1]。据估计,全世界有 2.42 亿人患有髋关节或膝关节 OA[2]。由于 OA 的发病机制复杂,目前尚未完全认识,故缺乏能够有效改变骨关节炎病情的药物 ( disease modifying osteoarthritis drugs,DMOADs )[3]。近年来巨噬细胞极化在 OA 发生发展中的作用越来越明显,M1 型巨噬细胞是分泌炎性细胞因子的促炎性细胞,而 M2 型巨噬细胞是促进组织修复的抗炎性细胞,二者功能相反,目前针对巨噬细胞极化也出现了一些相应的治疗策略。现就近年来巨噬细胞极化在 OA 中发生发展中的作用综述如下,为巨噬细胞作为 DMOADs 的治疗靶点寻找可能性。
一、M1 / M2 型巨噬细胞极化
巨噬细胞是人体免疫系统的重要组成部分,其表型和功能均具有高度异质性及可塑性,在经过不同病原相关分子模式的刺激或者损伤相关分子模式的刺激后,可极化为具有不同功能的表型。简而言之,巨噬细胞极化过程就是根据巨噬细胞所处的环境改变巨噬细胞的功能。一般情况下,巨噬细胞受到不同刺激时将会活化为经典活化型巨噬细胞 ( M1 型巨噬细胞 ) 和选择活化型巨噬细胞 ( M2 型巨噬细胞 ),分别在人体中发挥着不同的作用[4]。
M1 型巨噬细胞可由 Toll 样受体和 IFNγ 诱导而来,表达 CD86、CCL2 和可诱导型一氧化氮合酶 ( inducible nitric oxides synthase,iNOS ) 等基因[5],继而分泌 IL-6、TNF-α、反应性氧中间物 ( reactive oxygen intermediate,ROI ) 等细胞因子,具有加重炎症反应、促进碎片清除和清除凋亡细胞的作用[6]。与 M1 型巨噬细胞相比,M2 型巨噬细胞的活化途径则较为复杂。M2 型巨噬细胞可由 IL-4或 IL-13 诱导后表达 IGF-1 和 CD206 等,具有抗炎和促进组织修复作用。在 M2 型巨噬细胞亚型中,除了共同的抗炎作用外,还可根据不同的受体表达及功能分为 M2a、M2b、M2c 及 M2d 型巨噬细胞,且功能各异。M2a 型巨噬细胞可以促进细胞增殖和迁移、产生生长因子和清除凋亡细胞;M2b 型巨噬细胞可表达 CD64、TNF-α 等细胞因子,促进细胞成熟和合成细胞外基质;M2c 型巨噬细胞可表达 SLAM 和 HMOX-1 等,加速炎症分解和促进细胞外基质合成;M2d 型巨噬细胞可高表达血管内皮生长因子以及诱导 iNOS 等,或低表达 TNF-α 和精氨酸酶 1 等[7],在血管生成和伤口愈合中发挥作用[8]。简而言之,M2a、M2b、M2c 和 M2d 型巨噬细胞分别具有促进细胞增殖、促进细胞成熟、加速炎症消退和促进血管生成的作用[9-10]。M1 型巨噬细胞与 M2 型巨噬细胞主要特性见表 1。
巨噬细胞作为强大的免疫效应细胞,在受到不同的刺激后,既可以转变为分泌促炎因子的促炎性 M1 型巨噬细胞,也可以转变为促进组织修复的抗炎性 M2 型巨噬细胞。正因为巨噬细胞在极化后具有这种可塑性带来的双重功能,所以能够在组织稳态和疾病康复中发挥重要作用,而随着环境的变化,人体内 M1 型巨噬细胞和 M2 型巨噬细胞维持着动态平衡,当受到不同的刺激时还可相互转化[11]。最近有研究报道 M2 型巨噬细胞可以在含乳铁蛋白免疫复合物的刺激下分化为 M1 巨噬细胞[12],而组蛋白去乙酰化酶抑制剂 MS-275 可诱导 M1 型巨噬细胞向 M2 型巨噬细胞转化[13],这显示出了它们之间的动态性。但当这种动态平衡被打破时,产生更多的 M1 型巨噬细胞,就可能导致 OA 的发生或进展。诚然,巨噬细胞的表型和功能的动态转换是一个多分子相互作用的复杂过程,受到多种信号分子及其通路的调控。目前已知调控巨噬细胞极化的通路有 JAK / STAT 信号通路、PI3K / AKT 信号通路、JNK信号通路[14]、MAPK 信号通路[15]和 NF-κB 信号通路等,对相关通路的研究可能使其成为 OA 治疗的潜在靶点,因此巨噬细胞极化信号通路的研究对 OA 的治疗具有重要意义[16-17]。
二、巨噬细胞极化与 OA 发病关联
人体关节滑膜分为两层,外层 ( 内膜下层 ) 和内层( 内膜 )。内膜主要由两种类型的细胞组成,即分化来的巨噬细胞 ( 巨噬细胞样滑膜细胞 ) 和成纤维样滑膜细胞,他们对维持内关节的稳态非常重要。近年来,有研究发现巨噬细胞极化和 OA 发病存在着密切的关系,且在 OA中起作用的巨噬细胞类型主要是滑膜巨噬细胞,约 50%的 OA 患者关节滑膜内膜和亚内膜中大量存在这种细胞类型[18-19]。面对关节损伤或老化应激,软骨细胞或细胞外基质可以起到缓冲作用,并能激活滑膜巨噬细胞[20]。活化的滑膜巨噬细胞大量表达叶酸受体,利用放射性标记的叶酸可通过先进的成像技术对其进行靶向和追踪[17]。Piscaer等[21]使用 SPECT / CT 在单碘乙酸 ( MIA ) OA 模型和前交叉韧带横断 ( ACLT ) OA 模型中追踪 InCl3111标记的叶酸,结果显示,MIA 模型具有较高的初始巨噬细胞活化,2 周后达到峰值,8 周后消失,而 ACLT 模型的激活率较低,但在诱导 12 周后仍然有效。de Visser 等[22]使用另一种叶酸受体放射性示踪剂 Incm09111,发现高脂饮食诱导的OA 模型中 Incm09111信号增加了 28.4%。同时,Daghestani等[23]通过 SPECT / CT 观察了骨性关节炎患者99mtc-ec20标记叶酸受体的信号分布,研究发现,受影响膝关节中99mtc-ec20 的信号强度与体液 ( 血液和关节液 ) 中 CD14和 CD163 的水平以及关节间隙缩小显著相关。这些发现直接证实了活化滑膜巨噬细胞在 OA 病理生理学中的重要作用。
Sun 等[24]发现在高能量饮食诱导小鼠代谢性 OA 的过程中,高能量饮食促进了关节滑膜内巨噬细胞浸润,并且巨噬细胞 CD86、IL-6、Nos2 的基因表达水平明显增高,激活了滑膜内巨噬细胞向促炎性 M1 型巨噬细胞发展,而作为 M2 型巨噬细胞标记细胞因子 IL-10 的表达未发生变化。Topoluk 等[25]创建的 OA 滑膜液和 OA 软骨共培养模型中,在固有的 OA 微环境中维持滑膜 M1 型巨噬细胞和 M2 型巨噬细胞表型,当选择性耗竭滑膜巨噬细胞时可导致 M1∶M2 比值显著降低,IL-13、MMP-13 浓度可显著降低,软骨损伤也减弱,而 IL-13 和 MMP-13 均为导致 OA 发病的关键因子。Ni 等[26]研究发现 OA 患者滑膜巨噬细胞的 IL-12 p35、IL-12 p40 表达水平明显高于自身血液循环中的单核巨噬细胞,而 IL-12 高表达是 M1 型极化巨噬细胞的标志。Zhang 等[27]在胶原酶诱导的 OA 滑膜中发现,胶原酶持续注射增加了滑膜组织两层中巨噬细胞的数量,术后第 7 天和第 28 天 M1 型巨噬细胞的百分比均增高;术后 7 天时,两层均有 M2 型巨噬细胞存在,但术后 28 天时仅存在于亚层部分区域,且数量较对照组明显减少。这表明在胶原酶诱导的 OA 中,巨噬细胞聚集在OA 滑膜组织中且增强了 M1 型巨噬细胞极化,减少了 M2型巨噬细胞极化,这提示巨噬细胞在 OA 发病机制和发展中的潜在作用。Liu 等[28]研究发现 M1 和 M2 型巨噬细胞的失衡情况可以直接反映膝关节 OA 的严重程度,相比正常时,M1 型巨噬细胞越多,M2 型巨噬细胞越少,膝关节OA 病理越严重。上述一系列研究表明巨噬细胞极化参与了 OA 的发生发展进程,下面从四个方面阐述极化巨噬细胞在 OA 发生和进展中的作用。
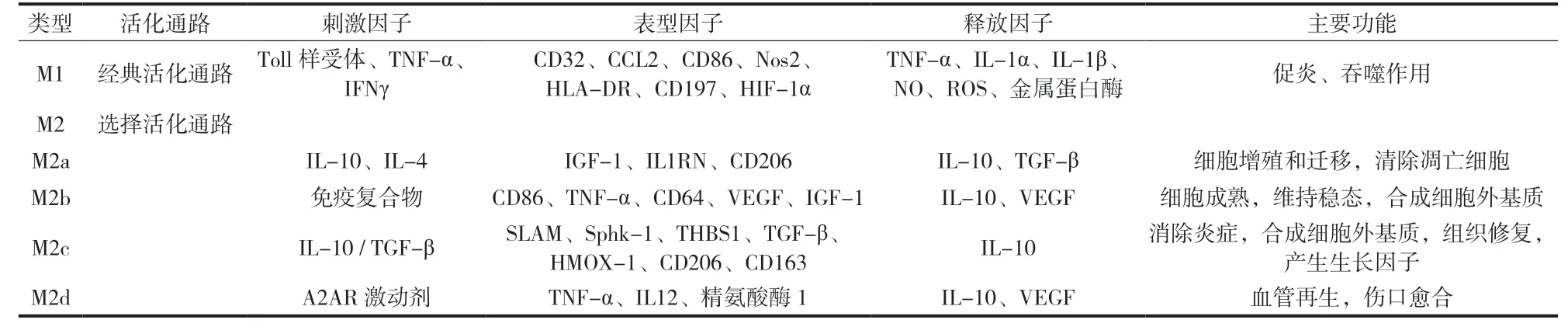
表 1 M1 型巨噬细胞与 M2 型巨噬细胞主要特性Tab.1 Main characteristics of M1 type macrophages and M2 type macrophages
1. 抑制软骨形成:M1 型极化巨噬细胞可以通过抑制关节软骨细胞的软骨形成参与 OA 发病[24]。极化巨噬细胞降低软骨生成的能力在一系列涉及 CD14+滑膜单核 / 巨噬细胞的实验中得到了进一步的测试[29]。当单层培养的 C28 /I2 软骨细胞系分别经 M1 和 M2 条件培养基处理时发现,与 M1 型巨噬细胞共培养后,MMP-2、MMP-13、RUNX2和 ADAMTS-5 等软骨降解基因表达相比对照组上调,并且许多与软骨细胞肥大表型相关的促炎因子如 IL-6、IL-8、IL-12 表达增多,引起糖胺聚糖酶释放增加;而与 M2 型巨噬细胞共培养后成软骨标志物如 SOX9、ACAN 的表达明显上调,软骨降解标志物无明显变化,M2 条件培养基的结果表明,M2 型巨噬细胞能阻止软骨细胞向肥大表型分化。虽然 M2 条件培养基处理不影响降解基因,但在非炎症条件下,该刺激能显著提高成软骨基因表达水平。
2. 引起关节内低级别炎症:M1 极化巨噬细胞可以通过引起关节内低级别炎症参与 OA 发病[30]。OA 在过去被认为是身体的正常磨损,免疫系统受到影响较小,但现在普遍认为 OA 是一种影响整个关节的低级别炎症性疾病[31]。在炎症阶段,M1 巨噬细胞被招募并产生高水平的促炎细胞因子和趋化因子,如 TNF-α、IL-1 和 IL-6,模式识别受体 ( PRR ),如 Toll 样识别受体 ( TLRs ) 和节点样受体 ( NLRs ) 识别病原体相关分子模式 ( PAMPs ) 和损伤相关分子模式 ( DAMPs ),从而激活下游炎症信号通路,如 NF-κB 信号,诱导大量释放促炎细胞因子和趋化因子[32]。组织病理学的研究表明,在 OA 组织标本中,免疫细胞浸润很常见。OA 的生物标志物研究也证实,外周血或关节液中的炎症细胞因子 ( 如 IL-1β 和 TNF-α ) 水平明显高于健康对照组。Benito 等[33]利用 MRI 影像学技术发现 OA 患者的弥漫性滑膜炎与软骨破坏呈正相关,并且膝关节滑膜炎症程度还可以预测 OA 的预后。Topoluk 等[25]在创建的体外 OA 滑膜液和 OA 软骨共培养 15 天模型中发现,在这 15 天内滑膜巨噬细胞及其 M1 / M2 极化状态在体外持续存在,并且 M1 与 M2 型巨噬细胞之比可达到5.4~7.4∶1,使用细胞因子阵列检测 OA 共培养微环境中发现,与共培养 0 天时相比,促炎介质如 IL-1α、IL-1β、IL-6、IL-8、TNF-α 以及包括 MIP-1、CCL-5、GM-CSF在内的趋化因子和 ADAMTS-4 可以维持不降,而抗炎细胞因子 IL-10 和 IL-13 随着共培养时间的延长而显著降低,并且 MMP-9 和 MMP-13 等破坏软骨基质的基质金属蛋白酶显著增加。OA 滑膜液与 OA 软骨体外共培养表明,在促炎环境下,软骨细胞存活率和软骨糖胺聚糖含量显著下降,这也表明 M1 极化巨噬细胞可形成关节内低级别炎症状态引起 OA,但其具体通路机制需要进一步研究。这些发现共同表明 OA 是一种持续的慢性炎症状态,而滑膜巨噬细胞是 OA 炎症反应和破坏反应的关键效应细胞[33]。
3. 影响软骨细胞合成分解代谢:M1 型极化巨噬细胞可以通过旁分泌影响软骨细胞合成和分解代谢参与 OA 发病。关节软骨细胞的激活包括异常增殖和增生性分化,是OA 发生和发展的关键。M1 型极化巨噬细胞可以直接产生高水平的炎性细胞因子,如 IL-1、IL-6 和 TNF-α 等,促进肥大软骨细胞分化和成熟,在 OA 软骨变性过程中发挥重要作用。这是 M1 型巨噬细胞分泌的 R-spondin-2 ( Rspo2 )蛋白激活软骨细胞中的 β-环蛋白途径造成的[27]。M1 型巨噬细胞分泌的 Rspo2 还能通过诱导关节软骨细胞终末分化,降解基质蛋白多糖和关节软骨参与影响 OA 进展。
4. 影响间充质软骨干细胞分化:M1 型巨噬细胞可以通过分泌细胞因子影响间充质软骨干细胞分化参与 OA 发病[34]。间充质干细胞是一种有希望在 OA 中修复软骨损伤的细胞类型,但 M1 型巨噬细胞显著降低了间充质干细胞的 COL2 和 ACAN 等成软骨基因表达,从而抑制了间充质干细胞向软骨细胞的分化和软骨修复,间接促进 OA 的发展。
基于上述四种极化巨噬细胞参与 OA 发生发展途径,笔者还发现巨噬细胞极化过程由若干条不同通路介导,其中起关键作用的是哺乳动物雷帕霉素 ( mammalian target of rapamycin,mTOR ) 通路[35]。mTOR 是细胞代谢的中枢调节因子,包含 2 个复合物,分别是 mTORC1 和 mTORC2。大量证据表明 mTORC1 信号在 OA 发展过程中对调节滑膜巨噬细胞向 M1 极化有重要作用[27]。滑膜巨噬细胞mTORC1 激活时伴有 M1 型巨噬细胞极化增强,并且贯穿于 OA 的发展过程中,而当巨噬细胞 mTORC1 失活时则可增强 M2 型巨噬细胞极化,阻止 OA 进展[36-37]。mTORC1在 OA 的发病和进展中也起着非常重要的作用,滑膜巨噬细胞中 mTORC1 活跃时可使软骨发生退行性变,还可以通过分泌 VEGF,刺激关节软骨下层血管生成,一定程度上促进 OA 进展。进一步研究滑膜巨噬细胞极化的机制和巨噬细胞极化对 OA 造成影响的潜在机制可能是预防和治疗OA 的关键。
三、巨噬细胞极化与 OA 治疗
巨噬细胞有很强的可塑性,其表型表达取决于它们所处微环境。它们可以转化为释放促炎因子引发炎症的 M1 亚型,也可以转变为产生抗炎因子促进组织再生的 M2 亚型。在 OA 中,M1 型巨噬细胞数量增多会上调ADAMTS-4、MMP-13 的表达,加重 OA 患者的骨赘形成和软骨损伤,而 M2 型巨噬细胞增多则可能缓解 OA 的发展。鉴于不同亚型的巨噬细胞在 OA 中的作用不同,使巨噬细胞受到合适的刺激,促使 M1 型巨噬细胞向 M2 型巨噬细胞转化,有希望减轻 OA 的进展,这对 OA 的治疗具有很大意义,未来针对滑膜巨噬细胞表型的治疗策略可能成为缓解或治疗 OA 的方法之一。
1. 间充质干细胞:有证据表明,干细胞能够通过将巨噬细胞转移到 M2 表型来调节炎症[38]。Topoluk 等[25]在体外建立了共培养 OA 软骨和 OA 滑膜液 15 天模型,在此过程中,使用氯磷酸盐清除巨噬细胞,使得 M1 / M2 从7.4∶1 下降到 4.3∶1,滑膜巨噬细胞总数约减少 84%,发现 OA 软骨的破坏程度也明显减弱,这说明了促进巨噬细胞表型转化可能是缓解 OA 的可行治疗方案。研究者将人羊膜间充质干细胞 ( hAMSCs ) 和人脂肪干细胞 ( hADSCs )分别与 OA 软骨直接接触共培养后发现,hAMSCs 比hADSCs 更能有效地促进 OA 滑膜巨噬细胞向 M2 表型转移,来维持软骨细胞活力,减轻 OA 进展。这可能与 hAMSCs 能保存 OA 软骨糖胺聚糖 ( GAG ) 和羟脯氨酸( HYP ) 含量缓解软骨损伤有关[25]。Topoluk 等也发现,将OA 软骨细胞、巨噬细胞 ( M1 / M2 ) 和胎盘间充质干细胞共培养后,胎盘间充质干细胞可以降低 M1 / M2 值,增加软骨细胞活性和糖胺聚糖的产生,缓解 OA 的进展,这可能与在共培养液中加入前列腺素 PGE2、TGF-β 或者吲哚胺 2,3-二氧化酶 ( IDO ) 等的作用有关[39-41],具体机制需在今后研究中进一步分析[25]。
2. 白细胞介素类:有研究发现 IL-4 能抑制脂多糖对小鼠单核巨噬细胞的刺激[42],减少巨噬细胞分泌 IL-1、IL-6、TNF-α、M-CSF、iNOS 等促炎细胞因子,降低 M1 /M2 值;而去除 IL-4 后 M1 / M2 值升高,骨溶解现象也增强[43],其降低 M1 / M2 的能力可能对缓解 OA 进展发挥作用。还有研究报道,IL-10 能促进巨噬细胞向 M2 亚型分化,甚至可能实现 M1 型巨噬细胞向 M2 型巨噬细胞的转化[44]。IL-10 对巨噬细胞极化状态的影响可能与 IL-10 抑制了 Janus 激酶 / 信号转导子和转录激活子 ( Janus kinase /signal transducer and activator of transcription,JAK / STAT ) 1以及 NF-κB p65 信号通路,增强了 JAK / STAT3 信号通路的活性有关[45-46]。
3. 有机、无机化合物:近年来研究发现有越来越多的有机、无机化合物有希望在 OA 治疗中得到应用。其中消退素 D1 ( Resolvin D1 ) 是源自促分解脂质介质家族中的 Ω-3 多不饱和脂肪酸[47],已被证明是能够在体内或体外炎症性疾病中,通过 G 蛋白耦联受体 ALX / FPR2 和GPR32[48-49]将巨噬细胞从促炎状态转变为抗炎状态的潜在介质。除此外,Kerschenmeyer 等[50]研究发现无机化合物硫酸化海藻酸盐可以通过减少 M1 型巨噬细胞基因表达标志物 TNFA、CXCL10、CCR7 等的表达和从蛋白水平降低TNF-α 的表达来减少 M1 型巨噬细胞极化,从而下调促炎标志物,可能是有效控制 OA 的潜在药物。
4. 中药类:近年发现有一些中药可以在巨噬细胞极化中发挥作用。Pal 等[51]研究发现萝卜硫素 ( sulfora-phane,SFN ) 可以通过调节细胞表面生物标志物来调节巨噬细胞的可塑性,将单核细胞转化为特定的 M2 型巨噬细胞或将 M1型巨噬细胞转化为 M2 型巨噬细胞,从而改善单核 / 巨噬细胞水平的病理严重程度,是改善 OA 的潜在药物之一。
总之,极化巨噬细胞可以通过多种方式参与 OA 发病,而巨噬细胞极化过程也包括了 JAK / STAT、PI3K /AKT、MAPK、JNK 以及当前研究较多的 mTOR 等诸多信号通路。巨噬细胞极化过程中的多个相互交织的信号通路以及参与 OA 发生进展的多种方式是 OA 单靶点治疗至今没有确切疗效的原因。清楚了解巨噬细胞的特定治疗靶点对于制订涉及巨噬细胞活化的治疗策略至关重要。促使巨噬细胞向 M2 型巨噬细胞分化或者促使 M1 型巨噬细胞向 M2 型巨噬细胞转化,可能是一种有效缓解 OA 进展的方式,消退素 D1、硫酸化海藻酸盐和萝卜硫素等正是针对此机制下缓解 OA 的潜在治疗药物,但其具体疗效还需在临床上进一步验证。在未来的研究中,进一步探究极化巨噬细胞在 OA 中的作用机制以及筛选更多能促使M1 型巨噬细胞向 M2 型巨噬细胞转化的药物具有重要的临床意义。
