骨质疏松的影像学与骨密度诊断专家共识
2020-09-23中华医学会放射学分会骨关节学组中国医师协会放射医师分会肌骨学组
中华医学会放射学分会骨关节学组 中国医师协会放射医师分会肌骨学组
中华医学会骨科学分会骨质疏松学组 中华医学会影像技术学分会骨密度学组
骨质疏松症是一种以骨量减少、骨密度减低,导致骨脆性增加、易发生骨折为特点的全身性疾病[1-2]。随着我国人口老龄化,骨质疏松症日益引起大家的重视。我国进行的以双能 X 线吸收仪 ( dual-energy X-ray absorptiometry,DXA ) 测量骨密度的大样本流行病调查显示我国 50 岁以上人群中,男性和女性年龄标准化骨质疏松症患病率分别为 6.46% 和 29.13%[3],目前我国现有男性骨质疏松症患者超过 1000 万,女性超过 4000 万[3-4]。骨质疏松性骨折 ( 脆性骨折 ) 是骨质疏松症的严重临床后果,好发于脊柱、髋部和腕部等,具有很高的致残率和致死率,造成严重的社会医疗负担,威胁人民健康[5-7]。
X 线片、CT、MRI 和核医学等影像检查结果以及DXA、定量 CT ( quantitative computed tomography,QCT ) 等骨密度测量结果是骨质疏松症的诊断、风险预测和疗效评价的主要依据[2,8]。目前我国各医疗机构中骨密度测量设备分散在不同的科室,缺乏系统的检查规范和诊断专家共识,影响学术发展和患者就诊体验。为规范骨质疏松症影像检查和骨密度测量,提高我国骨质疏松症影像学 ( 骨密度 ) 诊断水平,中华医学会放射学分会骨关节学组、中国医师协会放射医师分会肌骨学组、中华医学会骨科学分会骨质疏松学组、中华医学会影像技术学分会骨密度学组和中华放射学杂志编辑部组织相关领域专家,参考国内外大量文献、最新进展和多学科指南,并结合了中国学者的最新研究结果、专家意见以及我国医疗实际情况,经过充分讨论,并采纳多数专家意见,制定了《骨质疏松的影像学与骨密度诊断专家共识》,旨在为放射科及临床医务人员规范开展骨质疏松症诊疗提供指导依据。
一、骨质疏松症定义及分类
骨质疏松症是以骨量减少、骨质量受损及骨强度降低,导致骨脆性增加、易发生骨折为特征的全身性骨病。骨质疏松症分为原发性和继发性两大类。原发性骨质疏松症包括绝经后骨质疏松症 ( I 型 )、老年骨质疏松症 ( II 型 )和特发性骨质疏松症 ( 包括青少年型 )。继发性骨质疏松症指由任何影响骨代谢的疾病和 ( 或 ) 药物及其他明确病因导致的骨质疏松[2,8]。本专家共识主要适用于原发性骨质疏松症的诊断。
二、骨质疏松症的危险因素及临床表现
骨质疏松症多发生于绝经后女性及老年男性,骨丢失本身没有症状[9],发生骨折后,骨质疏松症的临床表现主要有疼痛、身高降低、驼背、活动受限及呼吸系统受累等[2,8,10]。由于骨质疏松早期无症状,因此更加需要对个体的骨质疏松症发病风险进行评估,并根据风险高低进行分层管理。目前已有多种风险评估方法,常用的有国际骨质疏松基金会 ( International Osteoporosis Foundation,IOF ) 提出的“一分钟骨质疏松症风险评估”[2]以及骨折风险评价工具,如骨折风险评价 ( fracture risk assessment,FRAX ),后者综合考虑了骨密度、年龄、身高、体重和骨质疏松危险因子等参数[2,11],可直接登录其网站自行评估 ( https://www.sheffield.ac.uk/FRAX/tool.aspx?country=2 )。另外,骨折风险评价方法需要参考人群骨折的发病率,而我国人群的骨折发病率尚不明确,所以该评估方法在我国的应用有很多限制,还需建立适合我国人群的标准。
三、骨质疏松症诊断原则
骨质疏松症的诊断原则是将病史、危险因素、临床表现、影像学检查和骨密度测量、实验室检查相结合,提示骨质疏松且合并有临床表现,才能称为骨质疏松症。其中,影像学检查和骨密度测量具有重要价值。一旦影像学检查 ( X 线片、CT、MRI 和骨扫描 ) 确诊脆性骨折,无论骨密度结果是否达到骨质疏松诊断标准,即可诊断骨质疏松。而在发生脆性骨折之前,诊断骨质疏松的主要依据是骨密度测量结果。
骨质疏松症诊断需鉴别原发性、继发性或特发性骨质疏松,参考年龄、性别、病史、临床表现、实验室检查和影像学检查进行判断。实验室生化指标可以反映人体骨形成和骨吸收情况,有助于骨质疏松症的诊断分型和鉴别诊断,以及早期评价对治疗的反应;但生化指标本身不能单独用于诊断骨质疏松症[2,12]。
四、影像学检查方法选择
1. X 线片:X 线片是最常用的检查方法。骨质疏松在X 线片上可以表现为骨小梁稀少,骨密度降低,但这些影像表现受主观因素影响大,对早期的骨丢失不敏感。若X 线片提示骨丢失,需进一步行骨密度测量检查。骨质疏松性骨折,尤其是椎体骨折的诊断,X 线片是首选方法,可以显示椎体变形和骨折情况。需要注意,因骨质疏松性骨折可以是轻微骨折、机能不全性骨折等X线片不易显示的类型,故建议采用 X 线片结合 CT 和 ( 或 ) MRI,避免漏诊、误诊。
2. CT:CT 也是诊断骨质疏松常用的影像学检查方法。CT 图像为断面解剖,避免了 X 线片的组织重叠投影问题,还可以进行多平面重组 ( multi-planar reconstruction,MPR ),显示细微骨折更敏感。同时,CT 检查在鉴别骨质疏松与骨肿瘤等其他骨病变方面很有帮助。
3. MRI:MRI 无辐射,组织对比度高,可较 X 线片和 CT 更灵敏地显示骨髓早期改变,并可用于显示骨髓水肿,在显示细微骨折以及与骨肿瘤和感染的鉴别方面有独特优势。由于普通 MRI 的信号没有标准化,故测量信号强度本身没有意义。MRI 的脂肪抑制序列可以精准测量骨髓的脂肪含量,可以用于骨质疏松评价和研究,但目前还不能用于骨质疏松症的诊断。
4. 核医学检查:放射性核素骨显像对原发性骨质疏松症本身的诊断并无明显价值,椎体压缩性骨折时表现为较强的线状特征性显像剂分布浓聚带。骨显像定量分析可用于骨质疏松症治疗过程中的疗效监测。鉴于代谢性骨病( 如甲状旁腺机能亢进、Paget 病、肥大性肺性骨关节病、骨软化症等 ) 患者骨显像呈现特征性影像学表现,骨显像可用于继发性骨质疏松症的诊断与鉴别诊断。此外,SPECT 和 SPECT / CT 显像 ( 如甲状腺显像、甲状旁腺显像、肾功能显像等 )、18F-FDG PET / CT 或 PET / MR 显像对继发性骨质疏松症的诊断与鉴别诊断具有价值。
五、脆性骨折的诊断
1. 脆性骨折概述:脆性骨折是骨质疏松症的严重并发症,以脊柱最常受累,髋部骨折的临床危害最严重;此外还包括腕部科雷氏骨折和肱骨近端骨折等[2]。与普通外伤性骨折不同,脆性骨折无明确外伤史,或仅有轻微外伤( 站立或更低的高度跌倒为轻微外伤 ) 史。
脆性骨折的诊断需具备以下 3 条:① 无外伤史或仅有轻微外伤史;② 影像学检查有明确的诊断骨折的证据;③ 除外继发性骨质疏松。
2. 脊柱脆性骨折的诊断:脊柱椎体骨折在骨质疏松患者中很常见,约 3 / 4 的患者无外伤史或临床症状。常用的影像学检查方法为胸、腰椎正侧位 X 线片。推荐 60 岁以上的老年人常规拍摄胸、腰椎正侧位 X 线片,以确定是否存在椎体脆性骨折[5]。CT 扫描侧位定位像和 DXA 侧位成像也可用于发现椎体骨折变形,但较难判断椎体终板皮质骨折等细微改变,建议用于筛查。胸腹部正侧位 X 线片,尤其是脊柱正侧位 X 线片都可以发现椎体变形,但由于对脊柱骨折的诊断认识不足,所以临床工作中常被漏诊[13]。CT 和 MRI 对椎体骨折显示更佳,并有助于鉴别诊断。MRI 还能显示椎体是否存在骨髓水肿,可用于鉴别新发性或者陈旧性骨折。
脊柱脆性骨折主要表现为椎体变形,目前常用的评价方法是 Genant 半定量分析法。根据肉眼判断椎体高度或面积的减少程度分为 0 ( 正常 )、1 度 ( 轻度 )、2 度 ( 中度 )和 3 度 ( 重度 )[14]。Genant 半定量分析法比较适合脊柱脆性骨折流行病学研究或药物疗效观察[14]。一般认为 Genant 1 度及以上均应判断为骨折。在临床实际工作中,肉眼判断椎体高度降低的程度可能存在误差。Wáng 等[15]建议仔细阅片,观察有无终板和 ( 或 ) 皮质骨折 ( endplate and / or cortex fracture,ECF ),有 ECF 者为椎体骨折,而无 ECF者为椎体变形。在椎体高度下降程度相同时,椎体骨折较椎体变形有更高的进一步骨折风险。严重的和多发的椎体骨折提示更高的进一步骨折风险。
3. 非脊柱部位的脆性骨折:非脊柱部位的脆性骨折常有明确的外伤史,建议常规行 X 线和 CT 检查。由于此类患者骨密度减低和组织重叠的原因,所以 X 线片可能会漏诊,CT 检查较 X 线片敏感,必要时可选择 MR 检查,常规加脂肪抑制像,可显示骨髓水肿情况。
六、骨密度测量方法与诊断标准
骨密度测量技术主要是利用 X 线通过不同介质发生不同程度衰减的原理,对人体骨矿含量、骨密度以及体质成分进行分析的无创性测量方法。目前常用的骨密度测量技术主要包括 DXA、四肢 DXA ( peripheral DXA,pDXA ) 和QCT 等。
1. 骨密度检查设备管理和人员资质:基于 X 线的骨密度测量仪应按照国家辐射装置管理相关规定对设备的场地和操作人员资质进行管理,符合放射工作人员各项要求。建议骨密度从业人员参加中华医学会、中国医师协会或国际权威机构等学术组织主办的培训,保证从业人员操作规范及质量控制的水平。
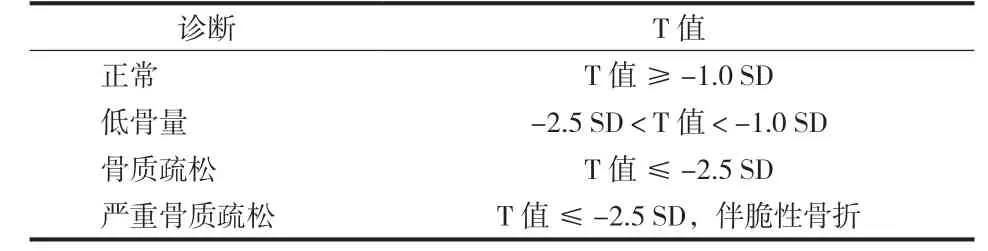
表 1 双能 X 线吸收仪骨质疏松症诊断标准
2. DXA:DXA 采用高、低两种能量的 X 线对人体进行扫描,测量骨密度。DXA 辐射剂量低,是目前应用广、认可度高的骨密度测量方法。DXA 测量结果包括骨矿含量、面积和骨密度等参数,在临床使用中多数使用骨密度。DXA 测量的是面积骨密度,单位为 g / cm2。DXA常用的测量部位是腰椎、髋部和前臂。DXA 诊断骨质疏松采用的是 T 值,应根据同种族、同性别的正常参考数据进行计算[2]。正常人参考数据库应选用中国人群、多中心、大样本并具有一定人群代表性的数据库,如 2018 年我国疾病控制中心组织的流行病学调查或大样本健康人群数据[2-3,16]。不同 DXA 机器的测量结果不能直接用于比较,可经过严格的质量控制和横向校准换算后进行对比[17]。DXA 诊断骨质疏松症的标准为:测量腰椎和髋部2 个部位,选择第 1~4 腰椎椎体、髋部的股骨颈和全髋3 个感兴趣区 ( region of interest,ROI ),以 3 个 ROI 中最低的 T 值进行判断。如果上述 2 个部位中 1 个部位测量受限( 如严重变形、内固定、植入物干扰等 ),则增加“非优势侧前臂”作为补充测量部位,取桡骨远端 1 / 3 为 ROI。骨质疏松的 DXA 诊断标准 ( 表 1 ) 由世界卫生组织 ( World Health Organization,WHO ) 专家组制定,也被称为 WHO标准。WHO 标准是根据白人绝经后女性随访人群数据计算出来,理论上只适用于白人女性,但随后多国的骨质疏松诊疗指南都采用了该标准,并推广到老年男性。我国的骨质疏松学术组织也推荐该标准在中国绝经后女性和老年男性中使用[2,8]。WHO 标准适用于绝经后女性和 50 岁以上男性,对于儿童、青少年、绝经前女性以及 50 岁以下的男性,其骨密度水平的判断建议采用同种族人群数据库计算出的 Z 值,将 Z 值 ≤ -2.0 SD ( 标准差 ) 定义为“低于同年龄段预期范围”或低骨量[2,8]。健康儿童、青少年参考数据库应选用来自中国人群的数据[18]。对于卵巢切除的女性可以等同于“绝经后女性”,采用 T 值进行判断。
根据 DXA 的平面投影成像技术原理,由于 DXA 测量的面积骨密度受体重、脊柱侧凸、骨质增生、椎体骨折和血管钙化等因素影响,而这些因素会降低骨密度测量的准确性,并漏诊一定比例的骨质疏松患者[19-20],所以当临床遇到体重过低、严重肥胖、脊柱侧凸或脊柱退变等情况时,建议采用 QCT 测量骨密度以减少上述因素的影响,或行影像检查寻找是否存在脆性骨折的证据。
3. QCT:QCT 是利用临床 CT 扫描的数据,结合 QCT的质量控制和分析系统测量骨密度的方法[21]。由于不同CT 机型扫描获得的骨组织 CT 值差异较大,所以 CT 值不能直接用于骨密度测量[22]。QCT 可以测量多个部位的骨密度,目前应用较多的是脊柱和髋部。对于椎体,QCT 测量的是椎体中央松质骨的体积骨密度,单位 mg / cm3,其测量结果不受脊柱退变、侧凸和体重等因素的影响[23]。而对于髋部,QCT 采用的是类似 DXA 的测量技术 ( CTXA hip ),其测量的面积骨密度与 DXA 测量的骨密度相当[24-25]。QCT如果单独使用,其辐射剂量高于 DXA,所以在临床使用中,QCT 测量应尽量与临床 CT 扫描同步进行,而且推荐使用低剂量技术。
国际临床骨密度学会 ( International Society for Clinical Densitometry,ISCD ) 和美国放射学院 ( American College of Radiology,ACR ) 分别于 2007 年[26]和 2018 年[27]提出腰椎 QCT 诊断骨质疏松症的标准,并在中国人群中得到验证,证明适用于中国人群[28]。中国老年学与老年医学学会骨质疏松分会和中华医学会健康管理学分会联合 11 家学会于 2018 年制定了《中国定量 CT ( QCT ) 骨质疏松症诊断指南 ( 2018 ) 》[29],该 QCT 诊断标准被《中国老年骨质疏松症诊疗指南 ( 2018 ) 》和《骨质疏松症中西医结合诊疗指南》采纳[8,30]。腰椎 QCT 骨密度骨质疏松诊断标准为:采用腰椎 QCT 骨密度绝对值进行诊断,取 2 个腰椎椎体松质骨骨密度平均值 ( 常用第 1 和第 2 腰椎 ),具体诊断标准见表 2[29]。QCT 与 DXA 测量股骨颈和全髋骨密度相关程度高,文献报道决定系数 ( R2 ) 为 0.81~0.88[24-25],提示 QCT 测量髋部骨密度与 DXA 测量结果等效,推荐以髋部 QCT 骨密度诊断骨质疏松的标准采用 DXA 的诊断标准,即 T 值 ≤ -2.5 SD,同样要求采用中国人群正常参考值[29,31]。目前的 QCT 诊断标准是根据美国 Mindways QCT系统,采用 120 kV 管电压测量结果数据制定的。
该诊断标准适用于绝经后女性和老年男性。年轻人出现骨密度降低时,应进一步检查除外继发原因。QCT 诊断骨质疏松只需做 1 个部位即可,根据临床需要选择做脊柱或髋部。
QCT 骨密度测量还可以用于疗效监测、骨折风险预测和骨科手术前的规划。在实际工作中,QCT 多与临床常规CT 扫描同步进行,因此不会额外增加辐射剂量和扫描时间。低剂量肺癌筛查胸部 CT 扫描结合 QCT 已作为中华医学会健康管理学分会健康管理推荐的应用[29]。
4. 外周骨密度测量:外周骨密度测量方法均为采用X 线进行的骨密度测量,包括外周 QCT ( peripheral QCT,pQCT )、pDXA、单能骨密度测量、放射吸收法等。测量部位主要包括前臂、跟骨、指骨和胫骨远端等。pQCT 还可用于评价骨结构。外周骨骼周围软组织相对较少,因此测量结果的准确性和重复性较好。同时,外周骨密度测量设备的 X 线剂量较小,对患者和设备操作人员都有较好的防护。超声测量无辐射,其参数虽与骨密度有相关性,但并不是骨密度。目前,外周骨密度测量不建议用于骨质疏松症的诊断和药物疗效判断,仅可用于骨质疏松风险人群的筛查和骨质疏松性骨折的风险评估。此类外周骨密度测量设备具有仪器小、设备便携易于搬运、设备费用低、辐射剂量低、扫描程序简单等优势,适用于中小医院或社区人群的骨质疏松症筛查[2]。

表 2 腰椎定量 CT 骨密度诊断骨质疏松标准
七、新技术及发展方向
1. DXA 骨小梁评分 ( trabecular bone score,TBS ):TBS是由 DXA 腰椎正位图像衍生出的纹理参数,是 DXA 的新测量指标,可提供骨密度之外的信息。50 岁以上男性人群的 TBS 与髋部和主要脆性骨折风险相关。TBS 不能单独用于决定是否进行骨质疏松治疗,可与骨折风险评价工具FRAX 和骨密度联合使用[32]。TBS 的临床应用价值尚需进一步研究[33-34]。
2. 能谱 CT 和双源 CT:能谱 CT 和双源 CT 是目前 CT技术的一个发展方向,采用双层探测器、高低能 量瞬间切换或双球管技术实现[35-36],可以区分不同的物质成分( 如钙、水和脂肪等 ),可用于骨骼钙含量的定量分析和骨密度测定。研究表明,采用双层探测器 CT 扫描机的能谱骨密度测量结果与 QCT 测量结果具有很好的一致性和相关性 (R=0.987 )[36]。能谱 CT 辐射剂量较高,建议将骨密度作为临床能谱 CT 扫描的后处理方法之一,不建议单独扫描。能谱 CT 或双源 CT 测量骨密度在骨质疏松症诊疗方面的价值尚需进一步研究确定。
3. MRI 脂肪测量:除可显示骨质疏松症的骨骼形态学改变之外,MRI 还可通过多种方法对骨质疏松进行评估。高分辨率 MRI 可用于评估骨微结构,单体素质子 MR 波谱和基于化学位移编码的水脂肪成像可测量骨髓质子密度脂肪分数,扩散加权成像可评估骨髓内水分子扩散,超短回波 ( ultra time of echo,UTE ) 成像技术可评估皮质骨等[37]。虽然目前大多数研究表明基于 MRI 获得的各种定量参数与骨密度关系密切,尤其是骨髓脂肪含量与骨密度呈显著负相关,但目前 MRI 尚无法提供直接的骨密度数值,且临床研究群体较小,缺乏 MRI 定量参数与骨密度的纵向研究。此外,骨的 MRI 评估受限于设备、技术条件等因素,成本也较昂贵[38],因此 MRI 目前尚不适用于临床骨质疏松的诊断或筛查,只可作为骨质疏松骨折评价及骨质疏松鉴别诊断的重要补充。
随着未来 MR 设备及技术的进一步完善优化,结合目前大数据及人工智能 ( artificial intelligence,AI ) 的发展,骨髓脂肪 MRI 定量测量及 UTE 骨皮质定量评估等均有望开发成为骨质疏松诊断或筛查的新策略。
4. 核医学显像技术:PET / CT 和 SPECT / CT 同机的CT 也可用于 QCT 测量,即扫描前对同机 CT 进行 QCT 校正,扫描完成后不仅可得到常规 PET / CT 和 SPECT / CT的图像,还可以得到 QCT 的骨密度测量数据,可作为骨质疏松症的诊断和疗效观察的重要依据;同时还可以获得肝脏脂肪、腹部皮下脂肪、内脏脂肪、四肢肌肉的 QCT数据,为进一步指导临床诊疗提供更多有价值的信息。
5. AI:随着计算机技术的快速发展,AI 在各个领域都得到广泛应用。AI 在骨质疏松症的应用刚刚起步,但已显示出良好的应用前景[39]。首先,AI 在骨质疏松性脊柱骨折的检测方面具有良好的应用价值。可以采用 X 线片、CT、MRI 或 DXA 的侧位图像,利用 AI 技术做椎体骨折的自动化检测,已有初步研究证实了其可行性[40-41]。其次,AI 在骨密度测定方面也有良好的应用前景。初步研究表明,利用脊柱 CT 图像结合 AI 技术可以自动测量椎体的 CT 值或骨密度值,同时还可测量脂肪和肌肉面积、肌肉密度等[42-43]。此外,AI 还可用于预测骨折风险[44]。鉴于 AI 在上述骨质疏松症诊断方面具有广泛的应用前景,应加大该方面的研究力度。
6. 骨折风险预测:骨折是骨质疏松症的严重并发症,严重影响患者生活质量。在临床工作中,最好选择骨折高危人群进行干预以预防骨质疏松性骨折的发生。如何预测骨折风险一直是骨质疏松研究的热点和难点。目前,骨密度测量结果作为骨质疏松症诊断和疗效监测的主要指标,大量随访数据证明 DXA 测量的骨密度降低可增加骨折的风险;还可利用骨质疏松症危险因素进行骨折风险预测,如骨折风险预测工具 ( FRAX )。但这些指标的预测效果并不理想,需要进一步研究更准确的骨折风险预测方法。我国目前缺乏长期随访的队列研究,因此改进研究预测骨折风险的方法,如建立随访队列、采用 DXA 或 QCT 骨密度测量、结合危险因素等,具有重要的意义。
八、本专家共识要点
1. 对于绝经后女性和老年男性,如果影像学有明确骨质疏松性骨折征象,不论骨密度结果如何,可以诊断骨质疏松和骨质疏松性骨折。
2. DXA 测量腰椎和髋部,采用中国人正常值数据库,如果 T 值 ≤ -2.5 SD,诊断为骨质疏松。
3. QCT 腰椎体积骨密度<80 mg / cm3,诊断为骨质疏松。QCT 髋部测量结果采用 DXA 诊断标准。
4. 骨密度测量结果符合骨质疏松,合并脆性骨折,诊断为严重骨质疏松。
5. 四肢骨密度测量可以用于骨质疏松筛查,但不能用于诊断。
执笔者:程晓光 ( 北京积水潭医院 )、徐文坚 ( 青岛大学附属医院 )、吴艳 ( 郑州大学第一附属医院 )、刘华 ( 北京市公安局法医鉴定中心 )、黄晨 ( 烟台市烟台山医院 )
共识专家组成员 ( 按姓氏拼音排序 ):艾松涛 ( 上海交通大学医学院附属第九人民医院 )、白荣杰 ( 北京积水潭医院 )、蔡香然 ( 暨南大学附属第一医院 )、常晓丹 ( 大连大学附属中山医院 )、陈建宇 ( 中山大学孙逸仙纪念医院 )、陈君蓉 ( 四川省骨科医院 )、陈爽 ( 复旦大学附属华山医院 )、陈伟 ( 陆军军医大学第一附属医院 )、程敬亮( 郑州大学第一附属医院 )、程晓光 ( 北京积水潭医院 )、崔建岭 ( 河北医科大学第三医院 )、戴畅 ( 新疆生产建设兵团第一师阿拉尔医院 )、邓微 ( 北京积水潭医院 )、丁昌懋 ( 郑州大学第一附属医院 )、丁长伟 ( 中国医科大学附属盛京医院 )、丁建平 ( 杭州师范大学附属医院 )、杜霞 ( 贵州医科大学附属医院 )、冯卫华 ( 青岛大学附属医院 )、高剑波 ( 郑州大学第一附属医院 )、高延征 ( 河南省人民医院 )、高兴军 ( 河南省信阳中心医院 )、龚沈初 ( 南通市第一人民医院 )、龚向阳 ( 浙江省人民医院 )、何波 ( 昆明医科大学第一附属医院 )、何涌 ( 桂林医学院第二附属医院 )、洪国斌 ( 中山大学附属第五医院 )、胡凌 ( 中华放射学杂志编辑部 )、黄晨 ( 烟台市烟台山医院 )、黄明芊 ( 美国纽约西奈山医院 )、黄振国 ( 中日友好医院 )、郎宁 ( 北京大学第三医院 )、雷新玮 ( 天津市第一中心医院 )、李春霖 ( 解放军总医院第二医学中心 )、李春燕 ( 广西医科大学第一附属医院 )、李娜 ( 北京积水潭医院 )、李绍林 ( 中山大学附属第五医院 )、李小明 ( 华中科技大学同济医学院附属同济医院 )、李永丽 ( 河南省人民医院 )、李真林( 四川大学华西医院 )、林强 ( 北京协和医院 )、林祥涛 ( 山东省立医院 )、刘华 ( 北京市公安局法医鉴定中心 )、刘吉华 ( 青岛大学附属医院 )、刘力 ( 北京市公安局法医鉴定中心 )、刘树学 ( 广东省中山市中医院 )、刘霞 ( 北京大学人民医院 )、柳林 ( 吉林大学中日联谊医院 )、陆勇 ( 上海交通大学医学院附属瑞金医院 )、吕维富 ( 中国科技大学第一附属医院 )、马立恒 ( 广东药科大学附属第一医院 )、马强 ( 首都医科大学附属北京友谊医院 )、马远征 ( 解放军总医院第八医学中心 )、牛金亮 ( 山西医科大学第二医院 )、潘诗农 ( 中国医科大学附属盛京医院 )、钱占华 ( 北京积水潭医院 )、强永乾 ( 西安交通大学第一附属医院 )、任翠萍 ( 郑州大学第一附属医院 )、宋英儒 ( 广西医科大学附属东医院 )、谈伟 ( 四川省骨科医院 )、汤光宇 ( 同济大学附属上海市第十人民医院 )、涂占海 ( 福建医科大学附属第一医院 )、王晨光 ( 海军军医大学附属长征医院 )、王亮 ( 解放军总医院第八医学中心 )、王玲 ( 北京积水潭医院 )、王绍武 ( 大连医科大学附属第二医院 )、王巍 ( 哈尔滨医科大学第一附属医院 )、王岩 ( 解放军总医院第一医学中心 )、王毅翔 ( 香港中文大学医学院 )、王植 ( 天津市天津医院 )、吴艳 ( 郑州大学第一附属医院 )、徐浩 ( 暨南大学附属第一医院 )、徐文坚 ( 青岛大学附属医院 )、徐正扬 ( 解放军总医院第一医学中心 )、杨本涛 ( 首都医科大学附属北京同仁医院 )、杨海涛 ( 重庆医科大学第一附属医院 )、杨吉刚 ( 首都医科大学附属北京友谊医院 )、杨炼 ( 华中科技大学同济医学院附属协和医院 )、杨敏洁 ( 深圳市人民医院 )、姚伟武 ( 上海交通大学医学院附属同仁医院 )、应奇峰 ( 浙江省人民医院 )、于静红 ( 内蒙古医科大学第二附属医院 )、郁万江 ( 青岛市立医院东院 )、袁慧书 ( 北京大学第三医院 )、曾献军 ( 南昌大学第一附属医院 )、曾自三 ( 广西医科大学第一附属医院 )、查云飞 ( 武汉大学人民医院 )、张朝晖 ( 中山大学附属第一医院 )、张国伟 ( 烟台市烟台山医院 )、张联合 ( 武警浙江省总队杭州医院 )、张琳琳 ( 中华放射学杂志编辑部 )、张嵘 ( 中山大学肿瘤防治中心 )、张伟 ( 河北医科大学第三医院 )、张晓东 ( 南方医科大学第三附属医院 )、张燕 ( 北京协和医院 )、张智海 ( 中国医科大学航空总医院 )、赵衡 ( 南华大学附属第一医院 )、郑卓肇 ( 清华大学附属北京清华长庚医院 )、周全 ( 南方医科大学第三附属医院 )、邹月芬 ( 南京医科大学第一附属医院 )
利益冲突所有作者均声明不存在利益冲突
志谢本共识制定过程中先后 3 次召开专家论证会,有 40 名国内外该领域知名专家参与并对共识提出修改意见,确保了共识的权威性和科学指导价值,在此对大家的辛勤付出致以深深的谢意!中华医学会放射学分会主任委员金征宇教授、候任主任委员刘士远教授,中华医学会骨质疏松与骨矿盐疾病分会章振林主任委员,中国医师协会放射医师分会王振常会长,中华医学会骨科学分会田伟前任主任委员、张英泽主任委员、刘强教授,中华医学会影像技术分会付海鸿主任委员、李真林候任主任委员和《中华放射学杂志》编辑部张琳琳主任、《中华骨科杂志》编辑部胡永成主任等领导和专家们积极倡导与推动了本共识的组织和写作,在此致以诚挚的感谢!
